力学刺激对体外保存软骨活力影响的实验研究
曲鹏玮,亓建洪,韩运宁,周路,谢地,张凯红,毕懿康
力学刺激对体外保存软骨活力影响的实验研究
曲鹏玮,亓建洪,韩运宁,周路,谢地,张凯红,毕懿康
271016 泰安,泰山医学院运动医学研究所
对体外保存猪膝关节软骨施加滚压力学刺激,探究力学刺激对软骨组织活力的影响。
利用滚压力学加载装置可以为骨软骨组织提供含有组织培养液的环境,并进行仿生的力学刺激。用骨软骨取材器械体外无菌获取猪膝关节软骨,于培养液保存过程中施加力学刺激(1.5 和4.0 MPa)后在第 2 周检测软骨的细胞存活率、蛋白多糖表达、组织形态学、杨氏模量。
1.5 MPa 组显示最高的软骨细胞存活率、蛋白多糖含量与杨氏模量,组织形态表现良好,差异有统计学意义(< 0.05);与静态对照组相比,4.0 MPa 组上述指标下降(< 0.05),形态学表现较差。
对体外保存软骨施加适宜的滚压力学刺激,能在2 周时间提高软骨细胞存活率,增强细胞外基质表达,并提升生物力学性能,为组织库软骨保存技术提供一种新方法。
软骨,关节; 细胞外基质; 力学刺激; 体外保存
关节软骨是一种柔软的结缔组织,在滑膜组织中能减少摩擦、缓冲压力、保护软骨下骨,并且能传递力学信号[1]。软骨组织无血管,自我修复力差。同种异体骨软骨移植(osteochondral allografts,OCAs)没有供区二次手术创伤,能用于修复大面积软骨损伤,远期临床疗效较为理想[2]。骨软骨组织移植前需要进行大约 2 周的微生物检测过程,在组织培养保存过程中,软骨细胞活性随时间而降低。提高移植软骨细胞活力、延长有效保存时间成为研究的难题和热点,研究主要集中在优化培养液成分、探索保存温度等方面[3]。人体关节软骨承受着持续的力学载荷。生物力学在软骨的发育、病理生理过程发挥十分重要的作用,力学载荷通过复杂的方式调控软骨细胞和细胞外基质的代谢活动[4]。流体静压力、轴向压缩等力学形式都已不同程度地应用于压力相关的软骨细胞层面的实验研究,旨在促进软骨细胞分化与细胞外基质表达[5]。本研究利用课题组研制的模拟膝关节生理运动的滚压力学加载装置,对体外保存关节软骨施加不同水平的滚压力学刺激,通过对软骨细胞存活率、基质含量、力学性能等评估,探究力学刺激对体外保存软骨组织活力的影响。
1 材料和方法
1.1 材料
健康六月龄、体重 100 kg 猪的新鲜后肢购自泰安市屠宰场;DMEM 培养液购自美国 Gibco 公司;乙二胺四乙酸(EDTA)、苏木素、伊红购自美国 Solarbio 公司;番红 O、二乙酸荧光素(FDA)、溴化乙锭(EB)购自美国 Sigma 公司;骨软骨移植器械为美国 Arthrex 公司产品;3343 型力学测试仪为美国 Instron 公司产品;Eclipse-80I 型光学/荧光显微镜为日本 Nikon 公司产品;VT1000 型振荡切片机、RM2235 型切片机为德国 Leica 公司产品。
1.2 方法
1.2.1 骨软骨组织获取 遵照无菌手术原则对猪膝关节皮肤用碘伏消毒,确保关节囊完整,铺洞巾。用外科解剖刀行膝关节正中切口,离断髌韧带、前后交叉韧带,完全暴露关节面。用专用手术器械获取股骨髁负重区直径为 8 mm,长为 10 mm 的带有软骨下骨的骨软骨标本 90 枚,取材中给予软骨 PBS 冲洗保持湿润,之后将骨软骨底面修平,PBS 冲洗去除残余脂肪与骨髓组织,放入无菌器皿中备用。
1.2.2 力学刺激与分组 利用课题组研制的滚压力学加载装置对软骨组织进行力学刺激,该装置已获得实用新型专利。装置包括调速电机、传动轮、摩擦架、滚筒等。其工作原理是:在无菌条件下将软骨组织块放在含组织液的装置内,通过调速电机带动传动轮、摩擦架在软骨组织块上做往返运动,同时底部滚筒旋转,从而实现对软骨组织块施加滚压力学载荷。根据前期研究,本次实验分 3 组,每组 30 个标本,A 组为静态对照组,在 DMEM 培养液中静态保存,B 组为 1.5 MPa 组,C 组为 4.0 MPa 组,B 组和 C 组软骨在 DMEM 培养液保存,第 1、7 天将软骨置于加载装置内并施加滚压力学刺激,每次 30 min,3 个组均隔天更换 DMEM 培养液,在第 14 天检测软骨相关指标。
1.2.3 观察与检测
1.2.3.1 软骨细胞存活率 去除标本的软骨下骨,保留软骨,PBS 冲洗,使用振荡切片机垂直于软骨表面,将软骨组织行厚度 30 μm 切片,置于 EP 管内,滴加 5 mg/L 的 FDA 和 50 mg/L 的 EB 各 500 μl,混匀后放入恒温箱,37 ℃避光孵育 15 min,洗后从 EP 管中取出平铺于载玻片上,使用荧光显微镜在 450 nm 波长激发光下进行观察。FDA/EB 荧光染色后,胞膜完好的活细胞显绿色,死细胞显红色;100 倍视野下随机选择拍照,用 Image J 软件对图像内的绿、红色细胞计数并计算细胞存活率。
细胞存活率(%)= 活细胞数/细胞总数 × 100%
1.2.3.2 番红 O 染色 4% 多聚甲醛固定骨软骨 24 h,然后流水冲洗,置入 10% EDTA中脱钙2 周。梯度酒精脱水,二甲苯透明,石蜡包埋,行 5 μm 厚度石蜡切片。脱蜡,梯度酒精水化,0.001% 固绿染色 5 min,盐酸酒精分化 10 s,0.1% 番红 O 染色 10 min。梯度脱水,透明,封片并镜检。在40 倍视野下拍照,使用 Image-Pro Plus 软件分析番红染色的积分光密度值()。
1.2.3.3 HE 染色 石蜡切片脱蜡至水,苏木素染色 10 min,自来水洗,碳酸锂饱和溶液复蓝数秒,伊红染色 3 min,水洗,梯度酒精脱水,透明,封片并镜检。
1.2.3.4 杨氏模量检测 使用英斯特朗力学测试机来检测软骨杨氏模量。去除软骨下骨,将直径 8 mm,厚度 2 mm 的软骨置于压力台,调节压力台至刚好不触及软骨。进行预调试,使软骨固有的粘弹性达稳定状态。设置加载速度 5 mm/min,保护压力 200 N,最大压缩量 40%,进行轴向加载实验,测定应力与应变,由系统自动采集数据,并计算样本在压缩量为 15% 时的杨氏模量。
1.3 统计学处理
2 结果
2.1 软骨细胞存活率检测
软骨 FDA/EB 荧光染色结果,绿色表示软骨活细胞,橙色或红色表示死细胞。1.5 MPa 组显示最高的绿色细胞比例,静态组显示较多的红色细胞,4.0 MPa 组红色细胞比例更高(图 1)。图像处理软件分析细胞组成比例显示,1.5 MPa 组细胞存活率高于静态对照组和 4.0 MPa 组,差异有统计学意义(< 0.05);4.0 MPa 组细胞存活率低于静态组,差异有统计学意义(< 0.05)(表 1)。
2.2 软骨番红 O-固绿染色观察
番红 O 与嗜碱性软骨结合显红色,反映基质中蛋白多糖分布。1.5 MPa 组全层着色好,其中深层最明显,证明蛋白多糖含量高;静态对照组着色较好,浅层淡染较明显;4.0 MPa 组基质整体淡染,深层也较明显(图 2)。软件分析(表 1)显示,1.5 MPa 组的值高于静态组和 4.0 MPa 组,差异有统计学意义(< 0.05);4.0 MPa 组的值低于其他两组,蛋白多糖成分较多流失,差异有统计学意义(< 0.05)。

图 1 软骨细胞 FDA/EB 荧光染色(× 100)(A:静态对照组;B:1.5 MPa 组;C:4.0 MPa 组)
Figure 1 FDA/EB fluorescent staining of chondrocytes (× 100) (A: Static control group; B: 1.5 MPa group; C: 4.0 MPa group)

表 1 软骨细胞存活率及软骨番红O 染色IOD值(,n = 10)
注:a与静态对照组比较,< 0.05;b与1.5 MPa 组比较,< 0.05。
Notes:a< 0.05 versus static control group;< 0.05 versus 1.5 MPa group.

图 2 软骨基质番红 O 染色(× 40)(A:静态对照组;B:1.5 MPa 组;C:4.0 MPa 组)
Figure 2 Safranin-O staining of cartilage matrix (× 40) (A: Static control group; B: 1.5 MPa group; C: 4.0 MPa group)
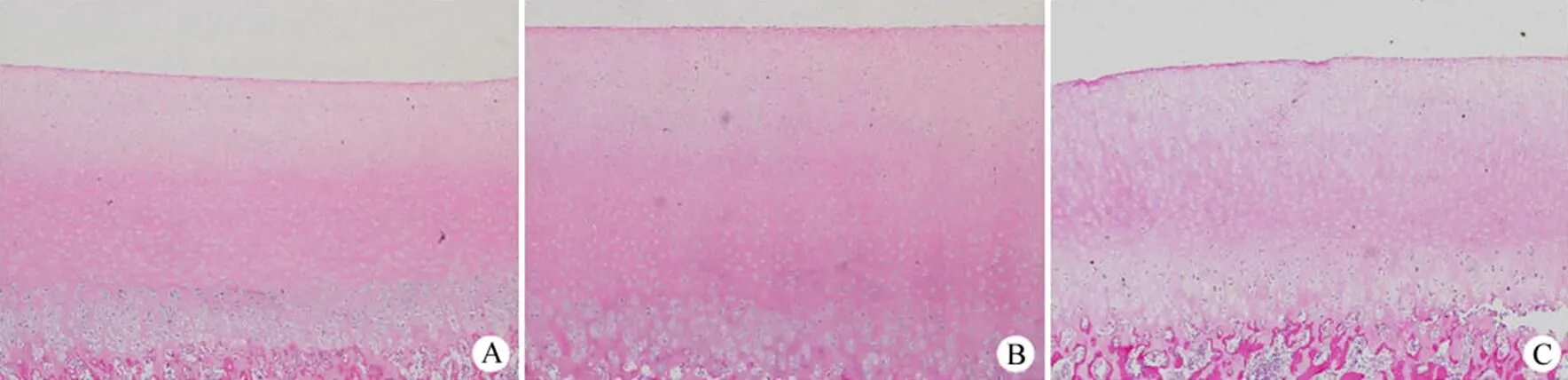
图 3 软骨 HE 染色观察(× 40)(A:静态对照组;B:1.5 MPa 组;C:4.0 MPa 组)
Figure 3 HE staining of cartilage tissues (× 40) (A: Static control group; B: 1.5 MPa group; C: 4.0 MPa group)
2.3 HE 染色结果
1.5 MPa 组软骨层次分明,表面平整,基质含量丰富,细胞数量正常,浅层细胞多为扁平样,体积较小,深层软骨细胞体积较大,位于透明状陷窝内,潮线完整;静态对照组软骨表面光滑,浅层细胞数下降,基质着色稍淡,潮线完整;4.0 MPa 组软骨表面粗糙,基质淡染较明显,软骨与下骨出现分离(图 3)。
2.4 软骨杨氏模量检测
软骨的负重能力可以通过检测杨氏模量来反映。当压缩率为 15% 时,第 14 天静态对照组软骨的杨氏模量为(6.78 ± 0.27)MPa,1.5 MPa 组软骨杨氏模量为(7.64 ± 0.35)MPa,4.0 MPa 组软骨杨氏模量为(6.27 ± 0.30)MPa,三组之间差异有显著性意义(= 71.25,< 0.001);LSD 检验结果,1.5 MPa 组杨氏模量高于静态对照组和 4.0 MPa 组,4.0 MPa 组低于静态对照组,有显著性差异(< 0.05)(图 4)。
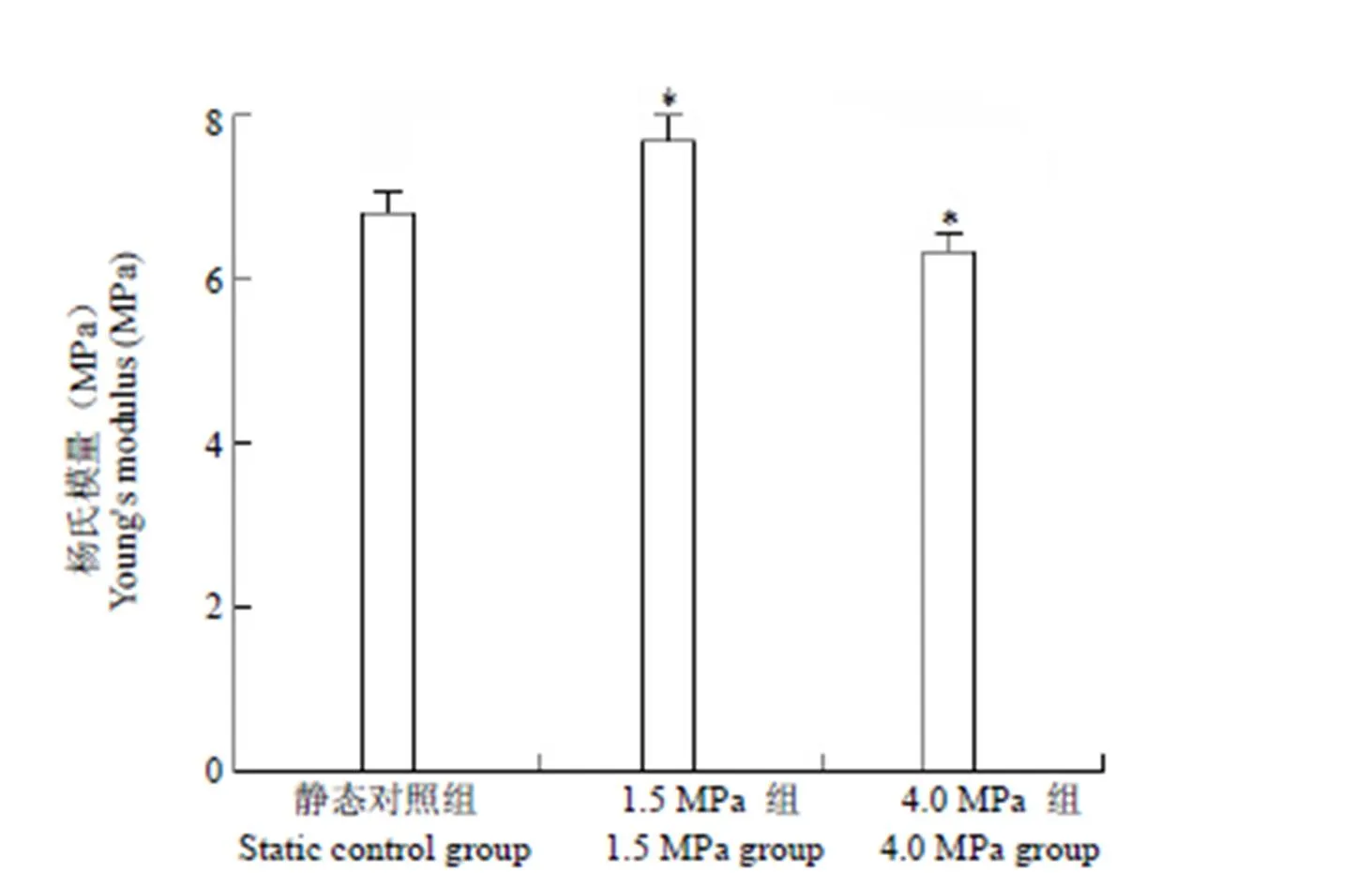
图 4 软骨杨氏模量检测(与静态对照组相比,*P < 0.05)
Figure 4 Young's modulus of cartilage tissues (*< 0.05 versus static control group)
3 讨论
同种异体骨软骨移植(OCAs)常用于治疗复杂的大范围软骨损伤,应用于运动员软骨损伤也取得较满意疗效[6]。要将这项技术全面推广,还需解决软骨供体问题和软骨组织体外保存技术问题。目前保存异体骨软骨组织更多采用组织培养法。在保存过程中,组织脱离了力学刺激,软骨组织活力不断降低。本实验尝试将力学干预应用于软骨体外保存过程中。
在生理状况下,关节软骨受到周期性的力学载荷刺激,力学作用形式包括流体静压力、剪切力、张力等,通过较为复杂的方式调控软骨细胞迁移、分化等代谢活动。力学刺激对维持软骨功能至关重要,但是负荷过多或不足都会带来有害影响,导致软骨退变。软骨组织工程中可通过对干细胞施加力学载荷而促进软骨化进程[7]。对于软骨细胞表型与基质代谢的维持,适当的力学刺激可产生正向影响,例如促进 SOX9 等软骨形成因子与基质成分表达[8-9],而不适宜的力学形式也可导致软骨细胞表型失衡[10]。本实验从软骨组织层次施加力学刺激探索其作用。人体膝关节内 3 ~ 5 MPa 的压力水平是常见的,正常行走时,膝关节内同时存在滚动与滑动,滚压载荷是活动状态下的正常力学载荷[11]。我们设计了模拟生理的滚压力学加载装置,提供轴向压缩力与剪切力的复合形式,在含有培养液的环境下,对体外保存的游离关节软骨给予一定的滚压力学刺激。有研究报道,对软骨细胞施加间歇性流体静压力(0.3 MPa,6 h/d)并培养 7 d,促进了蛋白多糖与 II 型胶原合成[12]。也有研究报道,对软骨细胞每 3 天施加一次拉伸力,每次30 min,第6 天较静态组出现明显的软骨细胞增殖,第 4 周促进了蛋白多糖合成,而施加拉伸力的频率为每天 1 次,则细胞轻微增殖,第 4 周未出现明显的基质成分提升,说明选择合适的刺激频率是重要的[13]。前期我们进行正交试验发现,1.5 MPa 的压力值能短时间内提高软骨的力学性能,本次设置了 1.5 MPa 与高压力水平 4.0 MPa,并从软骨活性方面进行研究。为了减小软骨染菌的可能,我们在第 1、7 天两个时间点进行每次 30 min 的力学干预,形成间歇性加载保存,观察应力刺激对软骨组织的影响。
通常用软骨细胞存活率来评价体外保存效果,细胞活性也作为衡量软骨移植修复效果的重要指标。研究显示,对软骨细胞施加压力(50% 强度,3 h/d)在第 1 天维持了较高的软骨细胞活力,2 周时间提高了 II 型胶原与蛋白聚糖的表达[14]。对软骨细胞施加频率为 2 Hz 与 3 Hz 的轴向压力(10%强度,24 h),促进了软骨细胞增殖,频率为 1 Hz时提高了蛋白多糖表达并维持了 7 d[15]。本实验第 14 天检测结果,1.5 MPa 组细胞存活率比静态保存组高,适宜的滚压力学刺激提升了软骨细胞活力,而4.0 MPa 组细胞存活率比静态组低,证明了 4.0 MPa 的应力水平为有害的力学形式,对软骨细胞产生破坏性作用。软骨中细胞比例为 1% ~ 5%,能合成蛋白多糖等基质成分。蛋白多糖积分光密度检测显示,1.5 MPa 组蛋白多糖表达高于静态组和 4.0 MPa 组,促进了基质表达,而 4.0 MPa 组蛋白多糖成分低于对照组,出现较大退化,4.0 MPa 为有害的载荷刺激,与细胞活性呈一致的趋势。HE 染色提示 1.5 MPa 组呈现较好的组织形态特点,细胞数目多,基质异染性较好,而 4.0 MPa 组基质淡染,骨与软骨连接疏松出现分离,提示发生损伤。关于力学影响软骨细胞的机制尚未完全阐明,研究报道力学刺激增加细胞内 Ca2+聚集,通过提高离子交换活动以及激活机械敏感通道,导致三磷酸肌醇等中间信号分子的产生而引起激酶级联反应[16],也有研究显示力学载荷激活了 MAPKs 信号通路而增强软骨细胞增殖[17]。
生物力学检测是反映关节软骨承载能力的一项重要指标,承载作用主要表现为抗压力和抗拉力,其中以抗压力显得尤为重要[18]。关节软骨呈粘弹性,杨氏模量可反映软骨的抗压性能。1.5 MPa 组的杨氏模量最高,呈现较好的生物力学性能,与力学刺激引起的基质上调密不可分。而 4.0 MPa 组软骨力学性能下降,验证了 4.0 MPa 为过大负荷。动物实验中常采取摘除半月板、切断交叉韧带等方式,可造成软骨受压过大而出现力学性能下降、骨性关节炎等表现,生理状况下适当的力学载荷才是有利的。
本实验对体外保存软骨在含组织培养液的环境中给予 1.5 MPa 适宜的滚压力学刺激,在 2 周的时间内提高了软骨细胞活力,增强细胞外基质表达,提升了生物力学性能。为组织库软骨保存提供了一种新思路,旨在提高软骨组织库利用率和关节软骨修复质量。本实验的不足之处是未进行力学刺激对软骨组织正向作用的机制探索。力学刺激方案(大小、时间等)的不断优化来提升正向作用的持续时间并探索相关机制是今后研究的重点。
[1] Alhadlaq HA, Xia Y, Hansen FM, et al. Morphological changes in articular cartilage due to static compression: polarized light microscopy study. Connect Tissue Res, 2007, 48(2):76-84.
[2] Raz G, Safir OA, Backstein DJ, et al. Distal femoral fresh osteochondral allografts: follow-up at a mean of twenty-two years.J Bone Joint Surg Am, 2014, 96(13):1101-1107.
[3] Qi J, Hu Z, Song H, et al. Cartilage storage at 4 degrees C with regular culture medium replacement benefits chondrocyte viability of osteochondral grafts in vitro. Cell Tissue Bank, 2016, 17(3):473-479.
[4] Responte DJ, Lee JK, Hu JC, et al. Biomechanics-driven chondrogenesis: from embryo to adult. FASEB J, 2012, 26(9):3614- 3624.
[5] DiFederico E, Shelton JC, Bader DL. Complex mechanical conditioning of cell-seeded agarose constructs can influence chondrocyte biosynthetic activity. Biotechnol Bioeng, 2017, 114(7): 1614-1625.
[6] Shaha JS, Cook JB, Rowles DJ, et al. Return to an athletic lifestyle after osteochondral allograft transplantation of the knee. Am J Sports Med, 2013, 41(9):2083-2089.
[7] Yu XM, Meng HY, Sun Z, et al. Bioreactor cultivation and mechanical stimulation for regeneration of tissue-engineered cartilage. ChinJ Tissue Eng Res, 2016, 20(2):185-190. (in Chinese)余晓明, 孟昊业, 孙振, 等. 生物反应器中的力学刺激促进组织工程软骨再生. 中国组织工程研究, 2016, 20(2):185-190.
[8] Diao HJ, Fung HS, Yeung P, et al. Dynamic cyclic compression modulates the chondrogenic phenotype in human chondrocytes from late stage osteoarthritis. Biochem Biophys Res Commun, 2017, 486(1):14-21.
[9] Nebelung S, Gavenis K, Rath B, et al. Continuous cyclic compressive loading modulates biological and mechanical properties of collagenhydrogels seeded with human chondrocytes. Biorheology, 2011, 48(5): 247-261.
[10] Liu Q, Hu X, Zhang X, et al. Effects of mechanical stress on chondrocyte phenotype and chondrocyte extracellular matrix expression. Sci Rep, 2016, 6:37268.
[11] Sun M, Lv D, Zhang C, et al. Culturing functional cartilage tissue under a novel bionic mechanical condition. Med Hypotheses, 2010, 75(6):657-659.
[12] Heyland J, Wiegandt K, Goepfert C, et al. Redifferentiation of chondrocytes and cartilage formation under intermittent hydrostatic pressure. Biotechnol Lett, 2006, 28(20):1641-1648.
[13] Fan JC, Waldman SD. The effect of intermittent static biaxial tensile strains on tissue engineered cartilage. Ann Biomed Eng, 2010, 38(4): 1672-1682.
[14] Jeon JE, Schrobback K, Hutmacher DW, et al. Dynamic compression improves biosynthesis of human zonal chondrocytes from osteoarthritis patients. Osteoarthritis Cartilage, 2012, 20(8):906-915.
[15] Tsuang YH, Lin YS, Chen LT, et al. Effect of dynamic compression on in vitro chondrocyte metabolism. Int J Artif Organs, 2008, 31(5):439- 449.
[16] Mizuno S. A novel method for assessing effects of hydrostatic fluid pressure on intracellular calcium: a study with bovine articular chondrocytes. Am J Physiol Cell Physiol, 2005, 288(2):C329-C337.
[17] Ren K, Ma Y, Huang Y, et al. Periodic mechanical stress activates MEK1/2-ERK1/2 mitogenic signals in rat chondrocytes through Src and PLCgamma1. Braz J Med Biol Res, 2011, 44(12):1231-1242.
[18] Haaparanta AM, Jarvinen E, Cengiz IF, et al. Preparation and characterization of collagen/PLA, chitosan/PLA, and collagen/chitosan/PLA hybrid scaffolds for cartilage tissue engineering. J Mater Sci Mater Med, 2014, 25(4):1129-1136.
Effects of mechanical stimulation on viability of cartilage preserved
QU Peng-wei, QI Jian-hong, HAN Yun-ning, ZHOU Lu, XIE Di, ZHANG Kai-hong, BI Yi-kang
Author Affiliation: Institute of Sports Medicine, Taishan Medical University, Taian 271016, China
To investigate the effects of mechanical stimulation on chondrocyte viability, by exerting rolling-sliding mechanical stimulation on the porcine articular cartilage preserved.
The rolling-sliding mechanical device used could provide an environment for osteochondral tissue containing culture medium, and applied bionic mechanical stimulation. The cartilage of porcine knee was obtainedunder sterile condition by a special osteochondral harvester and divided into three groups. Group A was prepared as static control group, and the cartilage was preserved in the culture medium statically. Group B was 1.5 MPa group, and group C was 4.0 MPa group. In group B and C, rolling-sliding mechanical stimulation was exerted 30 min each time on cartilage at day 1 and 7, during the preservation process in the culture medium. The culture medium was refreshed every 2 days in all the three groups. Experimental tests were performed on day 14, including the survival rate of chondrocyte, the expression of proteoglycan, histomorphology, and Young's modulus.
The highest chondrocytes survival rate, proteoglycan content and the young's modulus were observed in the 1.5 MPa group across all three groups, and the tissue morphology of group B was good (< 0.05). Compared with the static control group, the above index decreased in the 4.0 MPa group (< 0.05).
Exerting appropriate mechanical stimulation on cartilage can increase the survival rate of chondrocytes, enhance the expression of extracellular matrix, and improve the biomechanical properties of chondrocytes. This provides a new method for cartilage tissue bank.
Cartilage, articular; Extracellular matrix; Mechanical stimulation; In vitro preservation
QI Jian-hong, Email: jhqi7281@163.com
山东省自然科学基金(ZR2017LH018)
亓建洪,Email:jhqi7281@163.com
2017-12-25
10.3969/j.issn.1673-713X.2018.03.009

