广东地区梅毒螺旋体临床株的分离传代培养及非同义单核苷酸多态性检测
柯吴坚 黄涛 张君 吕萍 薛耀华 张晓辉 王柳苑 刘雅慧 郑和平
510009广州,南方医科大学皮肤病医院
不同个体感染梅毒螺旋体(Treponema pallidum,Tp)后临床表现和治疗反应各异[1],提示Tp感染过程中可能存在宿主遗传易感性或Tp基因致病性差异[2]。然而,大量梅毒宿主遗传易感性单核苷酸多态性(single nucleotidepolymorphisms,SNP)数据表明,宿主SNP与Tp遗传易感性均无显著相关[3-5]。因此Tp基因SNP导致的致病性差异将成为未来的研究热点[2,6]。我们从广东地区1例梅毒患者皮损中分离Tp临床株(命名为广东1株,简称GD1株),在兔睾丸中连续传代培养,通过目的基因DNA片段测序分析广东地区Tp基因编码区非同义SNP(non-synonymous SNP,nsSNP)位点突变,为后续GD1株全基因组测序奠定研究基础。
一、对象与方法
1.对象:患者为30岁男性,因阴茎无痛性溃疡9 d就诊。体检:阴茎表面多个浅表无痛性溃疡,伴双侧腹股沟淋巴结肿大。实验室检查:溃疡分泌物暗视野显微镜检查阴性,甲苯胺红不加热血清试验(TRUST)阴性,梅毒螺旋体明胶凝集试验(TPPA)阳性。7 d后复查溃疡暗视野显微镜检查阴性,TRUST阴性,TPPA 1∶160阳性。本研究通过南方医科大学皮肤病医院医学伦理委员会批准(批件号:GDDHLS-20170610),患者签署知情同意书。
2.GD1株的分离和传代培养:轻挤患者硬下疳皮损,用无针头5 ml注射器收集皮损中的浆液性渗出液,加入到含20%非感染兔血清中,立刻接种于3月龄、体重约3 kg、经梅毒螺旋体免疫荧光抗体试验(FTA)和性病研究实验室试验(VDRL)双重验证排除Tp感染的成年新西兰白兔双侧睾丸内,每个睾丸接种1 ml。待形成睾丸炎后,兔子处予安乐死,手术取睾丸,制备成菌悬液,采用暗视野显微镜、TP0548 PCR、测序和基因分型多重验证是否传代成功。取6 ml GD1菌悬液再次传代于3只新西兰白兔睾丸,剩余菌悬液采用500×g低速离心10 min,分离兔睾丸组织,吸取上清液后20 000×g离心30 min,去上清液,保留约0.2 ml浓缩GD1用于后续实验。重复以上步骤,直到获得足够实验GD1菌液。实验动物购于南方医科大学实验动物中心(合格证号:44002100005265)。动物实验经南方医科大学皮肤病医院动物管理及使用委员会批准,并参照实验动物管理和使用指南进行操作。
3.TP0548基因PCR、测序和分型:应用QIAamp DNA Mini试剂盒(德国QIAGEN公司)提取GD1菌悬液DNA,以Nichols标准株(美国华盛顿大学Sheila Lukehart教授馈赠)DNA为阳性对照,以分子水(molecular H2O,mH2O,美国Sigma公司)为阴性对照。PCR体系50 μl,模板DNA 5 μl、2.5 mmol/L dNTPs(美国Thermo公司)4 μl、10 × Go Taq PCR缓冲液(美国 Promega公司)5 μl、25 mmol/L MgCl2(美国Sigma公司)3 μl、20 μmol/L引物[生工生物工程(上海)股份有限公司合成,引物序列见表1]0.5 μl、5 U热启动Taq PCR聚合酶(美国Promega公司)0.5 μl、mH2O 31.5 μl。扩增条件:95℃预变性10 min;95℃变性1 min、60℃退火2 min、72℃延伸1 min,共45个循环;72℃延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳鉴定。PCR产物送生工生物工程(上海)股份有限公司测序,结果经BLAST验证。TP0548基因分型和nsSNPs分别采用BioEdit多重和双重序列比对分析。
4.泛影葡胺密度梯度离心法[7]纯化GD1株:将60%泛影葡胺(上海淮海制药厂)稀释成37.5%、25.0%、19.0%,于硝酸纤维管中依次加入1.5 ml 60%泛影葡胺、1 ml 37.5%泛影葡胺、1 ml 25.0%泛影葡胺和1 ml 19.0%泛影葡胺,最终形成非连续梯度。将步骤2获得的浓缩GD1株置于泛影葡胺非连续梯度离心液上层,20℃100 000×g离心45 min。离心后,在60%和37.5%泛影葡胺之间、37.5%和25.0%之间、25.0%和19.0%之间出现3条乳白色条带。选取菌量多的条带进行nsSNP检测。
5.TP0574 qPCR定量检测各层GD1株菌量[8-9]:参照步骤3分别提取各条带内GD1株基因组DNA。用LightCycler FastStart DNA MasterPLUS SYBR Green试剂盒(瑞士罗氏公司)检测各条带的GD1菌量,以Nichols标准株DNA为阳性对照,以mH2O为阴性对照,已知浓度的TP0574质粒标准品作为内参。PCR总反应体系为20 μl:5 μl待检测DNA样本、2 μl 20 μmol/L TP0574引物[生工生物工程(上海)股份有限公司合成,引物序列见表1]、4 μl 5 × Master Mix(瑞士罗氏公司)、9 μl mH2O。PCR反应条件:95℃预变性10 min;95℃变性10 s、60℃退火8 s、72℃延伸13 s,共45个循环;最后72℃延伸10 min。产物用LightCycler software(美国罗氏公司)分析。
6.PCR扩增TP0443和TP0584 nsSNPs:取纯化后的GD1株DNA作为模板,以Nichols株DNA为阳性对照,以mH2O为阴性对照,常规PCR扩增TP0443和TP0584 nsSNPs,引物序列见表1。50 μl PCR扩增反应试剂和扩增条件参照步骤3。扩增PCR产物经1.5%琼脂糖凝胶电泳鉴定。
二、结果
1.分离培养出GD1株:从梅毒患者硬下疳皮损分离到的Tp接种至新西兰白兔睾丸,约1个月形成睾丸炎,取睾丸制备菌悬液,经暗视野显微镜检查可见Tp(图1),表明成功从硬下疳分离出具有传染活性的临床Tp。
2.TP0548基因PCR、测序和分型结果:GD1菌悬液DNA经TP0548 PCR扩增,于361 bp处可见特异性扩增条带(图2)。经BLAST比对,确认为TP0548片段;经BioEdit多重序列比对,为TP0548分型中的f亚型。
3.TP0574 qPCR定量检测各层GD1株菌液浓度:以TP0574质粒标准品作为内参,qPCR定量检测各层GD1菌液浓度,结果发现,GD1株菌液在19.0%和25.0%层以及25.0%和37.5%层的浓度明显高于37.5%和60%层。
4.GD1株TP0443和TP0584 PCR和nsSNPs测序结果:GD1菌悬液DNA经TP0443和TP0584 PCR扩增产物分别为328 bp和301 bp(图3)。将GD1株测序结果与美国Nichols标准株进行nsSNPs位点比对,GD1株第469810位碱基由A突变为G(图4A),对应第120位编码氨基酸由苏氨酸→丙氨酸,导致TP0443基因出现nsSNP位点突变;634785位碱基由G突变为A(图4B),对应第314位编码氨基酸由丙氨酸→苏氨酸,导致TP0584基因出现nsSNP位点突变。
表1 梅毒螺旋体基因和非同义单核苷酸多态引物序列[7-9]
三、讨论

图1 梅毒螺旋体暗视野显微镜图(×40) 图2 梅毒螺旋体TP0548基因扩增产物电泳图 1:TP0548基因;2:阳性对照;3:阴性对照;4:标准参照物
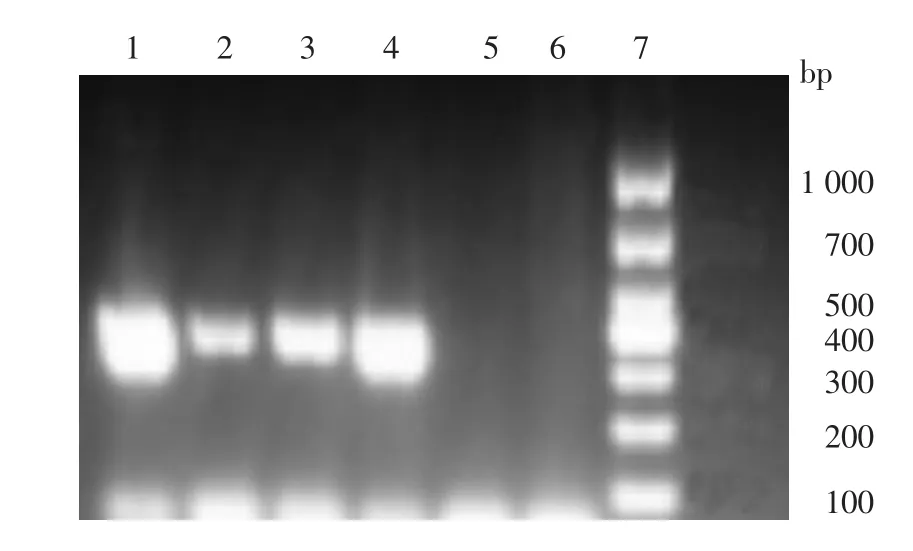
图3 梅毒螺旋体临床株与Nichils株TP0443和TP0584基因扩增产物电泳图 1:Nichils株TP0443基因;2:临床株TP0443基因;3:Nichils株TP0584基因;4:临床株TP0584基因;5:TP0443阴性对照;6:TP0584阴性对照;7:标准参照物

图4 梅毒螺旋体临床株TP0443、TP0584基因部分序列图4A:箭头所示为TP0443碱基发生A→G突变;4B:箭头所示为TP0584碱基发生G→A突变
Tong等[10]通过对厦门地区分离出的Amoy株进行全基因组序列分析发现,Amoy株与Nichols标准株、SS14、Mexico A、DAL-1和Chicago存在良好的基因组共线性关系,Amoy株与SS14高度同源。Sun等[11]通过比较6株上海地区、1株山西地区和1株安徽地区分离的Tp全基因组发现,8个菌株间存在329个SNPs,其中有5个为青霉素结合蛋白nsSNPs位点。广东地区梅毒菌株是否存在nsSNPs目前仍未知。本实验用泛影葡胺密度梯度离心法成功地从新西兰白兔睾丸组织中分离、纯化并获得高纯度的GD1株。通过比对GenBank中Nichols标准株与全球不同地区的11株临床分离株(DAL-1、SS14、Chicago、Mexico A、Sea81-4、UW074B、UW189B、UW228B、UW254B、UW391B和Amoy)全基因序列,共筛选出2个nsSNPs位点。nsSNPs检测结果证实,GD1株与美国Nichols株存在nsSNPs突变,该基因突变导致TP0443和TP0584的氨基酸序列出现改变。
国内外Tp菌株间的nsSNPs差异除了可用于Tp分子流行病学、传播机制和传播效应的研究,还为后续nsSNPs致病性差异比较、研究发病机制和Tp全基因组测序奠定基础。

