嫁接对梅花耐盐性的影响
杨佳鑫,遆羽静,罗燕杰,赵 靓,李庆卫
(花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,教育部林木花卉育种实验室,北京林业大学 园林学院,北京 100083)
梅(Prunusmume)属于蔷薇科李属(Prunus)或杏属(Armeniaca)。梅花原产中国,是中国传统名花,落叶观赏小乔木[1],早春开放,品种繁多,具有良好的观赏价值。2000年前梅已作为园林树木用于园林绿化,在中国园林应用中有着举足轻重的地位和影响。目前,张启翔等[2-4]研究了梅花品种及梅花杂交种根系的抗寒性,李庆卫等[5-6]进行了抗寒梅花品种区域试验,彭婷等[7-8]以梅花为试材对冷驯化植物中普遍存在的CBF/DREB1基因进行了研究,吕晓倩等[9-10]探讨了梅花耐热性,刘玉霞等[11]考察了高pH对梅花生长发育的影响,但尚未见梅花耐盐性研究的相关报道。
土壤盐碱化问题是全球最严重的环境问题之一,严重制约着社会和经济的发展。全球大约有8.31 亿hm2的土壤受到盐渍化的威胁,中国盐渍土总面积约3 600 万hm2,占全国可利用土地面积的4.88%,中国盐渍土主要分布在东北、华北、西北内陆地区以及长江以北沿海地带[12]。目前,抗寒梅花的繁殖推广呈现以北京为中心向“三北”地区辐射的趋势,在沈阳、兰州、延安、大庆、乌鲁木齐及赤峰等地都有梅花的栽植[13],因此梅花耐盐性研究在其向北繁殖推广过程中势必成为重要研究内容,同时随着中国盐碱地面积的不断扩大及土地盐碱化的日益加剧[14],梅花耐盐性研究对梅花在全国范围内繁殖推广都将具有重大意义。
梅花繁殖以嫁接为主,通过嫁接繁殖,可保持原有品种的观赏特性,其耐寒、生长快,且能提早开花[15]。梅花砧木通常选用梅(本砧)、毛桃、杏、李等树种的实生苗,杏砧耐寒力强,与杏梅类嫁接亲和性最好,是杏梅类梅花的主要砧木[16]。因此,本研究以杏梅系中一年生‘丰后’梅自根苗、山杏为砧木的‘丰后’梅嫁接苗以及山杏自根苗为试材,探讨NaCl胁迫后3类试材幼苗盐害程度以及部分生长和生理指标的变化,通过比较3种试材的抗盐性强弱,以探究嫁接对梅花耐盐性的影响,为其以后在盐碱地区的选择应用提供科学理论依据。
1 材料和方法
1.1 试验材料
以一年生‘丰后’梅自根苗、山杏为砧木的‘丰后’梅嫁接苗以及山杏自根苗(‘丰后’梅嫁接苗杏砧与山杏苗为同一批)为试材。采用单株盆栽方法,2017年3月份将长势相对一致的苗木栽植于规格为上口径30 cm、下口径20 cm、高30 cm的塑料花盆内,盆底布置托盘。培养基质由草炭土、珍珠岩、洗净河沙按2∶1∶1(体积比)的比例混合而成,每盆基质重量为7.5 kg。
1.2 试验设计
2017年6月上旬,试验苗进入旺盛生长期时,先将盆土控水1周,以使土壤干燥有利于施盐时盐分迅速扩散。试验土壤NaCl含量设置0.3%、0.6%、0.9%、1.2%、1.5%等5个浓度梯度,并以蒸馏水为对照(CK)。每处理设5次重复。待盆土干燥后,将定量的NaCl溶解后浇灌到所对应的处理中,盐分的添加分5 d完成,每天定量加入0.3%(根据盐与土壤质量比,即为22.5 g盐)的盐量,第1天往目标浓度为1.5%的盆中加0.3%的盐量,第2天往目标浓度为1.5%和1.2%的盆中加0.3%的盐量,第3天往目标浓度为1.5%、1.2%、0.9%的盆中加0.3%的盐量,第4天往目标浓度为1.5%、1.2%、0.9%及0.6%的盆中加0.3%的盐量,第5天往各目标浓度盆中均加0.3%的盐量,盐分添加的第5天为盐处理的开始(即盐处理第1天),并在盆下放置托盘,浇水后收集盆中流出的溶液,将溶液倒回盆内,以免盐分流失。苗木盐化处理后进行常规管理,定期浇水以维持土壤持水量在 60%~80%,处理35 d后结束试验。
1.3 测定指标及方法
1.3.1盐害指数NaCl处理后每7 d观察1次植株受害表现,第35天计算盐害指数(SI)和盐害率(P)。盐害分级标准为:0级. 无盐害症状;1级. 轻度盐害,有少部分叶尖、叶缘或者叶脉变黄;2级. 中度盐害,有大约1/2 的叶尖、叶缘焦枯;3级. 重度盐害,大部分叶尖、叶缘焦枯或落叶;4级. 极重度盐害,枝枯、叶落、最终死亡[17]。


1.3.2生理指标分别于试验前、试验第7、14、21、28、35天采取植物叶片样品。采用随机取样的方法,早晨取样,从植株不同方向取新稍中上部功能叶2~3片,取样后立即带回实验室处理,测定叶片相对电导率(RC)、丙二醛(MDA)含量、过氧化物酶(POD)活性和可溶性糖(SS)含量等生理指标。其中,相对电导率用电导率测定仪测定[18],丙二醛含量采用硫代巴比妥酸法测定[19],POD活性采用愈创木酚法测定[20],可溶性糖含量采用蒽酮比色法测[21]。
1.4 试验数据分析
数据计算用Excel 2012计算,绘图用SigmaPlot12.5,数据分析用SPSS22.0软件。
2 结果与分析
2.1 NaCl胁迫下‘丰后’梅及山杏的盐害指数和盐害率
如表1 所示,随着土壤中NaCl含量的增加,‘丰后’梅和山杏幼苗的盐害指数和盐害率均呈增大趋势,并均显著高于相应对照(P<0.05)。其中,在0.3%~0.6%低盐浓度处理时,‘丰后’梅自根苗增加幅度较大,而‘丰后’梅嫁接苗和山杏苗增加幅度较小;在0.9%~1.5%高盐浓度处理时3种植物的增加幅度均较小,但‘丰后’自根苗的盐害指数和盐害率分别在0.9%、0.6%盐浓度处理下就达到100%,而‘丰后’嫁接苗分别在1.2%、0.9%盐浓度处理,山杏分别在1.5%、0.9%盐浓度处理下才达到100%。同时,‘丰后’梅自根苗的盐害指数在0.3%~1.2%NaCl处理、盐害率在0.3%~0.6%NaCl处理时与‘丰后’梅嫁接苗和山杏之间均存在极显著差异(P<0.01),而‘丰后’梅嫁接苗与山杏之间始终无显著性差异;3种植物的盐害指数在NaCl含量为0.3%~0.9%时达50%以上,而其盐害率在NaCl含量为0.3%~0.6%时达到50%。因此,将盐害指数和盐害率结合起来反映其受盐害情况将更客观。根据Logistic方程求得‘丰后’梅自根苗、‘丰后’梅嫁接苗和山杏的盐害指数在50%时的土壤NaCl含量分别是0.545%、0.695%和0.705%。由此可说明,3种植物耐盐性由强到弱依次为山杏>‘丰后’梅嫁接苗>‘丰后’梅自根苗。
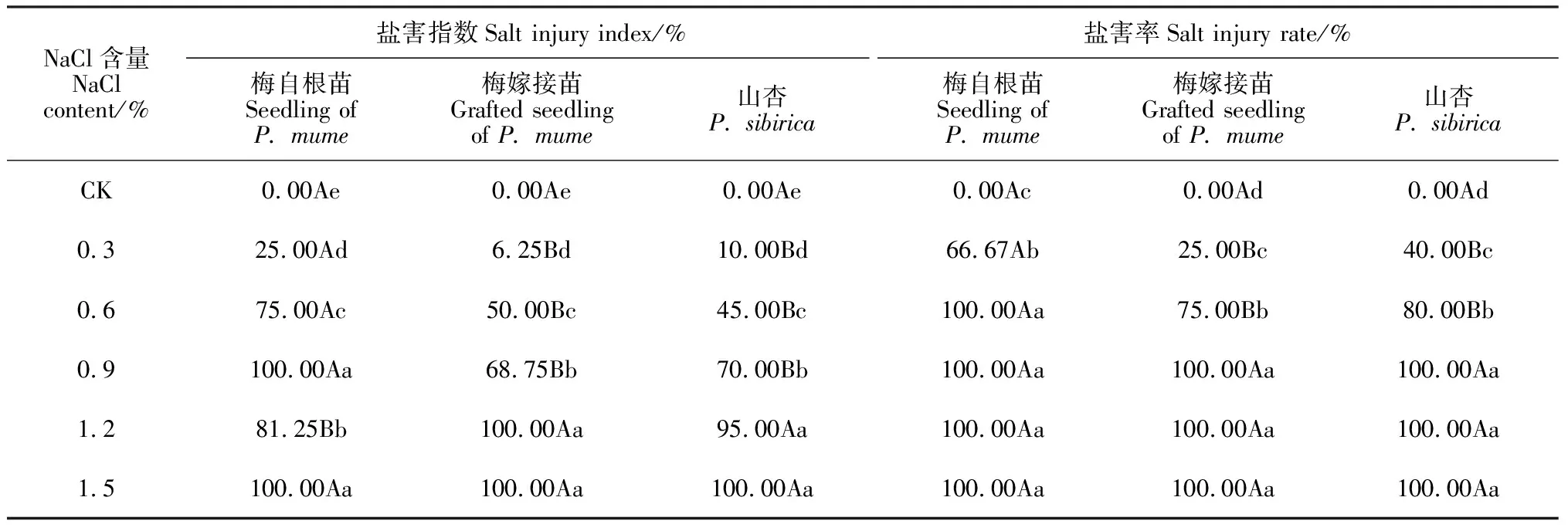
表1 NaCl处理后‘丰后’梅及山杏的盐害指数和盐害率
注:同行括号内大写字母表示不同植物间在0.01水平差异极显著;同列小写字母表示盐处理间在0.05水平上的差异显著
Note: Different capital letters in line stand for significant difference among species at 0.01 level, while different normal letters within the same row indicate significant difference among salt treatments at 0.05 level
2.2 NaCl胁迫对‘丰后’梅及山杏叶片相对电导率的影响
在NaCl胁迫下,3种植物叶片相对电导率均随着NaCl胁迫时间的延长总体呈现先上升后下降的趋势, ‘丰后’梅自根苗下降幅度较小,而‘丰后’梅嫁接苗和山杏苗下降幅度较大,并且3种材料在各浓度盐胁迫处理大多高于同期对照(图1)。
首先,‘丰后’梅自根苗叶片相对电导率在胁迫第7天时, 0.3%盐浓度处理缓慢增加至40%左右,0.6%~1.5%处理随着盐胁迫浓度的增加而迅速增大,且均达到80%以上,比CK显著增高4.77~5.70倍,其中的0.6%、0.9%及1.5%处理均达到高峰值;在胁迫第14~28天时,各浓度处理组叶片相对电导率变化均较小,在小范围内波动,其中的0.3%、1.2%处理在处理第28天达到高峰值;在胁迫35 d后,1.2%和1.5%处理组植株叶片全部脱落,无法继续测定其相对电导率值,但二者高峰值分别为97.75%、99.32%,盐胁迫程度最大;0.3%~0.9%处理的相对电导率值均有所下降,但下降幅度不大。
其次,‘丰后’嫁接苗叶片相对电导率值在各浓度处理0~21 d时逐渐上升。其中,1.2%和1.5%处理持续急剧上升;0.3%~0.9%处理在0~14 d缓慢增加,21 d时急剧上升;0.3%~1.5%处理均在21 d时达到高峰值(72.60%~94.93%),比CK增加了3.94~5.45倍。在盐胁迫28~35 d时, 1.2%和1.5%处理组相对电导率由于植株叶片全部脱落无法测定,0.3%~0.9%处理的相对电导率值均急剧下降,至胁迫35 d时分别下降到35.29%、24.07%、30.96%。
再次,山杏苗叶片相对电导率值在盐胁迫第7天时,0.3%盐浓度处理与CK无明显差异,0.6%~1.5%浓度处理则迅速上升;在盐胁迫第14天时,各处理叶片相对电导率均有不同程度增加,其中1.5%处理达到最高峰值(95.44%);在胁迫第21天时,0.3%~1.2%盐处理相对电导率缓慢上升,其中的0.9%和1.2%处理达到最高峰值,分别为92.20%和94.06%;在胁迫第28天时,0.3%和0.6%处理相对电导率上升到最高峰值(分别为80.89%和86.68%),而0.9%处理开始下降;至胁迫第35天时,除了1.2%和1.5%处理组由于植株叶片全部脱落无法测定外,0.3%~0.9%处理的相对电导率值均急剧下降,分别下降到46.01%、51.33%、38.46%。
2.3 NaCl胁迫对‘丰后’梅及山杏MDA叶片含量的影响
随着NaCl胁迫时间的延长,‘丰后’梅自根苗叶片MDA含量呈现上升-下降-上升-下降的变化趋势,‘丰后’梅嫁接苗和山杏均为先上升后下降的趋势(图2)。
首先,‘丰后’梅自根苗叶片MDA含量各处理随着时间的延长变化趋势比较一致。它们均在第7天时出现一个小高峰,其中的1.2%处理达到最高峰值(14.758 mmol/g);在第14天时,各处理MDA含量均有所下降;到第21天时,各处理MDA含量又逐渐上升,其中的1.5%处理达到最高峰值(15.426 mmol/g);至处理第28天时,0.3%~0.9%处理MDA含量均达到最高峰值(13.794~22.243 mmol/g),其中的0.6%处理峰值最高,比同期CK增加1.77倍;在处理第35天时,0.3%和0.6%MDA含量分别下降至13.374和13.338 mmol/g,而0.9%~1.5%处理组植株叶片全部脱落,无法继续测定其MDA含量。
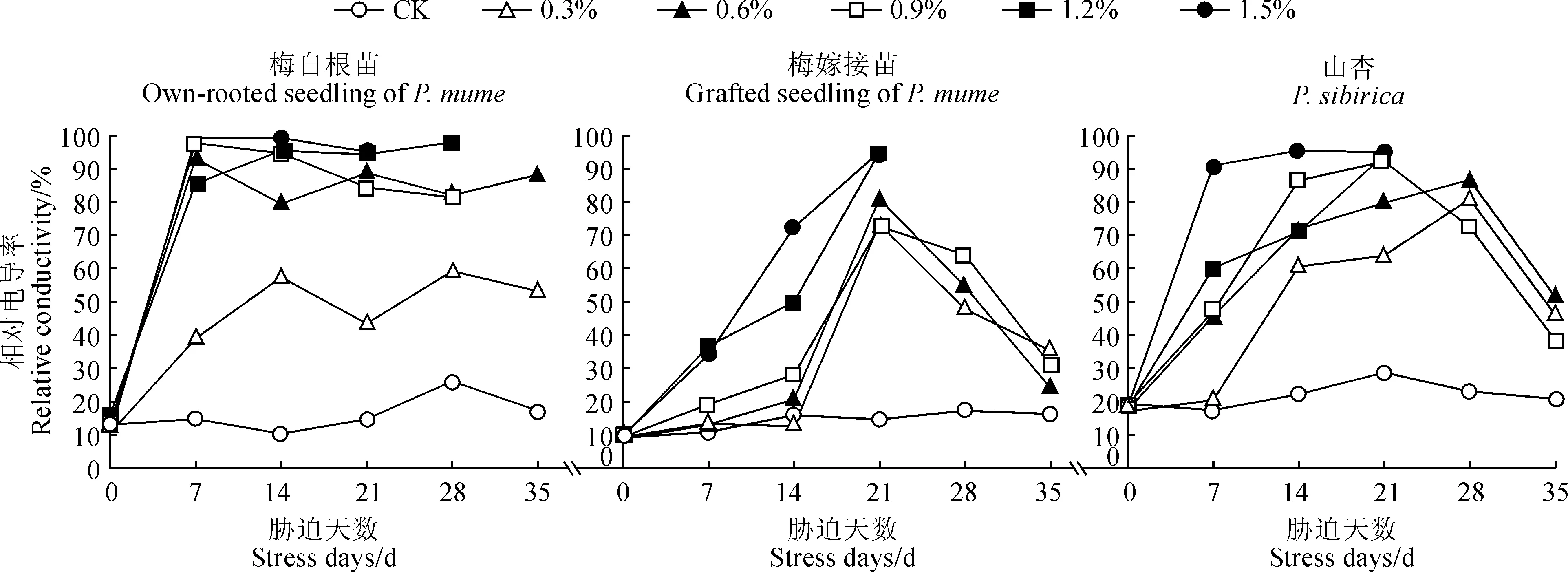
图1 盐胁迫下‘丰后’梅及山杏叶片相对电导率的变化Fig.1 Changes in relative conductivity of P. mume‘Feng hou’and P. sibirica under salt stress
其次,‘丰后’梅嫁接苗MDA含量在各浓度盐胁迫0~14 d均急剧上升, 0.3%~0.9%处理在第14天时达到最高峰值(23.454~28.589 mmol/g),比CK增加0.906~1.099倍;处理第21天时,1.2%和1.5%处理MDA含量达到最高峰值(分别为31.173和28.543 mmol/g),比CK分别增加1.559和1.343倍,而0.3%~0.9%处理急剧下降;至处理第28~35天时,0.3%~0.9%处理MDA含量继续下降,但下降幅度较小,最后分别下降至14.898、11.939、11.964 mmol/g,但0.3%处理仍高于同期CK,而0.6%和0.9%处理比同期CK分别下降了4.5%和4.3%。
再次,山杏苗MDA含量在0.3%和0.6%盐处理7 d时比CK略有下降,在其他浓度盐处理下均缓慢增加;在盐胁迫第14天时,0.3%~0.9%处理MDA含量变化不大,而1.2%和1.5%处理均达到最高峰值(分别为19.356和35.574 mmol/g);在胁迫第21天时,1.2%和1.5%盐处理MDA含量开始下降,0.3%~0.9%处理则迅速增加,其中的0.6%处理达到最高峰值(19.487 mmol/g);至胁迫第28天时,0.6%盐处理MDA含量开始下降,而0.3%和0.9%处理继续上升并达到最高峰值(分别为35.474和29.076 mmol/g);到胁迫第35天时,0.3%、0.6%、0.9%盐处理MDA含量分别下降至33.770、7.034和13.361 mmol/g,且0.6%和0.9%处理下降幅度比0.3%处理更大。
2.4 NaCl胁迫对‘丰后’梅及山杏叶片POD活性的影响
随着各浓度NaCl胁迫时间的延长,‘丰后’梅自根苗叶片POD活性整体呈现上升趋势,‘丰后’梅嫁接苗和山杏均总体呈现上升趋势,但个别浓度呈现先上升后下降趋势;在整个胁迫过程中,3种材料叶片的POD活性始终高于同期对照(图3)。
首先,‘丰后’梅自根苗POD活性在各浓度盐胁迫第7天时均明显上升;在胁迫第14~21天期间,0.3%~0.9%盐处理POD活性缓慢上升,而1.2%~1.5%盐处理则分别比胁迫第7天下降了56.3%和23.2%;在胁迫第28天时,0.3%和0.6%盐处理POD活性略有下降,0.9%和1.2%处理则达到最高峰值(分别为3 879.167和2 862.500 U·g-1·min-1),比同期CK分别增加5.47和3.77倍;至胁迫第35天时,0.3%和0.6%盐处理POD活性达到最高峰值(分别为1 525.000和3 116.667 U·g-1·min-1),比CK分别增加1.08和3.25倍。
其次,‘丰后’梅嫁接苗叶片POD活性在各浓度盐胁迫0~21 d期间均逐渐上升,且0.3%、1.2%和1.5%处理在胁迫第21天时均达到最高峰值,分别为6 550.000、8 000.000、9 687.500 U·g-1·min-1,比CK分别增加2.43倍、3.19倍和4.08倍;在盐胁迫第28天时,0.3%和0.6%盐处理POD活性略有下降,而0.9%处理则达到最高峰值(11 712.500 U·g-1·min-1),比同期CK增加了4.62倍;至胁迫第35天时,0.3%处理POD活性略有下降,0.9%处理则急剧下降,而0.6%处理达到最高峰值(11 241.667 U·g-1·min-1),比CK增加了4.16倍。
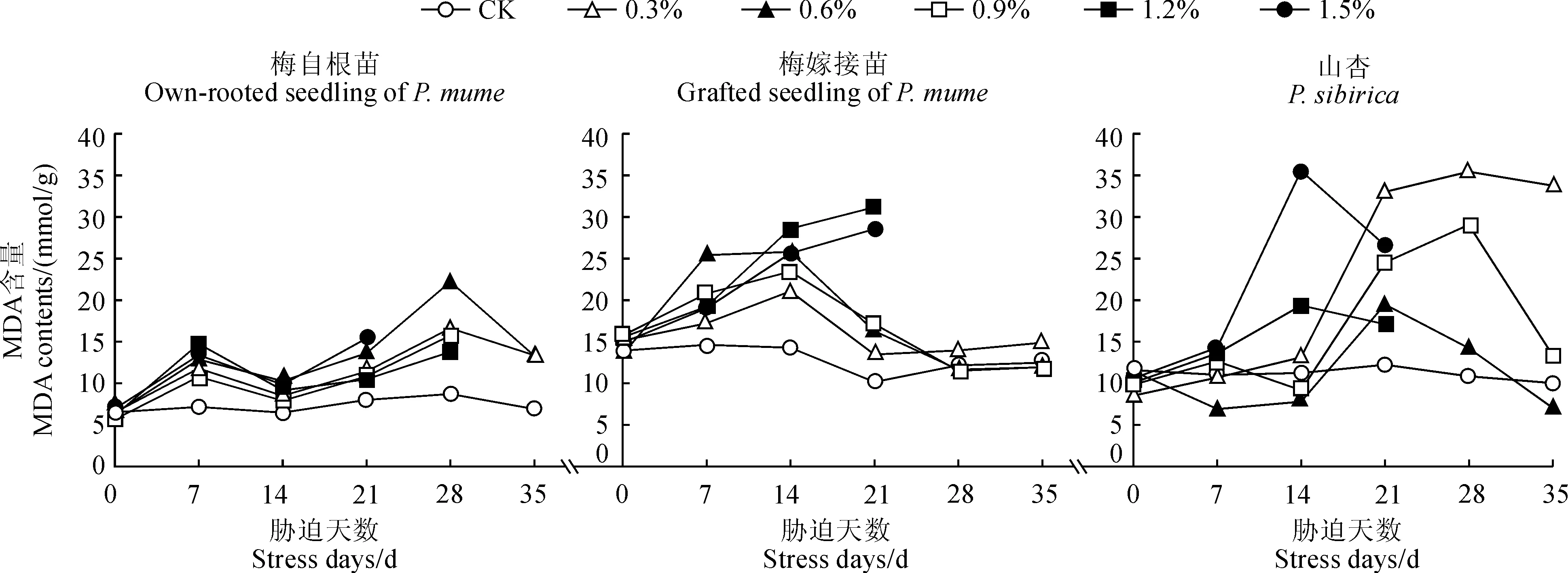
图2 盐胁迫下‘丰后’梅及山杏叶片MDA含量的变化Fig.2 Changes in MDA content of P. mume‘Feng hou’and P. sibirica under salt stress
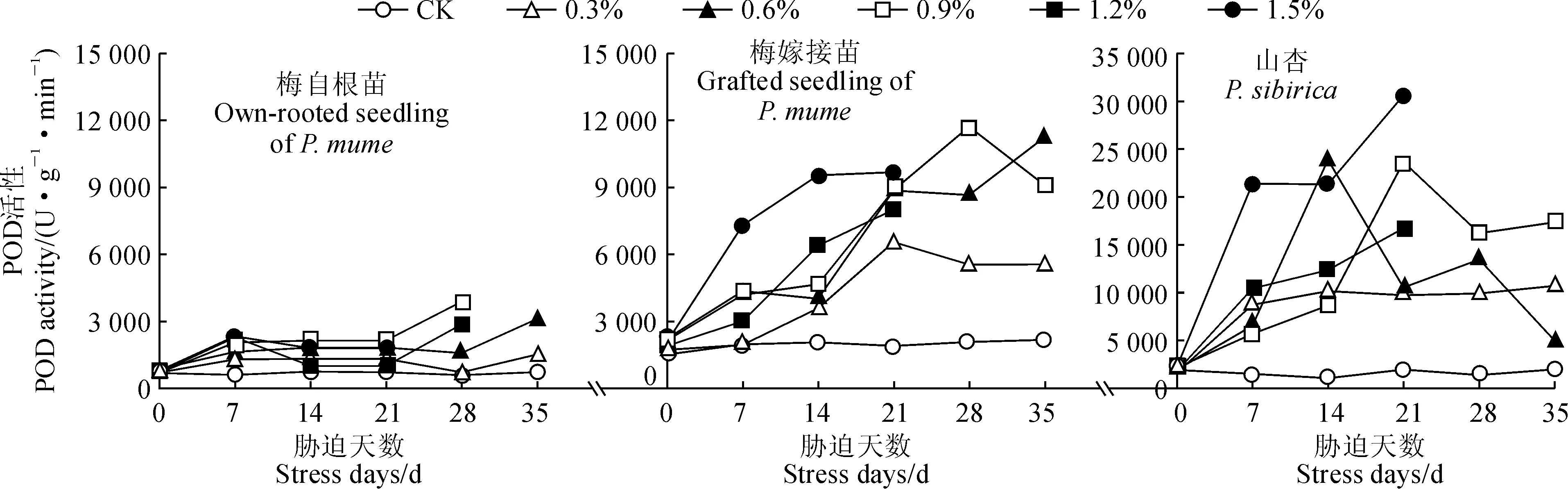
图3 盐胁迫下‘丰后’梅及山杏叶片POD活性的变化Fig.3 Changes in POD activity of P. mume‘Feng hou’and P. sibirica under salt stress
再次,山杏苗叶片POD活性在0.3%盐胁迫处理第7天时大幅上升,在胁迫14~35 d期间缓慢变化,至胁迫第35天时达到高峰值(10 729.167 U·g-1·min-1),比同期CK增加了4.36倍。叶片POD活性在0.6%盐处理7~14 d期间急剧上升,至第14天时达到高峰值(23 883.333 U·g-1·min-1),比同期CK大幅增加了21.22倍;在胁迫21~35 d期间总体呈现急剧下降趋势,相对第14天时下降了79%。叶片POD活性在0.9%盐处理7~14 d时增幅较小,在胁迫第21天时又急剧上升到最高峰值(23 662.5 U·g-1·min-1),比同期CK增加了11.06倍;其在胁迫28~35 d期间逐渐下降,但降幅不大。叶片POD活性在1.2%和1.5%盐胁迫处理7~21 d内逐渐上升,至胁迫第28天及以后因植株叶片全部脱落无法继续测定活性;1.5%处理POD活性比1.2%处理增幅更大,二者均在第21天时达到最高峰值,分别为16 729.167和30 625.000 U·g-1·min-1,比同期CK分别增加了7.52和14.61倍。
2.5 NaCl胁迫对‘丰后’梅及山杏叶片可溶性糖含量的影响
随着NaCl胁迫时间的延长,各盐浓度胁迫处理‘丰后’梅自根苗叶片可溶性糖含量整体呈现上升趋势,‘丰后’梅嫁接苗和山杏则均总体呈现先下降后上升趋势,但个别较高盐浓度处理呈现先上升后下降趋势(图4)。首先,‘丰后’梅自根苗叶片可溶性糖含量在各盐浓度处理7~35 d期间均逐渐上升,0.3%和0.6%处理在第35天达到高峰值,0.9%和1.2%处理在第28天达到高峰值,它们的峰值分别为12.206、15.283、14.770和18.146 mg/g,比相应CK分别增加了0.30、0.62、0.67和1.05倍;1.5%处理在胁迫第7天时就急剧上升到高峰值(15.304 mg/g),比同期CK增加0.73倍,而在胁迫14~28 d期间略有下降。其次,‘丰后’梅嫁接苗叶片可溶性糖含量在0.3%~1.2%盐胁迫处理第7天时均有所下降,而在1.5%处理下则急剧上升;在胁迫处理第14天时,0.3%~0.9%处理可溶性糖含量继续下降,而1.2%处理急剧上升,1.5%处理缓慢上升;在胁迫第21天时,各浓度盐处理幼苗可溶性糖含量均上升,且1.2%和1.5%盐处理达到最高峰值(分别为19.129和17.751 mg/g),比同期CK分别增加1.28和1.11倍;在盐胁迫28~35 d之间时,0.3%~0.9%处理可溶性糖含量逐渐上升,均在第35天时达到高峰值,分别为14.236、14.578和11.993 mg/g,比同期CK分别增加0.78、0.82和0.50倍。再次,山杏苗可溶性糖含量在0.3%、0.6%和1.2%盐胁迫处理7 d时均呈现下降趋势,而同期0.9%和1.5%处理则急剧上升并达到最高峰值(分别为21.042和33.339 mg/g),比CK分别增加0.30和1.07倍;在盐胁迫第14天时,0.3%盐处理可溶性糖含量略有上升,0.6%~1.2%处理均呈现下降趋势;在盐胁迫第21天时,0.3%和1.5%盐处理可溶性糖含量略有下降,而0.6%~1.2%盐处理均呈现上升趋势;当盐胁迫处理28~35 d时,0.3%~0.9%处理可溶性糖含量逐渐上升,且0.3%和0.6%处理在第35天达到最高峰值(分别为16.907和17.954 mg/g),但与同期CK无显著差异。
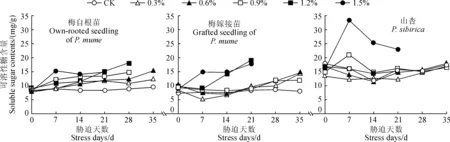
图4 盐胁迫下‘丰后’梅及山杏叶片可溶性糖含量的变化Fig.4 Changes in soluble sugar content of P. mume‘Feng hou’and P. sibirica under salt stress
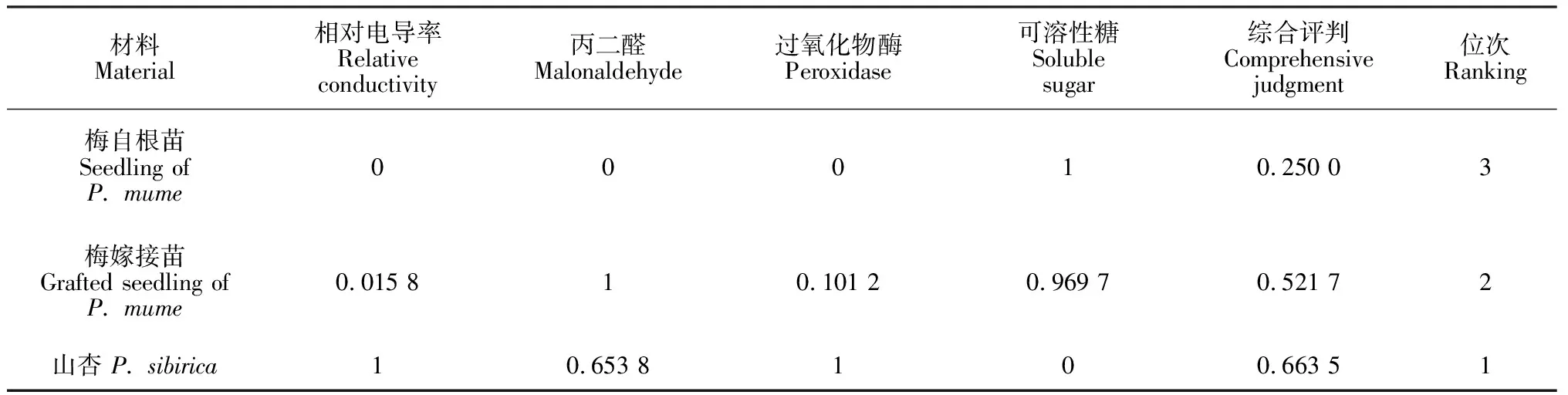
材料Material相对电导率Relative conductivity丙二醛Malonaldehyde过氧化物酶Peroxidase可溶性糖Soluble sugar综合评判Comprehensive judgment位次Ranking梅自根苗Seedling ofP. mume00010.250 03梅嫁接苗Grafted seedling ofP. mume0.015 810.101 20.969 70.521 72山杏 P. sibirica10.653 8100.663 51
2.6 ‘丰后’梅及山杏耐盐性综合分析
植物受到逆境胁迫时的生理变化错综复杂,并受到多种因素的影响,孤立地用一个指标评价植物耐盐能力很难真实反映植物的抗性本质。因此,为综合评价‘丰后’梅及山杏耐盐能力的大小,采用隶属函数值法,即用模糊数学隶属度公式对各项生理指标测定值进行定量转换,具体计算方法是,对POD活性和可溶性糖含量采用隶属函数,对相对电导率和MDA 含量采用反隶属函数计算[22]。然后,用每个树种各项指标隶属度的平均值作为树种抗性能力综合鉴定标准进行比较,综合评定结果如表2所示,3种植物耐盐能力表现为山杏>‘丰后’梅嫁接苗>‘丰后’梅自根苗,这与各材料盐害指数和盐害率的表现一致,从而印证了采用隶属函数值法评价植物耐盐性的可行性。
3 讨 论
3.1 ‘丰后’梅、山杏自根苗及其嫁接苗的耐盐性
梅花作为中国传统名花,是中国园林绿化和园林造景中的重要植物材料,而梅花的繁殖以嫁接为主要手段[23]。本研究以一年生‘丰后’梅自根苗、山杏为砧木的‘丰后’梅嫁接苗以及山杏自根苗为试材,通过测定4个生理指标并应用隶属函数值法综合评定三者耐盐性,结果表现为山杏>‘丰后’梅嫁接苗>‘丰后’梅自根苗;通过测定盐害指数和盐害率并依据Logistic方程求得山杏、‘丰后’梅嫁接苗、‘丰后’梅自根苗耐盐阈值分别为土壤NaCl含量0.705%、0.695%和0.545%;与‘丰后’梅自根苗相比,嫁接明显增加了‘丰后’梅的耐盐阈值,提高了叶片中POD活性,降低了叶片中相对电导率和MDA含量增加幅度,说明以耐盐性较强的山杏作为嫁接砧木后,‘丰后’梅嫁接苗耐盐性比其自根苗更强,嫁接对梅花耐盐性具有一定的促进作用,这与李娅娜[24]采用耐盐性强的砧木嫁接黄瓜幼苗后提高了其耐盐性的研究结论一致。这为梅花向盐渍土分布较广的北方地区繁殖推广过程中梅花品种、梅花繁殖方法及梅花砧木的选择提供了理论依据。
3.2 NaCl胁迫下‘丰后’梅和山杏自根苗及其嫁接苗的生物膜稳定性
在盐分胁迫条件下,植物细胞膜系统的变化分成两个阶段。首先表现为盐分对膜系统的破坏,也反映其对盐分的忍耐程度;然后是植物对膜系统的修复。电解质外渗率可以反映膜系统的完整性,电解质外渗越多,细胞膜的损伤程度越大[25],电解质渗透的多少通常用相对电导率来测定。MDA作为脂质过氧化作用的产物,其含量的多少可以代表膜损伤程度的大小,MDA含量就越高,氧自由基产生速率就越快,植物的抗逆性就越差[26]。POD是清除过氧化物和H2O2主要的抗氧化酶,保护膜系统不受自由基的伤害,膜系统的修复与POD活性的升高密不可分。
本次试验中,‘丰后’梅及山杏苗叶片MDA含量在不同测定天数随着NaCl胁迫程度的逐渐升高而总体呈现逐渐升高趋势,说明盐浓度越高,叶片中积累的MDA及电解质外渗越多,对梅花及山杏苗造成的伤害越大。但随着盐处理时间的延长,各浓度处理叶中MDA含量均呈下降趋势,但下降时间有所差异。由此可见,在同一浓度NaCl胁迫下,随着处理时间的推移,各材料植株对盐溶液产生了一定的适应性,这与孙伟泽等[27]对不同浓度盐胁迫下苜蓿MDA含量变化的研究结果一致。同时,‘丰后’梅自根苗相对电导率值在胁迫第7天时达到高峰值,后随着盐胁迫时间的延长变化较为缓慢,一直处于较高值,而‘丰后’嫁接苗和山杏苗相对电导率值均在盐胁迫21~28 d期间有所下降;‘丰后’梅自根苗MDA含量除了在0.3%和0.6%两个较低浓度盐处理35 d后略有下降外,在0.9%~1.5%较高浓度盐处理下基本处于上升趋势,而‘丰后’嫁接苗和山杏苗均在各浓度盐胁迫处理14~28 d的不同时间段急剧下降。以上两点说明‘丰后’嫁接苗和山杏随着胁迫时间的推移能对盐溶液产生一定的适应性,而‘丰后’梅自根苗细胞膜受到盐胁迫损伤程度较‘丰后’嫁接苗和山杏更大,且不可逆转,从而证明‘丰后’嫁接苗和山杏耐盐性强于丰后’梅自根苗。
另外,本次试验中 ‘丰后’梅及山杏苗POD活性随着NaCl胁迫程度升高和胁迫时间的延长总体均呈现升高趋势,这与李永德等[28]研究不同浓度NaCl胁迫下文冠果幼苗POD活性总体变化趋势一致。但是,本试验中3种植物在各浓度盐胁迫处理下POD活性的高峰值差异较大,同期三者POD活性整体表现为山杏>‘丰后’梅嫁接苗>‘丰后’梅自根苗。说明3种植物在盐胁迫下均能通过提高保护酶活性来消除胁迫产生的过多氧自由基,从而保持体内活性氧产生与清除之间的平衡,使其免受盐胁迫伤害,但耐盐性较强的植物POD活性更高,对膜系统的修复能力更强。
3.3 NaCl胁迫下‘丰后’梅和山杏自根苗及其嫁接苗的有机渗透调节物质含量
渗透调节是植物适应盐胁迫的基本特征之一。在盐胁迫条件下,细胞可以通过积累一些物质,如脯氨酸、多胺、可溶性糖等来调节细胞内的渗透势,维持自身水分平衡,还可以保护细胞内许多重要代谢活动所需的酶类活性[29]。可溶性糖是很多植物主要的渗透调节剂,也是合成其他有机溶质的碳架和能量来源,对细胞膜和原生质胶体起稳定作用。有研究表明,逆境胁迫下植物积累的可溶性糖越多,其抗逆性就越强[30]。本次试验中,随着NaCl胁迫时间的延长,‘丰后’梅及山杏苗可溶性糖含量整体呈现上升趋势,说明3种植物在NaCl胁迫下可以通过增加体内的可溶性糖含量来维持自身渗透平衡,均表现出一定的耐盐性;但是,某些盐浓度处理的可溶性糖含量呈现先上升后下降趋势,原因可能是植物通过积累渗透调节物质——可溶性糖,从而增加细胞内的膨压,提高植物的吸水能力,而盐胁迫后期叶片中可溶性糖含量逐渐下降,原因可能是由于胁迫时间的延长,植物体内的生理生化反应发生了变化,可溶性糖的分解速度加快,合成速度变慢,分解速度大于合成速度,致使可溶性糖含量下降[31]。
综上所述,梅花作为中国传统名花,在中国园林应用中有着举足轻重的地位和影响,是中国园林绿化和园林造景中的重要植物材料。随着抗寒梅花的繁殖推广呈现以北京为中心向“三北”地区辐射的趋势,梅花耐盐性研究在其向盐渍土分布较为广泛的北方地区繁殖推广过程中势必成为重要研究内容。本研究通过探讨‘丰后’梅和山杏自根苗及其嫁接苗的耐盐特性和耐NaCl阈值,以及它们可能的耐盐生理机制,论证了以耐盐性较强的山杏作为嫁接砧木后,‘丰后’梅嫁接苗耐盐性比其自根苗增强,即嫁接对梅花耐盐性具有一定的促进作用。但不同地区盐碱地所含盐分种类、比例不同,具体应用时应视不同地域的情况而引种。另外,本次试验涉及的梅花品种、梅花嫁接砧木类型及梅花嫁接组合较少,要进一步深入研究梅花耐盐机制及嫁接对梅花耐盐性的影响可以选择不同品系梅花类型、不同砧木种类及各种嫁接组合进行耐盐性试验,从而对梅花耐盐性进行全面研究分析评价,进而筛选出耐盐性且抗寒性强的梅花品种及嫁接组合在北方地区繁殖推广应用。
参考文献:
[1] 陈俊愉. 中国梅花[M]. 海口:中国海南出版社, 1996: 69-70.
[2] 张启翔. 梅花品种抗寒性的比较分析[J]. 北京林学院学报, 1985,(2): 47-56.
ZHANG Q X. A comparative study on differences in cold hardiness in some of Mei flower cultivars[J].JournalofBeijingForestryUniversity, 1985,(2): 47-56.
[3] 张文娇. ‘东方朱砂’等5个梅花品种生理特性及梅花造景研究[D]. 杭州:浙江农林大学, 2011.
[4] 段美红, 李文广, 高祥利, 等. 三种梅花品种枝条抗寒性研究[J]. 中国观赏园艺研究进展, 2015: 495-499.
DUAN M H, LI W G, GAO X L,etal. Study on cold tolerance of three varieties ofPrunusmume[J].AdvancesinOrnamentalHorticultureofChina, 2015: 495-499.
[5] 李庆卫. 川、滇、藏、黔野梅种质资源调查和梅花抗寒品种区域试验的研究[D]. 北京:北京林业大学, 2009.
[6] 张秦英. 抗寒梅花品种区域试验及离体培养的研究[D]. 北京:北京林业大学, 2004.
[7] 彭 婷. 不同梅花品种CBF/DREB1同源基因的克隆及功能分析[D]. 武汉:华中农业大学, 2016.
[8] 过 聪.梅花CBF/DREB1同源基因的克隆和功能的初步分析[D]. 武汉:华中农业大学, 2010.
[9] 吕晓倩. 梅花杂交育种与后代耐热性评价研究[D]. 北京:北京林业大学, 2014.
[10] 刘德良, 赖万年. 夏季梅花品种耐热性生理生化指标研究[J]. 北方园艺, 2012,(2): 57-61.
LIU D L, LAI W N. Research on physio-biochemistry indexes of heat resistant ofPrunusmumein summer[J].NorthernHorticulture, 2012,(2): 57-61.
[11] 刘玉霞, 杨佳鑫, 段美红, 等. 高pH对梅花生长发育的影响[J]. 北方园艺, 2017,(6): 99-102.
LIU Y X, YANG J X, DUAN M H. Research onPrunusmumeresponse to high pH[J].NorthernHorticulture, 2017,(6): 99-102.
[12] 赵 宣, 韩霁昌, 王欢元, 等. 盐渍土改良技术研究进展[J]. 中国农学通报, 2016,32(8): 113-116.
ZHAO X, HAN J C, WANG H Y,etal. Research progress of saline soil improvement technology[J].ChineseAgriculturalScienceBulletin, 2016,32(8): 113-116.
[13] 张秦英, 陈俊愉, 魏淑秋. 梅花在中国分布北界变化的研究[J]. 北京林业大学学报, 2007,29(增刊1): 35-37.
ZHANG Q Y,CHEN J Y,WEI S Q. The change of Mei’ snorth boundary of distribution in China[J].JournalofBeijingForestryUniversity, 2007,29(Suppl.1): 35-37.
[14] RADICS, RADIC-STOJKOVICM, PEVALEK-KOZLINAB. Influence of NaCl and mannitol on peroxidase activity and lipid peroxidation inCentaurearagusinaL.roots and shoots[J].PlantPhysiol, 2006,163(12): 1 284-1 292.
[15] 黄国林, 张孝岳, 龙次平. 不同砧木对梅花嫁接繁殖影响研究[J]. 园艺学文集, 2005: 219-221.
HUANG G L, ZHANG X Y, LONG C P. Study on the grafting and breeding influence ofPrunusmumeby different cutting boards[J].HorticultureAnthology, 2005: 219-221.
[16] 张加正, 潘仙鹏, 洪 莉. 梅花嫁接繁殖技术[J]. 浙江农业科学, 2006, (5): 539-540.
ZHANG J Z, PAN X P, HONG L. Grafting and breeding technology ofPrunusmume[J].JournalofZhejiangAgricultureSciences, 2006, (5): 539-540.
[17] 胡晓立, 李彦慧, 陈东亮, 等. 3种李属彩叶植物对NaCl胁迫的生理响应[J]. 西北植物学报, 2010,30(2): 370-376.
HU X L, LI Y H, CHEN D L,etal. Physiological responses of three colored-leaf species ofPrunusunder NaCl stress[J].ActaBot.Boreal.-Occident.Sin, 2010,30(2): 370-376.
[18] 刘从霞. 4种李属彩叶植物抗寒生理研究[D]. 河北保定:河北农业大学,2007.
[19] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[20] 高 茜. 贮藏温度对红砂种子生理特性的影响[D]. 兰州:甘肃农业大学,2013.
[21] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006.
[22] 杨敏生, 裴保华, 朱之悌. 白杨双交杂种无性系抗旱性鉴定指标分析[J]. 林业科学, 2002,38(6): 36-42.
YANG M S, PEI B H, ZHU Z D. Index analysis on comprehensive judgement of drought resistance ability of white poplar hybrid clones[J].ScientiaSilvaeSinicae, 2002,38(6): 36-42.
[23] 朱 玲, 常 平, 梁英梅, 等. 南京梅花的嫁接繁殖技术及嫁接苗的管理[J]. 北京林业大学学报, 2013,35(增刊1): 157-159.
ZHU L, CHANG P, LIANG Y M,etal. Grafting propagation technology and management of grafted Mei flower (Prunusmume) plants in Nanjing[J].JournalofBeijingForestryUniversity, 2013,35(Suppl.1): 157-159.
[24] 李娅娜. 不同砧木的耐盐性差异及其对黄瓜幼苗耐盐性的影响[D]. 武汉:华中农业大学, 2006.
[25] 王瑞刚, 陈少良, 刘力源, 等. 盐胁迫下3种杨树的抗氧化能力与耐盐性研究[J]. 北京林业大学学报, 2005,27(3): 46-52.
WANG R G, CHEN S L, LIU L Y,etal. Genotypic differences in antioxidative ability and salt tolerance of three poplars under sact stress[J].JournalofBeijingForestryUniversity, 2005,27(3): 46-52.
[26] 王爱国. 丙二醛作为脂质过氧化指标的探讨[J]. 植物生理学通讯, 1986, (2): 55-57.
WANG A G. Inquiry into Malondialdegyde as index of peroxidation of plant lipids[J].PlantPhysiologyCommunications, 1986, (2): 55-57.
[27] 孙伟泽, 韩 博, 胡晓宁, 等. 不同浓度盐胁迫下苜蓿丙二醛含量变化[J]. 安徽农业科学, 2009,37(5): 1 905-1 906,1 911.
SUN W Z, HAN B, HU X N,etal. Malonyldialdehyde changes of alfalfa under salt stress[J].JournalofAnhuiAgri.Sci., 2009,37(5):1 905-1 906,1 911.
[28] 李永德, 李 旭, 金香花, 等. NaCl胁迫对文冠果幼苗生长和生理生化特征的影响[J]. 延边大学农学学报, 2015,37(3): 212-216.
LI Y D, LI X, JIN X H,etal. Growth and physiological characteristics ofXanthocerassorbifoliaseedlings under NaCl stress[J].AgriculturalScienceJournalofYanbianUniversity, 2015,37(3): 212-216.
[29] 史军辉, 王新英, 刘茂秀. NaCl胁迫对胡杨幼苗叶生理生化指标的影响[J]. 新疆农业科学, 2012,49(11): 2 022-2 028.
SHI J H, WANG X Y, LIU M X. Effects of NaCl stress on the physiological and biochemical indexes in seedling leaves ofPopuluseuphraticaOliv[J].XinjiangAgricultureSciences, 2012,49(11): 2 022-2 028.
[30] 方志红, 董宽虎. NaCl胁迫对碱蒿可溶性糖和可溶性蛋白含量的影响[J]. 中国农学通报, 2010,26(16): 147-149.
FANG Z H, DONG K H. Effects of NaCl stress on soluble protein contents and soluble carbohydrate contents ofArtemisiaCnethifolia[J].ChineseAgriculturalScienceBulletin, 2010,26(16): 147-149.
[31] 刘 行. 金露梅耐盐生理特性研究[D]. 河北保定:河北农业大学, 2009.

