东方百合‘演员’DXS基因的克隆与表达分析
张浩宇,樊俊苗,王 婷,杜 方
(山西农业大学 园艺学院,山西太谷 030801)
萜类物质广泛存在于自然界生物体内,大约有55 000种,构成了最大的天然产物家族[1]。在高等植物中,有些萜类物质参与生理代谢活动,如光合作用、呼吸作用和细胞周期控制等[2],有些萜类化合物如丹参中的丹参酮类具有药理活性[3],有些萜类化合物为食品工业和化妆品工业的重要原料[4],同时低分子量的萜类也是百合花香成分中的重要物质[5]。萜类物质合成途径有位于质体的2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-methyl-D-erythritol 4-phosphate, MEP)和位于胞质的甲羟戊酸(mevalonate, MVA)两条途径[6]。1-脱氧木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase, DXS)是MEP途径中的关键酶[7-8],并且已有研究表明其在拟南芥中发挥着限速酶作用[9],是萜类次生代谢物质等下游产物的一个关键调控位点。
百合作为主要的切花和盆花材料,在国内外花卉市场占有重要地位[10]。百合不仅具有艳丽的色彩,还有丰富的香型,有墨香、浓香、甜香、淡香以及无香[11]。近年来,百合花香是学者研究的一大热点。从揭示花香成分[12-13]、释放器官[14]、散发规律[15-16]到代谢通路的挖掘[17]以及相关基因、调控基因的克隆[18]和原核生物表达验证[19],都取得了突破性的进展。通常亚洲百合无香味,而东方百合香味浓烈,严重影响消费者的购买欲。因此,改良花香是育种家孜孜以求的育种目标。已有研究表明,与有香百合相比,无香百合中单萜类化合物的释放量很低或根本检测不到[14]。因此,研究百合单萜类花香物质的代谢通路及其关键基因对于揭示花香差异本质原因具有重要意义。本研究采用RACE技术从东方百合‘演员’(LiliumOriental hybrid ‘Entertainer’)花瓣中克隆得到DXS的cDNA全长,并对其在不同香型百合品种间表达特征进行了研究,为今后通过基因工程改良百合花香提供了理论依据。
1 材料和方法
1.1 材 料
试验材料(表1)种植于山西农业大学园艺学院园艺站百合圃。2017年5~7月陆续取不同品种百合盛开期花瓣,经液氮速冻,-80 ℃保存,备用。
1.2 方 法
1.2.1RNA提取与cDNA第一链合成使用TaKaRa公司裂解液,采用Trizol法提取百合总RNA。使用生物光度计检测RNA的浓度和纯度,用1%琼脂糖凝胶电泳检测RNA质量,按照GenStar试剂盒说明反转录成cDNA。
1.2.2DXS基因的克隆从NCBI核酸数据库中查询获得1条百合cDNA序列信息,GeneBank登录号为KR998332.1。分别设计5′-RACE和3′-RACE引物(表2),以‘演员’cDNA为模板,利用TaKaRa公司RACE试剂盒进行PCR扩增。PCR反应总体系为50 μL,其中cDNA 2.5 μL,10×UPM引物5 μL,5′(3′)GSP引物1 μL,ddH2O 15.5 μL,2×SeqAmpTMBuffer 25 μL, SeqAmp DNA Polymerase 1 μL。PCR扩增条件为:94 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环,94 ℃ 30 s,65 ℃ 30 s,72 ℃ 3 min,25个循环。1%琼脂糖凝胶电泳检测,切胶回收目的片段,加A反应按照天根加A试剂的方法标准操作。加A后,连接载体pMD-19T(TaKaRa),转化EscherichiacoliDH5α感受态细胞(全式金),菌液PCR验证后送生工生物工程(上海)股份有限公司测序。利用DNAMAN软件拼接测序结果,得到编码序列。
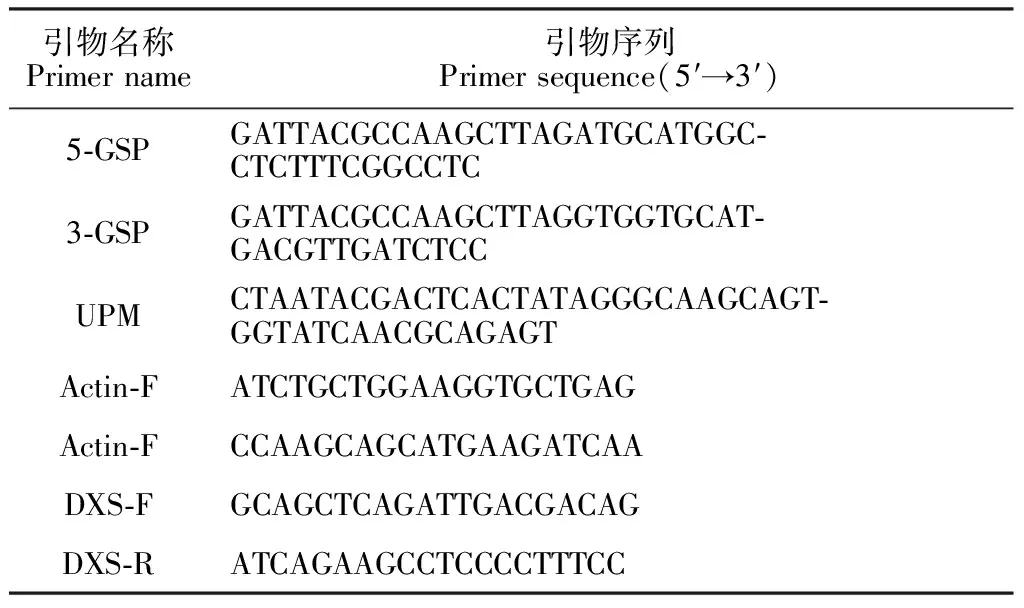
表2 引物序列
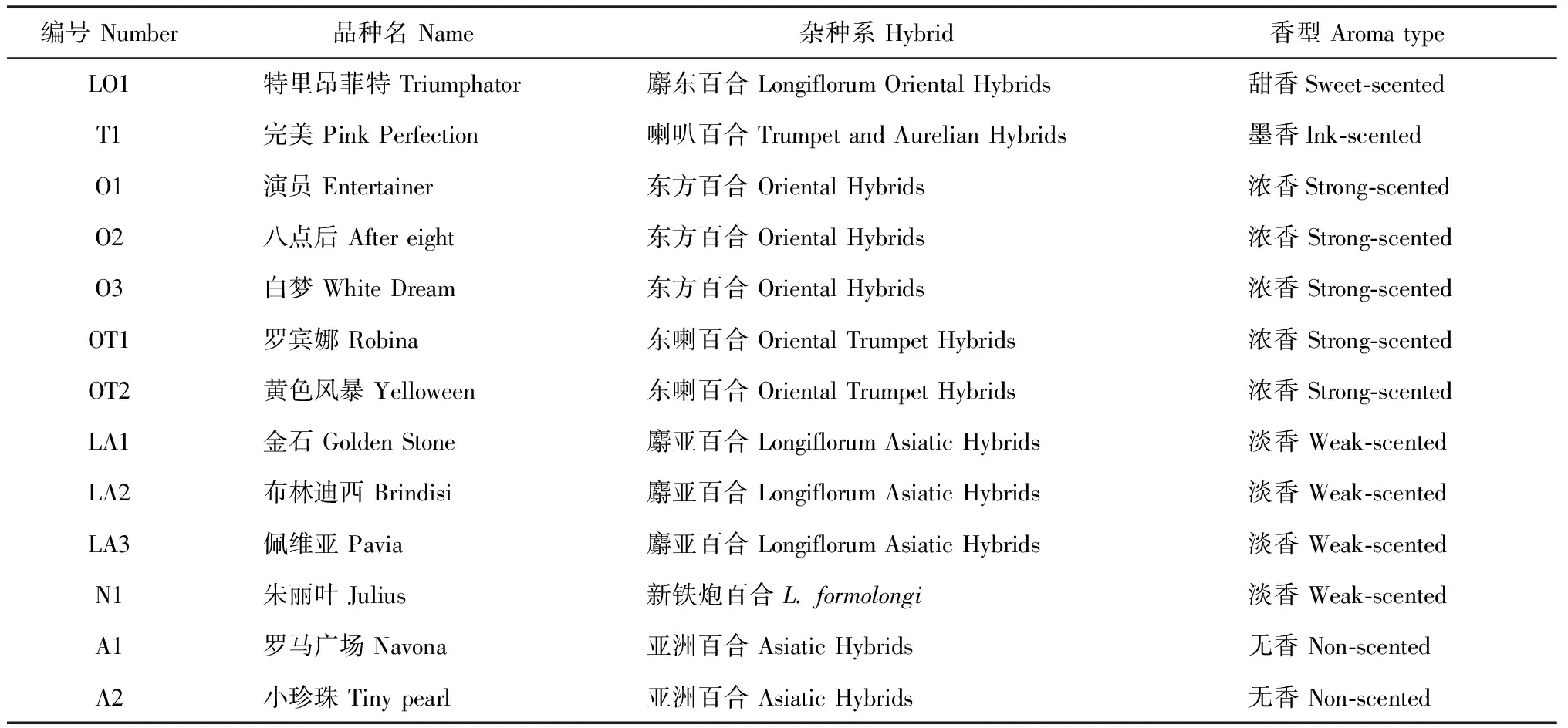
表1 试验用材料基本信息
1.2.3生物信息学分析利用ProtParam (http://web.expasy.org/protparam/) 预测LeDXS分子量和理论等电点[20]。用SMART在线软件 (http://smart.embl-heidelberg.de/) 预测LeDXS蛋白结构域[21]。通过SignalP4.1 (http://www.cbs.dtu.dk/services/SignalP/) 在线软件进行信号肽预测[22]。用在线软件ExPASy (http://web.expasy.org/protparam/) 分析蛋白质亲水性/疏水性;用TMHMM Server V2.0 (http://www.cbs.dtu.dk/services/TMHMM/) 在线软件对LeDXS进行跨膜性分析[23]。用PRABI (https://npsa-prabi.ibcp.fr/cgi-bin/secpred sopma.pl) 预测蛋白质二级结构[24]。用DNAMAN Version 9软件进行序列比对及翻译,用MEGA6.0软件构建系统进化树[25]。
1.2.4实时荧光定量PCR分析根据已克隆的百合LeDXS的cDNA序列分析结果,设计荧光定量引物,Blast比对确定引物特异性。分别以不同品种盛开期花瓣的cDNA为模板,以Actin基因作为内参基因,反应引物DXS-F、DXS-R、Actin-F、Actin-R见表2。参照杜方等[26]的步骤进行荧光定量PCR,研究不同品种百合LeDXS基因表达差异,每个试验进行3次重复。所得数据采用Excel进行平均数统计,2-ΔΔCT法[27]计算相对表达量,以SPSS V20软件进行方差分析,LSD多重比较,利用Excel 2010绘图。
2 结果与分析
2.1 LeDXS基因全长cDNA的克隆
通过RACE法,以东方百合‘演员’花瓣cDNA为模板,分别进行5′和3′-RACE扩增、TA克隆和测序分析,获得5′末端序列长度2 254 bp,获得3′末端序列长度1 004 bp(图1),与预期结果一致。命名该基因为LeDXS,GenBank登录号为MF576067。该基因全长2 471 bp,其中包含5′-UTR 50 bp,3′-UTR 279 bp和开放阅读框2 142 bp,编码713个氨基酸。通过DNAMAN软件翻译获得LeDXS基因编码的氨基酸序列(图2)。
2.2 DXS蛋白结构分析
SMART预测氨基酸序列中含有3个功能结构域,分别是N端DXP合成结构域、TPP结合结构域和转酮醇酶结构域(图2)。ProtParam分析该蛋白相对分子量为76.3 kD,理论等电点为6.65,化学式为C3370H5374N942O1016S32,原子量10734。信号肽结果分析表明,LeDXS不属于分泌蛋白。LeDXS GRAVY(Grand average of hydropathicity)值为负值,表明蛋白属于亲水性蛋白。蛋白跨膜性分析显示无跨膜区域,不属于膜蛋白。二级结构预测显示,其氨基酸组成α-螺旋(Hh)为267个(37.45%),延伸链(Ee)为139个(19.50%),β-转角(Tt)为81个(11.36%),无规则卷曲为226个(31.70%)。
2.3 多序列比对与聚类分析
百合‘演员’中克隆的DXS基因分别与已分离获得的LhDXS基因[13]、Unique8314[28]序列一致性都高达99%(图3),与无油樟(Amborellatrichopoda)、蔓花生(Arachisduranensis)、黄芪(Astragalusmembranaceus)的一致性分别达74%、74%、73%。用MEGA7软件对10种可以产生萜类化合物的植物进行DXS聚类分析,结果表明所获得的百合DXS基因属于第一类基因,是较为保守的管家基因(图4)。
2.4 百合DXS基因在品种间的表达模式
采用qRT-PCR方法检测LeDXS在13个百合品种的表达情况。由图5可知,LeDXS在不同品种中均有表达,在浓香型东方百合‘白梦’中表达量最高,在无香的亚洲百合‘小珍珠’中最低;浓香型百合表达量与淡香型和无香型之间差异显著,但淡香型和无香型百合基因表达差异不显著;同一香型百合之间基因表达差异也不尽相同,浓香型百合之间存在显著差异。LeDXS在百合不同品种间的表达量表明,不同品种百合花香的差异与LeDXS基因表达有关。
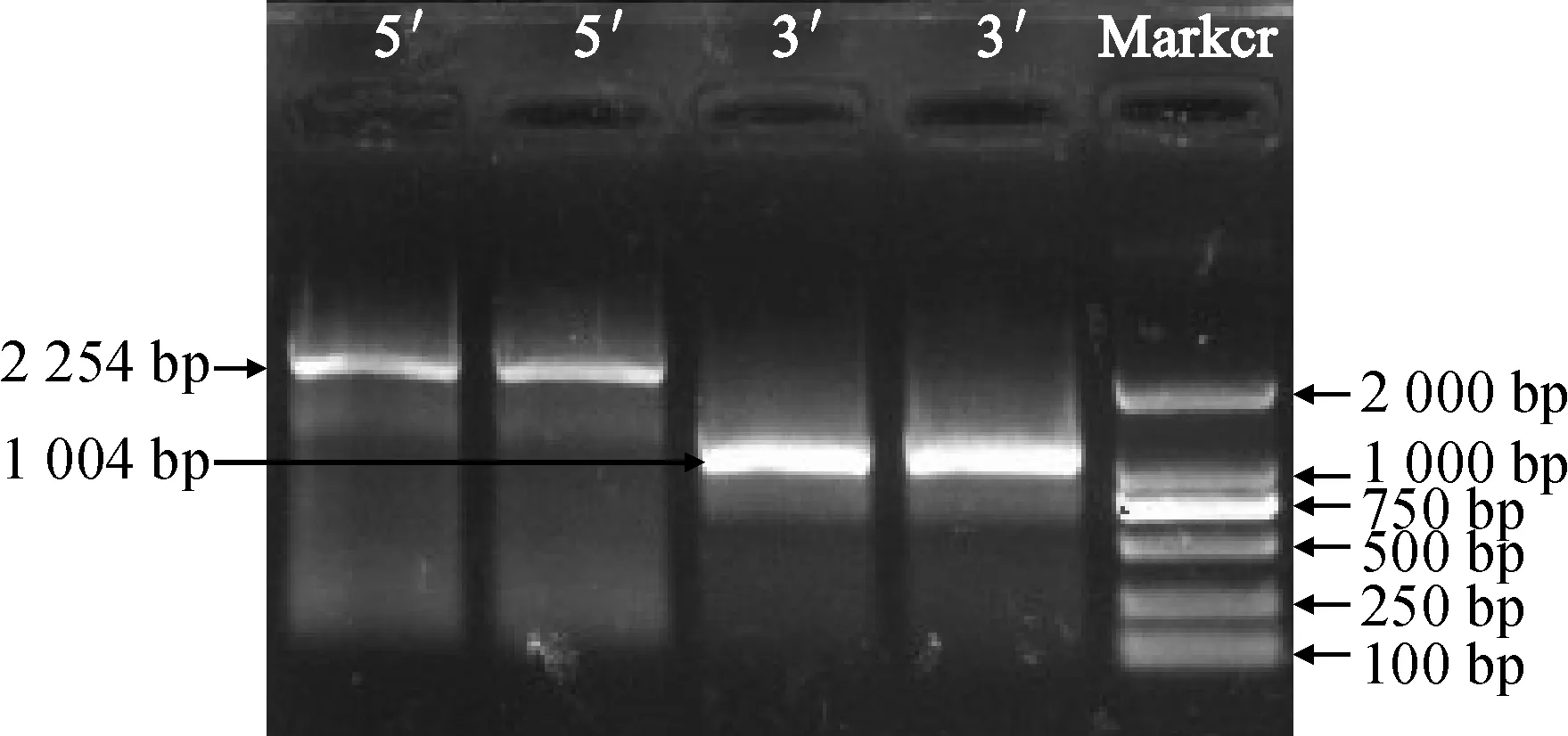
图1 DXS基因片段RACE电泳图Fig.1 Electrophoresis pattern of RACE fragments of DXS

ATG为起始密码子;TAG为终止密码子;粉色、蓝色和绿色箭头分别表示N端DXP合成结构域(DXP_synthase_N)、TPP结合结构域(Transket_pyr)和转酮醇酶结构域 (Transketolase_C)在氨基酸序列中的起止位置图2 百合LeDXS基因的核酸序列及推导的氨基酸序列The ATG in the red box is the start codon; the TAG in the box is the stop codon; the pink, blue and green arrows indicate the starting and ending positions of the N-terminal DXP synthesis domain, the TPP binding domain and the transketolase domain in the amino acid sequence, respectivelyFig.2 The nucleotide (above) and deduced amino acid sequences (below) of LeDXS
3 讨 论
萜类物质在植物生长调节、信号转导和自身防御等方面发挥重要作用[29]。张辉秀等[13]研究表明浓香型百合萜烯类释放量最高,在淡香类中没有检测到,并且认为其中两种单萜成分是百合花致香的关键成分。DXS基因是萜类物质合成MEP途径的第一个关键酶基因,萜类含量与DXS的表达水平密切相关[30],目前已在178种植物中分离和克隆[31]。DXS基因过表达或干扰表达均能够改变次生代谢物质合成,在拟南芥(Arabidopsisthaliana)[32]、胡萝卜(Daucuscarota)[33]、宽叶薰衣草(Lavandulalatifolia)[34]和猕猴桃(Actinidiachinensis)[35]等植物中都已进行了初步功能验证。不同物种DXS基因家族成员数不同,以前的研究认为DXS酶由1~3个基因编码,基于RNA-seq测序的研究表明,胡萝卜[33]和烟草(Nicotianatabacum)[36]有中分别有5个和6个,对于百合DXS基因研究甚少,目前,已知的百合DXS家族成员至少有2个,前人只在 ‘Belladonna’中获得部分cDNA序列[14],张腾旬在东方百合‘西伯利亚’品种中也克隆得到1个DXS基因cDNA全长,属于Ⅱ型DXS[37],但序列信息尚未公布。本研究通过RACE技术,克隆了百合DXS基因cDNA全长,并利用生物信息学手段分析研究其编码的蛋白特性,该蛋白具有亲水性特点,不属于分泌蛋白,由此推测它只在质体中发挥功能。
通过对基因的表达规律研究,发现其表达量与器官、花、果实发育程度、昼夜节律、品种等有关。研究表明CnDXS2在夜香树(CestrumnocturnumL.)叶片中的表达量总体高于花器官[38]。随着花朵开放级数和果实成熟,玫瑰花瓣[39]和猕猴桃果实[35]中DXS基因表达量逐级增加。茉莉花瓣中DXS基因的表达具有昼夜节律性[40]。课题组之前的研究表明,LhDXS在百合‘索邦’花和鳞片中显著高表达,但只在‘朱丽叶’花中显著高表达[26]。本研究发现,LeDXS基因的表达水平与花香的释放呈现一定的规律,浓香型百合基因表达量显著高于淡香型和无香型百合。Johnson的研究结果表明,浓香型百合‘Conca’d Or’比淡香型‘Santander’DXS基因表达量高[14],与本研究结果一致。

红色部分为3个序列不完全一致位点;黑色方框中ATG为起始密码子,方框中TAG为终止密码子图3 百合DXS基因多序列比对The red parts indicate some differences exist in the 3 sequences; the ATG in the black box is the start codon, the TAG in the black box is the stop codonFig.3 Multiple sequence alignment of DXS from lilies

图4 LeDXS与其他植物DXS蛋白的系统进化树Fig.4 Phylogenetic tree analysis of LeDXS and DXS of other plants
本试验主要从百合中分离获得一个DXS基因cDNA全长,对其进行了初步研究,发现LeDXS属于DXSⅠ,是功能较为保守的一类,分析了该基因在不同品种中的表达模式,推测LeDXS在百合花香萜类化合物合成途径中起重要作用,后期需进一步对百合DXS基因家族成员数目、分类和功能以及在百合花香代谢调控中的作用机制进行研究,对于明确花香差异的本质原因,以及利用现代生物育种技术改良百合花香具有一定的意义。
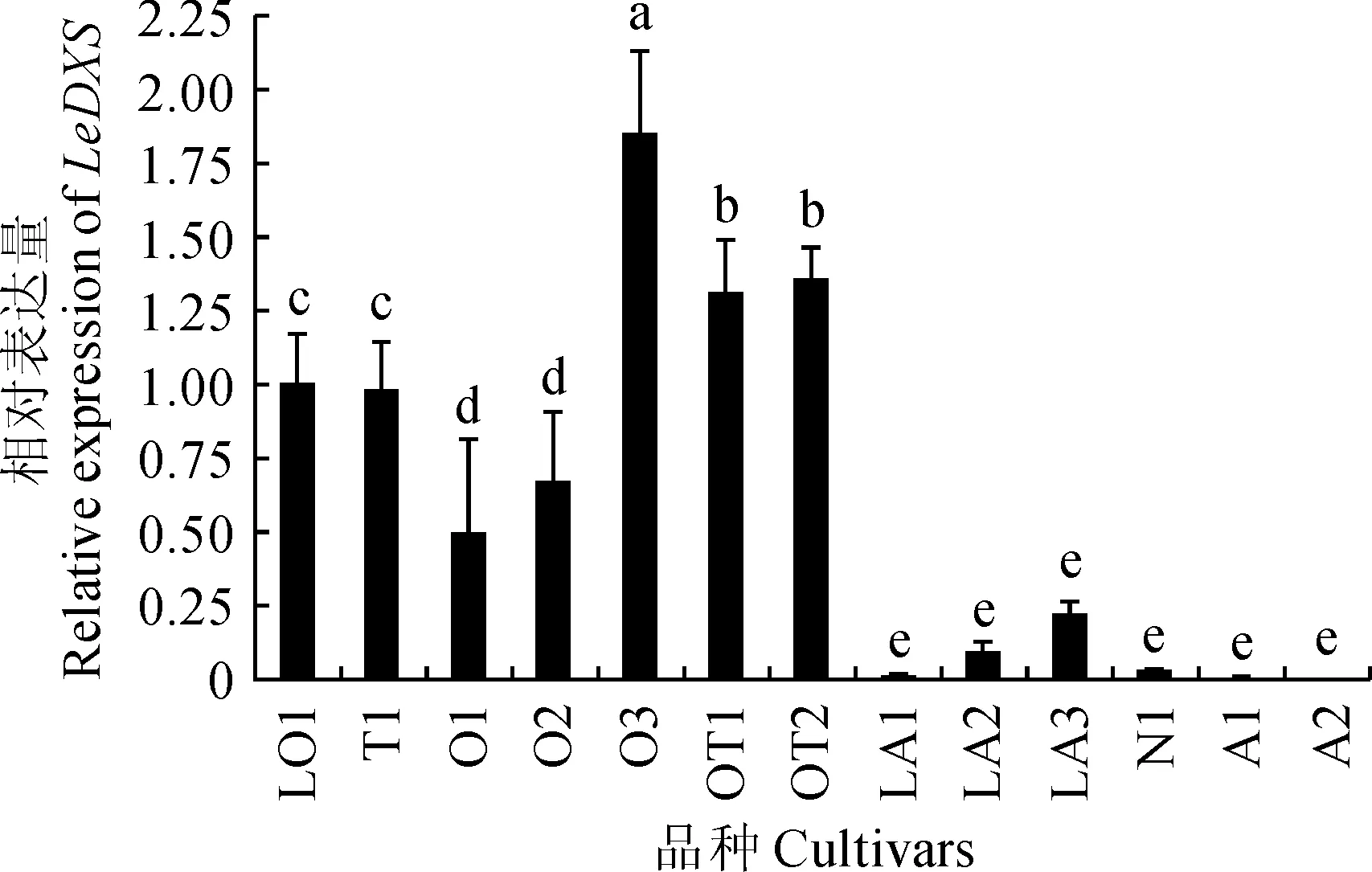
品种名称同表1;不同小写字母代表不同品种的差异显著性(P<0.05)图5 DXS在不同品种百合的相对表达量The names of cultivars are the same as Table 1; Different normal letters show significant differences among different cultivars(P<0.05)Fig.5 Expression analysis of DXS in different cultivars
参考文献:
[1] AJIKUMAR P K, TYO K, CARLSEN S,etal. Terpenoids: opportunities for biosynthesis of natural product drugs using engineered microorganisms[J].MolecularPharmaceutics, 2008,5(2): 167-190.
[2] 赵恒伟, 葛 锋, 孙 颖,等. 植物萜类物质生物合成的相关转录因子及其应用前景[J]. 中草药, 2012, (12): 2 512-2 519.
ZHAO H W, GE F, SUN Y,etal. Transcription factors involved in plant terpenoid biosynthesis and their application prospect[J].ChineseTraditionalandHerbalDrugs, 2012, (12): 2 512-2 519.
[3] DAI Z, LIU Y, HUANG L,etal. Production of miltiradiene by metabolically engineeredSaccharomycescerevisiae[J].Biotechnology&Bioengineering, 2012,109(11): 2 845-2 853.
[4] 马转转, 庞潇卿, 谌 容,等. 萜类化合物生物合成途径中关键酶的研究进展[J]. 杭州师范大学学报(自然科学版), 2015, (6): 608-615.
MA Z Z, PANG X Q, SHEN R,etal. Research advances of key enzymes in the biosynthesis pathways of isoprenoids[J].JournalofHangzhouNormalUniversity(Natural Science Edition), 2015, (6): 608-615.
[5] 唐 彪, 胡增辉, 冷平生, 等.浓香型和淡香型百合单萜合酶基因差异表达[J].北京农学院学报, 2016,31(2): 88-94.
TANG B, HU Z H, LENG P S,etal. The expression of monoterpene synthase genes inLiliumwith strong and light floral fragrance[J].JournalofBeijingUniversityofAgriculture, 2016,31(2): 88-94.
[6] DUDAREVA N, KLEMPIEN A, MUHLEMANN J K,etal. Biosynthesis, function and metabolic engineering of plant volatile organic compounds[J].NewPhytologist, 2013,198(1): 16-32.
[7] BATTISTINI M R, SHOJI C, HANDA S,etal. Mechanistic binding insights for 1-deoxy-D-Xylulose-5-Phosphate synthase, the enzyme catalyzing the firstreaction of isoprenoid biosynthesis in the malaria-causing protists,PlasmodiumfalciparumandPlasmodiumvivax[J].ProteinExpression&Purification, 2016,120: 16-27.
[8] RODRIGUEZ-CONCEPCION M, BORONAT A. Breaking new ground in the regulation of the early steps of plant isoprenoid biosynthesis[J].CurrentOpinioninPlantBiology, 2015,25: 17-22.
[9] WRIGHT L P, ROHWER J M, GHIRARDO A,etal. Deoxyxylulose 5-phosphate synthase controls flux through the methylerythritol 4-phosphate pathway inArabidopsis[J].PlantPhysiology, 2014,165(4): 1 488-1 504.
[10] 陈 莉, 辛海波, 李晓艳,等.百合MDHAR基因的克隆与表达分析[J]. 林业科学,2010,46(9): 178-181.
CHEN L, XIN H B, LI X Y,etal. Cloning and expression analysis ofMDHARfromLiliumlongiflorum[J].ScientiaSilvaeSinicae,2010,46(9): 178-181.
[11] 杜 方.百合引种栽培及分子研究[M].北京:中国林业出版社,2015:16-17.
[12] 范燕萍, 范丽琨. 不同类型百合花瓣挥发性香气成分分析[C]// 中国园艺学会观赏园艺专业委员会2008年学术年会. 2008.
[13] 张辉秀,胡增辉,冷平生,等. 不同品种百合花挥发性成分定性与定量分析[J]. 中国农业科学, 2013,46(4):790-799.
ZHANG H X, HU Z H, LENG P S,etal. Qualitative and quantitative analysis of floral volatile components from different varieties ofLiliumspp.[J].ScientiaAgriculturaSinica, 2013,46(4): 790-799.
[14] JOHNSON T S, SCHWIETERMAN M L, KIM J Y,etal.Liliumfloral fragrance: A biochemical and genetic resource for aroma and flavor[J].Phytochemistry, 2016,122: 103-112.
[15] LI T J, HU Z H, ZHEN J,etal. Diurnal changes of monoterpenes emission andLi-mTPSexpression inLilium‘Siberia’[J].ActaAgriculturaeBoreali-occidentalisSinica, 2016,25(5): 763-769.
[16] 张辉秀,冷平生,胡增辉,等.‘西伯利亚’百合花香随开花进程变化及日变化规律[J].园艺学报, 2013,40(4): 693-702.
ZHANG H X, LENG P S, HU Z H,etal. The floral scent emitted fromLilium‘Siberia’at different flowering stages and diurnal variation[J].ActaHorticulturaeSinica, 2013,40(4): 693-702.
[17] 孔 滢,孙 明,潘会堂,等.花香代谢与调控研究进展[J].北京林业大学学报,2012,34(2):146-154.
KONG Y, SUN M, PAN H T,etal. Advances in metabolism and regulation of floral scent[J].JournalofBeijingForestryUniversity, 2012,34(2): 146-154.
[18] 李路路,王 欢,孙 明,等.岷江百合单萜合酶基因克隆与表达分析[J].福建农林大学学报(自然科学版),2014,43(4): 397-402.
LI L L, WANG H, SUN M,etal. Molecular cloning and expression analysis of a monoerpene synthase gene inLiliumregale[J].JournalofFujianAgricultureandForestryUniversity(Natural Science Edition), 2014,43(4): 397-402.
[19] 王 欢. 百合苯甲酸甲酯代谢相关LiBSMT基因的克隆与分析[D].北京:北京林业大学,2015.
[20] 李绍翠,姜新强,丁爱琴,等.月季RhMYB61基因的克隆及表达特征分析[J].华北农学报, 2017,32(5): 61-68.
LI S C, JIANG X Q, DING A Q,etal. Cloning and expression characteristics ofRhMYB61 gene fromRosabybrida[J].ActaAgriculturaeBoreali-Sinica, 2017,32(5): 61-68.
[21] LETUNIC I, DOERKS T, BORK P. SMART: recent updates, new developments and status in 2015[J].NucleicAcidsResearch, 2015,43(Database issue): 257-60.
[22] PETERSEN T N, BRUNAK S, VON HEIJNE G,etal. Signal P 4.0:discriminating signal peptids from transmembrane regions[J].NatureMethods, 2011,8(10): 785-786.
[23] 徐 丽,陈 新,宗晓娟,等.甜樱桃砧木SABP2基因的克隆与分析[J].核农学报, 2017,31(1):14-20.
XU L, CHEN X, ZONG X J,etal. Cloning of a dehydrin genePcDHN1 and its response to abiotic stresses in sweet cherry rootstock[J].ActaAgriculturaeNucleataeSinica, 2017,31(1): 14-20.
[24] 董慧霞,理永霞,贾秀贞,等.杨树SABP2基因的克隆与分析[J].西北农林科技大学学报(自然科学版), 2017,45(3): 82-88,95.
DONG H Z, LI Y X, JIA X Z,etal. Cloning and analysis ofSABP2 gene about poplar[J].JournalofNorthwestSci-TechUniversityofAgricultureandForestry(Natural Science Edition), 2017,45(3): 82-88,95.
[25] 赵 佳,刘 荣,等.月季花青素苷相关R2R3-MYB蛋白基因的克隆和表达分析[J].中国农业科学, 2015,48(7): 1 392-1 404.
ZHAO J, LIU R,etal. Cloning and expression analysis of R2R3-MYB genes related to anthocyanin biosynthesis in rose[J].ScientiaAgriculturaSinica, 2015,48(7): 1 392-1 404.
[26] 杜 方,樊俊苗,王 婷,等.百合品种和器官中花香和抗性基因的表达模式[J].分子植物育种, 2017,15(6): 2 126-2 132.
DU F, FAN J M, WANG T,etal. The expression patterns of floral fragrance and resistance related genes in organs and cultivars of lily[J].MolecularPlantBreeding, 2017,15(6): 2 126-2 132.
[27] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods, 2001,25(4): 402-408.
[28] DU F, WU Y, ZHANG L,etal. De novo assembled transcriptome analysis and SSR marker development of a mixture of six tissues fromLilium, Oriental Hybrid ‘Sorbonne’[J].PlantMolecularBiologyReporter, 2014,33(2): 281-293.
[29] LANGE B M, RUJAN T, MARTIN W,etal. Isoprenoid biosynthesis: The evolution of two ancient and distinct pathways across genomes[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2000,97(24): 13 172-13 177.
[30] WRIGHT L P, ROHWER J M, GHIRARDO A,etal. Deoxyxylulose 5-phosphate synthase controls flux through the methylerythritol 4-phosphate pathway inArabidopsis[J].PlantPhysiology, 2014,165(4): 1 488-1 504.
[31] 张浩宇,樊俊苗,王 婷,等.植物萜类合成关键基因DXS研究进展[J]. 生物技术通报, 2018,34(3):1-8.
ZHANG H Y, FAN J M, WANG T,etal. Advance onDXSgene involved in the terpenoid biosynehesis in plants[J].BiotechnologyBulletin, 2018,34(3): 1-8.
[32] HENRIQUEZ M A, SOLIMAN A, LI G,etal. Molecular cloning, functional characterization and expression of potato (Solanumtuberosum) 1-deoxy-D-xylulose 5-phosphate synthase 1 (StDXS1) in response toPhytophthorainfestans[J].PlantScience, 2016,243: 71-83.
[33] SIMPSON K, QUIROZ L F, RODRIGUEZ-CONCEPCION M,etal. Differential contribution of the first two enzymes of the MEP pathway to the supply of metabolic precursors for carotenoid and chlorophyll biosynthesis in carrot (Daucuscarota)[J].FrontPlantScience, 2016,7(e6373).
[35] NIEUWENHUIZEN N J, CHEN X, WANG M Y,etal. Natural variation in monoterpene synthesis in kiwifruit: transcriptional regulation of terpene synthases by NAC and ETHYLENE-INSENSITIVE3-like transcription factors[J].PlantPhysiology, 2015,167(4): 1 243-1 258.
[36] YAN N, ZHANG H, ZHANG Z,etal. Organ- and growing stage-specific expression of solanesol biosynthesis genes inNicotianatabacumreveals their association with solanesol content[J].Molecules, 2016,21(11): 1 536.
[37] 张腾旬. 百合花香单萜合成关键酶LiDXS基因的克隆与分析[D]. 北京:北京林业大学, 2017.
[38] 刘 涛,许颖妍,熊 青,等.夜香树DXS2基因的克隆与表达分析[J].安徽农业科学,2017,45(10):132-136+218.
LIU T, XU Y Y, XIONG Q,etal. Cloning and expression analysis ofDXS2 gene inCestrumnocturnumL.[J].JournalofAnhuiAgriculturalSciences, 2017,45(10): 132-136+218.
[39] FENG L,CHEN C, LI T,etal. Flowery odor formation revealed by differential expression of monoterpene biosynthetic genes and monoterpene accumulation in rose (RosarugoseThunb.)[J].PlantPhysiologyandBiochemistry, 2014,75: 80-88.
[40] 孙 君, 陈桂信, 叶乃兴, 等. 茉莉花香气相关基因JsDXS及其启动子的克隆与表达分析[J].园艺学报, 2014,41(6):1 236-1 244.
SUN J, CHEN G X, YE N X,etal. Cloning and expression analysis of deoxyoxylulose-5-phosphate synthase gene related to aroma fromJasminumsambacand isolation of its promoter[J].ActaHorticulturaeSinica, 2014,41(6): 1 236-1 244.

