玉米酵母双杂交cDNA文库的构建及ZmCEN互作蛋白的筛选
雷海英,白凤麟,段永红,王志军
(1 长治学院 生物科学与技术系,山西长治 046011; 2 山西农业大学 农学院, 山西太谷 030801; 3 长治学院 化学系, 山西长治 046011)
细胞中存在着一个精密的骨架系统——细胞骨架,尤其是微管和微丝骨架,在细胞周期的进程中扮演着重要角色,直接参与有丝分裂中细胞器的组装及胞质分裂,维持细胞正常的形态结构与功能[1]。微管组织中心(microtubule organizing center, MTOC)决定着细胞微管的极性,为微管提供了生长的起点和延伸的方向。哺乳动物的MTOC,如中心体,是一个高度动态变化的结构,随细胞周期进行复制、分离,并且在分裂期形成纺锤体的两极,是细胞的动力中心。而63%的高等植物没有中心体,其功能的执行依赖于细胞内的细胞结合蛋白以及上游信号分子的调控,如中心蛋白(centrin)就是微管组织中心(MTOC)的一种重要组成部分[2],最早从绿藻(Tetraselmisstriata)中分离得到,是负责细胞分裂、分化的重要的钙结合蛋白。现已知中心蛋白存在于藻类、酵母、低等生物及高等动植物中[3-4]。中心蛋白的功能主要是通过与其互作蛋白,如中心体成分Sfi1[5-8]、Mps[9-10]和Karl[11-12]等作用而执行功能。
目前,中心蛋白的研究主要集中在低等生物、模式植物及人,对玉米中心蛋白(ZeamaysL. centrin, ZmCEN)的作用机制及互作蛋白研究未见报道。本实验室在前期研究中已成功进行了ZmCEN基因克隆和表达,并对ZmCEN的功能开展了初步研究[13-14]。本研究通过构建玉米cDNA文库,采用酵母双杂交技术筛选出与ZmCEN互作的蛋白质,为从分子水平上揭示ZmCEN作用的分子机制及开展其生物学功能研究奠定基础。
1 材料和方法
1.1 供试材料
参试材料为玉米(ZeamaysL.)自交系‘郑58’,由山西省农业科学院孙毅研究员提供。
总RNA提取、质粒提取及片段回收等试剂盒购自Takara公司,cDNA文库构建、酵母转化试剂盒、SD/Leu培养基等购自Clontech公司。酵母菌Y2HGold、Y187、大肠杆菌EscherichiacoliTOP10均由本实验室保存;酵母双杂交载体质粒为pGBKT7、pGADT7,购自Clontech公司。
1.2 实验方法
1.2.1玉米幼苗全株cDNA文库的构建(1) 总RNA的提取:选取玉米在光照培养箱中培养1周的生长健康的4~5叶期植株,连同根部一起取出,冲洗干净,于干热灭菌后的研钵中加入液氮,研磨后利用Trizol(TaKaRa)试剂提取总RNA(具体方法参照说明书),采用NanoDrop 2000 分光光度计检测RNA浓度和质量。
(2) ZmCEN cDNA 单链、双链合成及双链cDNA的纯化:采用SMART技术和Clontech酵母双杂交文库构建试剂盒(“Mate & Plate” Library System) 合成cDNA,PCR 反应条件为:95 ℃ 30 s;95 ℃ 10 s,65 ℃ 6 min(每个循环+5 s),25 个循环;68 ℃ 5 min。取7 μL反应产物做1% 琼脂糖凝胶电泳检测,剩余的约93 μL 加入到CHROMA SPIN TE-400纯化柱中纯化,最后溶解到20 μL 去离子水中重悬cDNA,采用1% 琼脂糖凝胶电泳检测质量。
(3) 收集转化子: 将ds cDNA 与 pGADT7-Rec 线性质粒共转至 Y187 感受态细胞中,按酵母转化试剂盒(Yeast makerTMYeast Transformation System 2,Clontech)指南操作,将转化子涂布于 150 mm SD/-Leu 平板上,待菌落长到 2~3 mm 时即收获转化子。
(4) 文库滴度检测:取 10 μL cDNA 文库菌液,分别稀释为10、100、10 000倍后涂布于100 mm SD/-Leu 平板上,30 ℃倒置培养3~5 d,分别统计平板上的菌落数以计算文库滴度。
1.2.2诱饵载体的构建引物序列依据ZmCEN基因CDS序列设计。ZmCEN-F/ZmCEN-R引物序列见表1,限制性内切酶NcoI/XhoI将扩增产物进行双酶切后,4 ℃连接过夜,采用载体通用引物测序验证序列的正确性。
1.2.3酵母转化、pGBKT7-ZmCEN毒性及自激活检测将pGBKT7质粒和构建好的pGBKT7-ZmCEN重组载体100 ng分别转化入酵母Y2HGold 的感受态细胞[26]中,稀释将转化液稀释10、100倍后分别取100 μL 涂布SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/Aba固体平板上检测其毒性;同时将 100 ng pGBKT7-ZmCEN及100 ng pGADT7质粒共转至Y2HGold感受态细胞,将转化液稀释10、100倍后分别取100 μL涂布SD/-Trp/-Leu/X-α-Gal、SD/-Trp/-Leu/-His/-Ade/X-α-Gal/AbA平板;同时将100 ng pGBKT7-53与100 ng pGADT7-T 共转至Y2HGold感受态细胞,为阳性对照;将100 ng pGBKT7-lam与100 ng pGADT7-T 共转至Y2HGold感受态细胞,设为阴性对照。将转化液稀释10、100倍后分别取100 μL涂布于SD/-Trp/-Leu/X-α-Gal、SD/-Trp/-Leu/-His/-Ade/X-α-Gal/AbA平板上,将上述平板在30 ℃下倒置培养 3~5 d,检测自激活。感受态细胞的制备和转化过程按照试剂盒(Yeast makerTMYeast Transformation System 2,Clontech)操作指南进行。
1.2.4玉米中心蛋白(ZmCEN)互作蛋白的筛选从上述SD/-Trp平板上挑取含有pGBKT7-ZmCEN的Y2HGold 菌落(2~3 mm)至50 mL SD/-Trp液体培养基中,30 ℃下250~270 r/min 振荡培养,直至OD600≈0.8;1 000 g离心5 min,去上清,用4~5 mL SD/-Trp 液体培养基重悬,在含有45 mL 2×YPDA 液体培养基的2 L的锥形瓶中接入1 mL cDNA文库菌液和4~5 mL诱饵菌液,设阳性对照为Y2HGold[pGBKT7-53+pGADT7-T],阴性对照为Y2HGold[pGBKT7-lam+pGADT7-T]。30 ℃下30~50 r/min 培养, 20 h后1 000 g 离心收集 10 min,弃上清,再用 50 mL 0.5×YPDA 清洗2次,离心,去上清,收集细胞;用 10 mL 0.5×YPDA 重悬细胞,将杂交液涂布于SD/-Trp/-Leu/-His/-Ade 的营养缺陷型固体培养基上,30 ℃倒置培养 7 d,筛选互作蛋白。
将划线3次均能生长的克隆定为阳性克隆。将抽提所得质粒转化至大肠杆菌 TOP10宿主,涂布于加有Amp 的平板上,挑斑送上海生工进行测序。测序后的cDNA 序列进行Blast 比对分析。选取互作蛋白NAC67和TON1b的菌落分别在SD/-Trp/Leu和SD/-Trp/-Leu/-His/-Ada营养缺陷型培养基上划线生长,β-半乳糖苷酶进一步验证其互作。
1.2.5双分子荧光互补[15]体内验证ZmCEN与TON1b蛋白的互作通过设计PCR引物,扩增出不含终止密码子的ZmCEN和TON1b的cDNA序列,并将此无终止密码子的ZmCENcDNA序列插入到nYFP的N-端半分子载体pSPYNE 的多克隆位点中,使之与nYFP相连形成ZmCEN-pSPYNE 融合蛋白;同时也将无终止密码子的TON1b的cDNA序列插入到nYFP的C-端半分子载体pSPYCE的多克隆位点中,形成TON1b-pSPYCE的融合蛋白。分别取两质粒5 μL(约1.2 mg)通过PEG诱导分别转化及共转化玉米原生质体,23 ℃弱光孵育 12~18 h进行瞬时表达,激光共聚焦显微镜(卡尔蔡司LSM880)观察并照相。

表1 实验中用到的 PCR 引物
2 结果与分析
2.1 玉米酵母双杂交cDNA文库的构建
玉米幼苗总RNA提取及mRNA纯化。提取的总RNA,OD260/OD280为1.986。由图1,A 看出,提取的总RNA 完整性较好,测定浓度为0.08 μg/μL,取3 μL进行建库。LD-PCR设置为25个循环。
玉米幼苗cDNA 的合成和纯化。如图1,B所示,合成的双链 cDNA 的电泳结果呈现弥散状分布,双链cDNA 大小介于300~5 000 bp 之间,表明cDNA 全长性较好。纯化后双链cDNA 浓度结果为167.4 ng/μL,OD260/OD280为1.73,大小介于300~4 000 bp 之间,表明全长性较好,符合建库要求。
cDNA文库质量与滴度检测,库容2.56×107CFU>1×106CFU,文库滴度:5.36×108CFU/mL,符合建库标准(>2×107CFU/mL)。
2.2 诱饵载体pGBKT7-ZmCEN的毒性及自激活检测
通过设计一步克隆引物,将ZmCEN基因插入到pGBKT7载体上,获得了pGBKT7-ZmCEN真核融合表达载体,通用引物测序证明载体构建成功。对融合表达载体转化酵母菌Y2HGold进行毒性检测,结果对照与插入菌株均在SD/-Trp缺陷型培养基上生长出单克隆菌落,表明pGBKT7和pGBKT7-ZmCEN对酵母Y2HGold无毒性作用(图2)。pGBKT7-ZmCEN诱饵质粒自激活作用检测结果如图2所示,只有阳性对照组中由于pGBKT7-53表达的 p53 蛋白与pGADT7-T 表达的T 蛋白发生相互作用,可在SD/-Trp/Leu和SD/-Trp/-Leu/-His/-Ada营养缺陷型培养基上复苏,而阴性对照pGBKT7-lam+pGADT7-T和实验组pGBKT7-ZmCEN+pGABT7-T只在SD/-Trp缺陷型培养基上生长,均不在四缺平板上生长,表明该诱饵基因的融合蛋白没有自激活活性,可用于下一步实验。
2.3 诱饵载体pGBKT7-ZmCEN筛选玉米幼苗cDNA文库
将诱饵载体pGBKT7-ZmCEN转入酵母Y2HGold后,提取单克隆质粒,送上海生物工程公司进行测序,并通过NCBI Blast 进行比对,得到了 28个可能与ZmCEN互作的蛋白质(表2)。从筛选的互作蛋白中分别选取NAC67和TON1b蛋白,采用表1中引物进行扩增并构建载体,再次进行共转验证和 β-半乳糖苷酶检测(图3),进一步证明了NAC67和TON1b蛋白与ZmCEN存在互作。利用 Uniprot 在线网站,对候选28个互作蛋白进行了 gene ontology(GO)注释(图4),结果表明ZmCEN的候选互作蛋白参与的生物过程有 21 种,包括翻译、代谢过程、化合物的生物合成过程、对外界刺激的响应及防御等;细胞组份包含叶绿体基质、核糖体及细胞内的非膜结合细胞器等;参与的分子功能有14 种,包括水解酶、翻译延伸因子、DNA复制原点结合活性及各种磷酸化酶活性等。
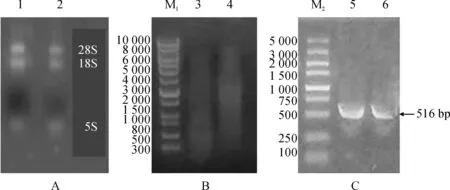
A. 玉米全株总RNA;B. cDNA纯化; C. ZmCEN基因PCR扩增; M1.10 000 bp DNA分子量标准; M2. 5 000 bp DNA分子量标准;1 和2为提取的总RNA; 3和4为纯化的cDNA; 5和6为PCR扩增ZmCEN基因产物图1 玉米ZmCEN基因PCR扩增A. Electrophoresis results of total RNA; B. ds cDNA; C. The PCR result of ZmCEN gene; M1. 10 000 bp DNA ladder; M2. 5 000 bp DNA ladder; 1 and 2 were the total RNA; 3 and 4 were the purified cDNA; 5 and 6 were the PCR result of ZmCEN geneFig.1 The PCR result of ZmCEN gene of maize
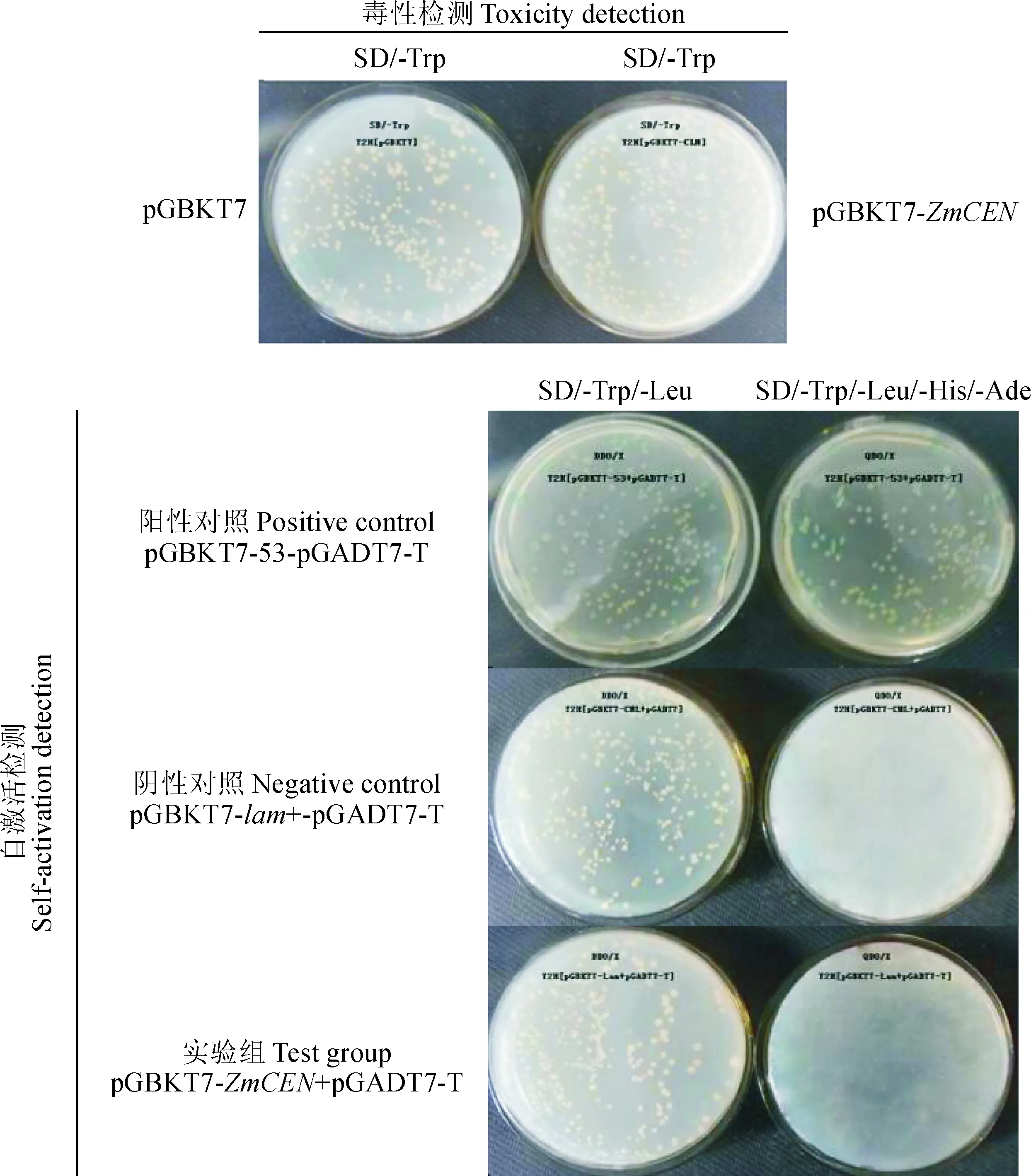
图2 诱饵融合蛋白的毒性和自激活活性检测Fig.2 Toxicity and self-activation detection of the bait recombinant protein
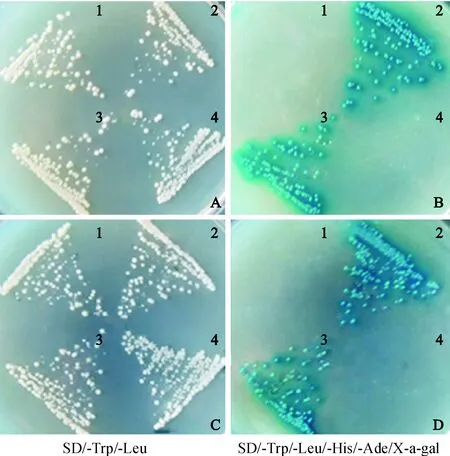
A、B. 1. pGBKT7-ZmCEN+pGADT7; 2. pGBKT7-ZmCEN+pGADT7-NAC67; 3. pGBKT7-53+pGADT7-T; 4. pGBKT7-lam+pGADT7-T;C、D. 1. pGBKT7-ZmCEN+pGADT7; 2. pGBKT7-ZmCEN+pGADT7-TON1b; 3. pGBKT7-53+pGADT7-T; 4. pGBKT7-lam+pGADT7-T图3 诱饵载体与蛋白NAC67和TON1b的互作验证Fig.3 Functional assay of bait protein with NAC67 and TON1b proteins in yeast
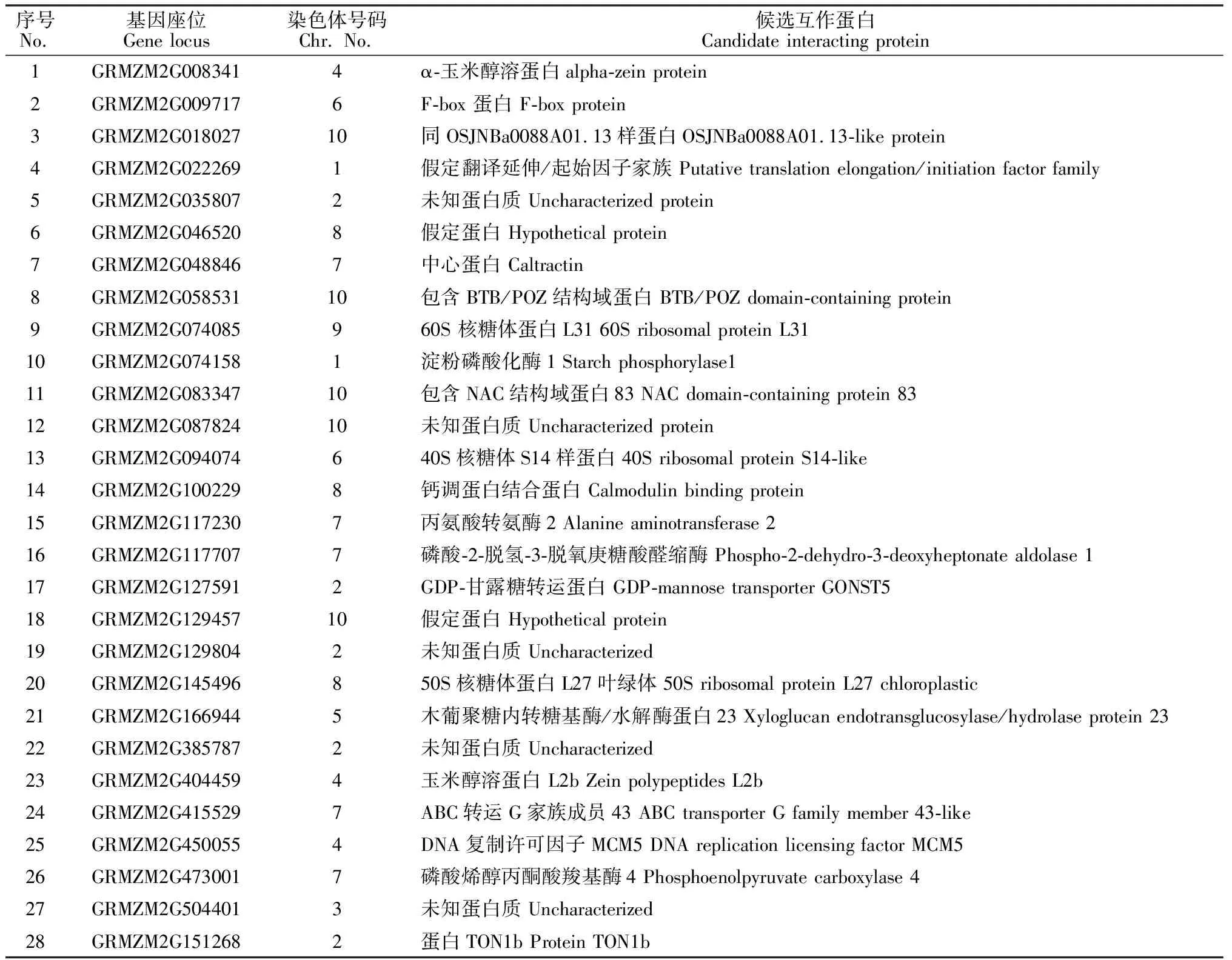
序号No.基因座位Gene locus染色体号码Chr. No.候选互作蛋白Candidate interacting protein1GRMZM2G0083414α-玉米醇溶蛋白alpha-zein protein2GRMZM2G0097176F-box 蛋白 F-box protein3GRMZM2G01802710同OSJNBa0088A01.13样蛋白OSJNBa0088A01.13-like protein4GRMZM2G0222691假定翻译延伸/起始因子家族 Putative translation elongation/initiation factor family5GRMZM2G0358072未知蛋白质 Uncharacterized protein6GRMZM2G0465208假定蛋白 Hypothetical protein7GRMZM2G0488467中心蛋白 Caltractin8GRMZM2G05853110包含BTB/POZ结构域蛋白 BTB/POZ domain-containing protein9GRMZM2G074085960S 核糖体蛋白L31 60S ribosomal protein L3110GRMZM2G0741581淀粉磷酸化酶1 Starch phosphorylase111GRMZM2G08334710包含NAC结构域蛋白83 NAC domain-containing protein 8312GRMZM2G08782410未知蛋白质 Uncharacterized protein13GRMZM2G094074640S核糖体S14样蛋白 40S ribosomal protein S14-like14GRMZM2G1002298钙调蛋白结合蛋白 Calmodulin binding protein15GRMZM2G1172307丙氨酸转氨酶2 Alanine aminotransferase 216GRMZM2G1177077磷酸-2-脱氢-3-脱氧庚糖酸醛缩酶 Phospho-2-dehydro-3-deoxyheptonate aldolase 117GRMZM2G1275912GDP-甘露糖转运蛋白 GDP-mannose transporter GONST518GRMZM2G12945710假定蛋白 Hypothetical protein19GRMZM2G1298042未知蛋白质 Uncharacterized20GRMZM2G145496850S核糖体蛋白L27叶绿体 50S ribosomal protein L27 chloroplastic21GRMZM2G1669445木葡聚糖内转糖基酶/水解酶蛋白23 Xyloglucan endotransglucosylase/hydrolase protein 2322GRMZM2G3857872未知蛋白质 Uncharacterized23GRMZM2G4044594玉米醇溶蛋白 L2b Zein polypeptides L2b24GRMZM2G4155297ABC转运G家族成员43 ABC transporter G family member 43-like25GRMZM2G4500554DNA复制许可因子MCM5 DNA replication licensing factor MCM526GRMZM2G4730017磷酸烯醇丙酮酸羧基酶4 Phosphoenolpyruvate carboxylase 427GRMZM2G5044013未知蛋白质 Uncharacterized28GRMZM2G1512682蛋白TON1b Protein TON1b
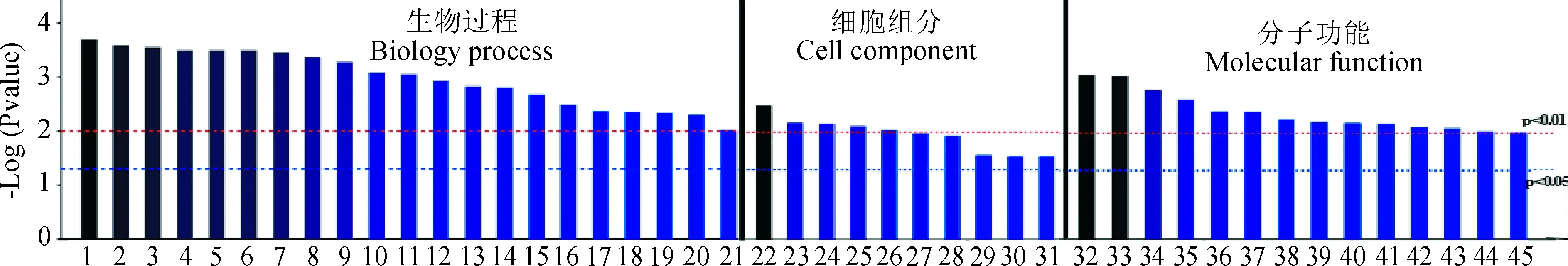
1.其他机体防御反应;2.翻译;3.肽的生物合成过程;4.肽的代谢过程;5.对其他生物体的反应;6.响应外部的生物刺激;7.酰胺的合成过程;8.细胞内酰胺的代谢过程;9.生物刺激反应;10.对真菌的防御反应;11.有机氮类化合物的生物合成过程;12.对外刺激反应;13.响应真菌;14.防御反应;15.翻译延伸;16.多生物过程;17.生物合成过程;18.有机体合物的代谢过程;19.细胞大分子生物合成过程;20.大分子生物合成过程;21.细胞生物合成过程;22.核糖体;23.核糖核蛋白复合体;24.叶绿体基质;25.质体间质;26.细胞的一部分;27.MCM复合物;28.细胞;29.细胞内;30.非膜结合细胞器;31.细胞内的非膜结合细胞器;32.脲基乙醇酸水解酶活性;33.翻译延伸因子活性;34.糖原磷酸化酶的活性;35.DNA复制原点的结合;36.营养库活性;37.核糖体的结构成分;38.水解酶活性,作用于碳氮健;39.磷酸化酶活性;40.结构分子活性;41.磷酸吡哆醛结合;42.磷酸烯醇式丙酮酸羧化酶活性;43.核苷三磷酸酶活性;44.焦磷酸酶活性;45.水解酶活性,作用于酸酐图4 ZmCEN候选互作蛋白 Gene ontology 注释1. defense response to other organism; 2. translation; 3. peptide biosynthetic process; 4. peptide metabolic process; 5. response to otherorganism; 6. response to external biotic stimulus; 7. amidebiosynthetic process; 8. cellular amide metabolic process; 9. response to bioticstimulus; 10. defense response to fungus; 11. organonitrogen compound biosynthetic process; 12. response to external stimulus; 13. response to fungus; 14. defense response; 15. translational elongation; 16. multi-organism process; 17. biosynthetic process; 18. organonitrogencompound metabolic process; 19. cellular macromolecule biosynthetic process; 20. macromolecule biosynthetic process; 21. cellularbiosynthetic process; 22. ribosme; 23. ribonucleoprotein complex; 24. chloroplast stroma; 25. plastid stroma; 26. cell part; 27. MCMcomplex; 28. cell; 29. intracellular; 30. non-membrane-bounded organelle; 31. intracellular non-membrane-bounded organelle;32. ureidoglycolate hydrolase activity; 33. translation elongation factor activity; 34. glycogen phosphorylase activity; 35. DNA replicationorigin binding; 36. nutrient reservoir activity; 37. structural constituent of ribosome; 38. hydrolase activity, acting on carbon-nitrogen(but not peptide) bonds; 39. phosphorylase activity; 40. structural molecule activity; 41. pyridoxal phosphate binding; 42. phosphoenolpyruvate carboxylase activity; 43. nucleoside-triphosphatase activity; 44. pyrophosphatase activity; 45. hydrolase activity, acting on acid anhydridesFig.4 Gene ontology annotation of ZmCEN candidate interacting proteins
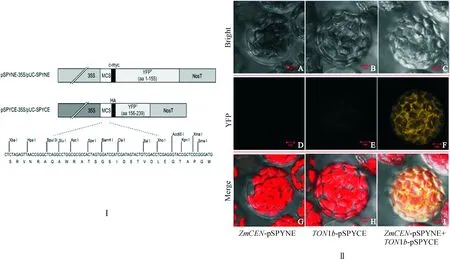
Ⅰ. BiFC载体图谱;Ⅱ. ZmCEN与TON1b蛋白在拟南芥原生质体中的互作。其中,A~C为明场下的拟南芥叶片原生质体细胞图;D~F为拟南芥叶片原生质体细胞的YFP荧光信号图;G~I为荧光信号与明场的叠加图图5 BiFC验证ZmCEN与候选蛋白TON1b的相互作用(Bar=2 μm)Ⅰ. BiFC vector map; Ⅱ. The interaction of ZmCEN and TON1b protein in Arabidopsis protoplast cell. A-C. Bright-field images ofArabidopsis protoplast cell; D-F. Epifluorescent images of yellow fluorescent protein (YFP) in Arabidopsis protoplast cell;G-H. Merged images of epifluorescent and bright-field imagesFig.5 BiFC identified interaction between ZmCEN and TON1b proteins (Bar=2 μm)
2.4 BiFC体内验证ZmCEN与TON1b蛋白的互作
利用BiFC载体系统(图5,Ⅰ)验证ZmCEN 和TON1b蛋白在拟南芥原生质体的相互作用,如图5,Ⅱ(卡尔蔡司LSM880共聚焦显微镜100X 油镜下观察并拍照)所示,在构建的对照组N-端YFP半分子载体ZmCEN-pSPYNE(图5,Ⅱ,A、D、G)和C-端YFP半分子载体TON1b-pSPYCE(图5,Ⅱ,B、E、H)分别转化拟南芥原生质体,结果均未观察到黄色荧光的表达,当将两半分子YFP载体共转拟南芥原生质体时,由于蛋白ZmCEN 和TON1b蛋白发生相互作用可产生完整的YFP,可观察到明显的黄色荧光的表达(图5,Ⅱ,C、F、I),从而证明ZmCEN和TON1b蛋白在拟南芥细胞内存在互作。
3 讨 论
构建高质量cDNA 文库是利用酵母双杂交系统筛得大量互作蛋白的成功基础。本实验构建的cDNA 文库滴度为5.36×108CFU/mL,达到了文库筛选的要求。通过构建的文库,筛选到了28个与诱饵蛋白ZmCEN互作的蛋白质,为进一步研究ZmCEN的分子机制打下基础。
在筛选的28个与ZmCEN发生互作的蛋白质中,其中2个是玉米醇溶蛋白的相关蛋白,已知玉米醇溶蛋白是玉米胚乳细胞中蛋白质的主要成分,但醇溶蛋白与ZmCEN作用的机制还不了解。研究表明:玉米醇溶蛋白的积累过程与细胞骨架有紧密联系,α醇溶蛋白在细胞骨架指导下,调控其基因转录形成mRNA,然后到达内质网中,醇溶蛋白组分到达蛋白体中心区域,促使其体积增大,最后蓄积成球状蛋白体[16]。而ZmCEN属于细胞骨架维管组织中心的一个组分,它与玉米醇溶蛋白发生互作,可能与醇溶蛋白在细胞中的积累存在联系,确保胚乳细胞中的醇溶蛋白达到足够数量及一定体积。二者之间的互作的机制研究对于玉米胚乳细胞的蛋白含量、籽粒大小乃至玉米产量等研究都有一定的意义。
有研究报道NAC是植物特有的一类转录因子,在植物的发育调控、抗病、激素信号转导、响应生物和非生物胁迫等都有作用[17]。本试验还筛选到2种与ZmCEN互作的BTB/POZ(Bric-a-brac tramtrack broad complex/Pox virus and zinc finger)蛋白家族蛋白,该家族的蛋白质N端都含有一个保守的BTB/POZ蛋白-蛋白结合结构域,以同源或异源二聚体的形式执行功能。此类蛋白质已经被证明执行许多分子功能,包括转录调控、细胞形态维持、细胞增殖和凋亡、离子通道组装、泛素途径降解蛋白等[18]。其中1种BTB/POZ结构的互作蛋白是一个NAC转录因子(LOC103640879)。NAC 家族转录因子在植物的次生细胞壁生物合成过程中也起着重要的调控作用[19]。Zhong 等[20]研究发现拟南芥 NAC 结构域转录因子 SND1 (for secondary wall-associated NAC domain protein)是调控纤维中次生壁合成的关键转录开关和转录活化剂。Zhong等[21]研究表明,与水稻和玉米次生壁相关的 NACs (namely OsSWNs and ZmSWNs) 在次生壁增厚方面双突变体缺失的缺陷[22]。柳展基等[23]从玉米中克隆了 ZmNAC1(EU224278),发现其受低温、干旱、高盐和 ABA 诱导表达,如形成纺锤丝、细胞板、细胞壁,并将细胞能够均等地拉向两极,以保证子代细胞能与其亲代有同样的遗传信息。由于植物细胞没有中心体,通过一个维管组织中心(MTOC)执行相同的功能,高度动态的微管和微丝骨架是高等植物细胞分裂和细胞生长所必须的重要基本组成成分。ZmCEN属于骨架结构微管组织中心蛋白,ZmCEN在MTOC中通过与其他蛋白作用,共同完成细胞有丝分裂的一系列活动[21]。推测ZmCEN与NAC67互作也可能参与细胞骨架的建成、维持细胞形态,细胞壁的形成、细胞的均等分裂等。本研究也证实了ZmCEN与TON1b蛋白存在互作,研究表明,TON1b招募基序蛋白(TRMs)与TON1b、蛋白磷酸酶2A 共同作用,参与早前期带(preprophase band,PPB)形成及细胞分裂的调控[24]。研究结果显示,拟南芥CEN1在体内与TON1a相互作用,参与细胞骨架及有丝分裂前皮层微管和微丝PPB的形成,而PPB在有丝分裂中决定细胞的分裂面和新细胞壁的位置[25]。TON1b蛋白与 PPB发生共定位,若将拟南芥的ton1基因突变,则不能形成PPB。TON1b蛋白为植物在PPB形成所必须[26]。许多微管结合蛋白已经被证明参与PPB的形成,为PPB决定细胞分裂面的位置[24]。由此推测,研究ZmCEN与TON1b的互作对于玉米细胞分裂中细胞板分裂面和细胞壁的形成非常重要,为进一步研究ZmCEN在玉米中的作用机制奠定了基础。
近年来采用酵母双杂交系统,筛选出了许多相互作用且有意义的蛋白[27-30],如本实验中与ZmCEN相互作用的蛋白NAC67、TON1b等,进一步说明该系统在研究蛋白互作筛选候选蛋白方面具有重要意义。虽然该系统存在假阳性问题,但可以通过其他实验手段对互作蛋白进行进一步验证。在后面的研究中我们将对筛选到的其余蛋白逐一验证,并通过相互作用的蛋白研究ZmCEN的调控机制及生物学通路。
参考文献:
[1] VECCHIO A J D, HARPER J D I, VAUGHN K C,etal. Centrin homologues in higher plants are prominently associated with the developing cell plates[J].Protoplasma, 1997,196(4): 224-234.
[2] WICK S,CHO S O. Higher plant spindle poles contain a protein that react with antibodies to the calcium-binding protein centrin[J].JournalofCellBiology, 1988,107: 455.
[3] SCHIEBEL E, BORNENS M. In search of function for centrins[J].TrendsCellBiol., 1995,5(5): 197-201.
[4] SALISBURY J L. Centrin, centrosomes, and mitotic spindle poles[J].CurrentOpinioninCellBiology, 1995,7(1): 39-45.
[5] SALISBURY J L. Centrosomes: Sfi1p and centrin unravel a structural riddle[J].CurrentBiology, 2003,14(1): 27-29.
[6] JUAN M S, LILIANE A. New insights into the interaction of centrin with Sfi1[J].BBA-ProteinsProteom, 2016,1864(4): 319-330.
[7] KILMARTIN J V. Sfi1p has conserved centrin-binding sites and an essential function in budding yeast spindle pole body duplication[J].JournalofCellBiology, 2003,162(7): 1 211-1 221.
[8] DORAORA G, LILIANE A. CK2 phosphorylation of human centrins 1 and 2 regulates their binding to the DNA repair protein XPC, the centrosomal protein Sfi1 and the photo transduction protein transducin β[J].FEBSOpenBio., 2014,4(1): 407-419.
[9] JASPERSEN S L, GIDDINGS J T, WINEY M. Mps3p is a novel component of the yeast spindle pole body that interacts with the yeast centrin homologue Cdc31p[J].JournalofCellBiology, 2002,159(6): 945-956.
[10] SAWANT D B, MAJUMDER S, PERKINS J L,etal. Centrin 3 is an inhibitor of centrosomal Mps1 and antagonizes centrin 2 function[J].MolecularBiologyoftheCell, 2015,26(21): 3 741-3 753.
[11] JEAN M, CYNTHIA R, OLIVUER F,etal. CENTRIN2 modulates homologous recombination and nucleotide excision repair inArabidopsis[J].PlantCell, 2004,16(6): 1 633-1 643.
[12] HU H, HEEHAN J H, CHAZIN W J. The mode of action of centrin: binding of Ca2+and a peptide fragment of Kar1p to the C-terminal domain[J].JournalofBiologyChemistry, 2004,279(49): 50 895-50 903.
[13] 雷海英, 白凤麟, 王志军. 玉米(ZeamaysL.)ZmCEN基因原核表达载体的构建及表达体系的优化[J]. 长治学院学报, 2016,33(2): 5-9.
LEI H Y, BAI F L, WANG Z J. Constuction optimization of expression conditions ofZmCENgene(ZeamaysL.) in prokaryotic cells[J].JournalofChangzhiUniversity, 2016,33(2): 5-9.
[14] 雷海英, 白凤麟, 刘建霞, 等. 玉米ZmCEN基因的克隆、表达与生物信息学分析[J]. 华北农学报, 2016,31(3): 18-24.
LEI H Y, BAI F L, LIU J X,etal. Cloning, experssion and bioinformations analysis of maizeZmCENgene[J].ActaAgricultureBoreali-Sinica, 2016,31(3): 18-24.
[15] BERENDZEN K W, BOHMER M, WALLMEROTH N,etal. Screening for in planta protein-protein interactions combining bimolecular fluorescence complementation with flow cytometry[J].PlantMethods, 2012,8(1): 1-17.
[16] 李 强. 玉米自交系醇溶蛋白突变性状的表征鉴定与遗传分析[D]. 太原: 山西大学, 2012.
[17] 葛姗姗, 唐桂英, 毕玉平, 等. 玉米全基因组NAC基因家族的鉴定与分析[J]. 山东农业科学,2015,47(2): 1-6.
GE S S, TANG G Y, BI Y P,etal. Genome-wide identification and analysis of NAC gene family in maize[J].ShandongAgriculturalSciences, 2015,47(2):1-6.
[18] ALBAGLI O, DHORDAIN P, DEWEINDT C,etal. The BTB/POZ domain: a new protein-protein interaction motif common to DNA and actin-binding proteins[J].CellGrowth&DifferentiationtheMolecularBiology, 1995,6(9): 1 193-1 198.
[19] 邢国芳, 张雁明, 张魏斌, 等. 植物 NAC 转录因子的研究进展[J]. 山西农业科学, 2012,40(4): 409-411, 423.
XING G F, ZHANG Y M, ZHANG W B,etal. Research progress of NAC transcription factors in plant[J].ShanxiAgriculturalSciences, 2012,40(4): 409-411, 423.
[20] ZHONG R, DEMURA T, YE Z H. SND1, a NAC domain transcription factor, is a key regulator of secondary wall synthesis in fibers ofArabidopsis[J].PlantCell, 2006,18(11): 3 158-3 170.
[21] ZHONG R, LEE C, MCCARTHY R L,etal. Transcriptional activation of secondary wall biosynthesis by rice and maize NAC and MYB transcription factors[J].PlantCellPhysiol., 2011,52(10): 1 856-1 871.
[22] 陈 娜, 蒋 晶, 曹必好, 等. 植物 NAC 转录因子功能研究新进展[J]. 分子植物育种, 2015,13(6): 1 407-1 414.
CHEN N, JIANG J, CAO B H,etal. The latest progresses on plant NAC transcription factors function[J].MolecularPlantBreeding, 2015,13(6): 1 407-1 414.
[23] 柳展基, 邵凤霞, 唐桂英, 等. 一个新的玉米 NAC 类基因(ZmNAC1) 的克隆与分析[J].遗传, 2009,31(2): 199-205.
LIU Z J, SHAO F X, TANG G Y,etal. Cloning and characterization of a transcription factorZmNAC1 in maize (Zeamays)[J].Hereditas, 2009,31(2): 199-205.
[24] 薛秀花, 任海云. 细胞骨架在植物细胞周期进程中的动态变化及其调控[J]. 北京师范大学学报(自然科学版), 2016,52(6): 687-695.
XUE X H, REN H Y. Cytoskeleton dynamics and regulation during plant cell cycle[J].JournalofBeijingNormalUniversity(Natural Science). 2016,52(6): 687-695.
[25] AZIMZADEH J, NACRY P, CHRISTODOULIDOU A,etal.ArabidopsisTONNEAU1 proteins are essential for preprophase band formation and interact with centrin[J].PlantCell, 2008,20(8): 2 146-2 159.
[26] DREVENSEK S, GOUSSOT M, DUROC Y,etal. TheArabidopsisTRM1-TON1 interaction reveals a recruitment network common to plant cortical microtubule arrays and eukaryotic centrosomes[J].PlantCell, 2012,24(1): 178-191.
[27] 朱海龙, 程光远, 彭 磊, 等. 甘蔗条纹花叶病毒P3蛋白与甘蔗 Rubiso大亚基互作的研究[J]. 西北植物学报, 2014,34(4): 676-681.
ZHU H L, CHENG G Y, PENG L,etal. Interaction between sugarcane streak mosaic virus P3 and Rubiso large subunit from sugarcane[J].ActaBotanicaBoreali-OccidentaliaSinica, 2014,34(4): 676-681.
[28] 赵艺泽, 刘 艳, 王锡锋. 利用酵母双杂交系统筛选介体异沙叶蝉中与小麦矮缩病毒外壳蛋白互作的蛋白质[J]. 中国农业科学, 2015,48(12): 2 354-2 363.
ZHAO Y Z, LIU Y, WANG X F. Screening of putative proteins in vectorPsammotettixalienusL. that are interacted with coat protein of wheat dwarf virus by a split-ubiquitin Yeast Membrane System[J].ScientiaAgriculturaSinica, 2015,48(12): 2 354-2 363.
[29] 曹新有, 刘阳娜, 陈 明, 等. 采用酵母双杂交系统筛选 GmDREB5 的互作蛋白[J]. 西北植物学报, 2009,29(4): 662-668.
CAO X Y, LIU Y N, CHEN M,etal. Screening of proteins involved in the interaction with GmDREB5 using Yeast Two-Hybrid System[J].ActaBotanicaBoreali-OccidentaliaSinica, 2009,29(4): 662-668.
[30] 梁 浩, 董爱武, 俞 瑜. 水稻 MRG701 互作蛋白的筛选和鉴定[J]. 复旦学报(自然科学版), 2016,55(1): 82-88.
LIANG H, DONG A W, YU Y. Screening interaction proteins of rice protein MRG701 by Yeast Two Hybrid[J].JournalofFudanUniversity(Natural Science), 2016,55(1): 82-88.

