沙门氏菌对养猪业的危害及防治措施
马梓承,古金元,彭 涛,王玉超,孟凡亮,刘照虎,王宏宇,胡东方,王方坤,刘思当(山东农业大学动物科技学院,山东 泰安 271000)
1 沙门氏菌分类与临床病变
猪沙门氏菌病(Swine salmonellosis)是由沙门氏菌属包括猪霍乱沙门氏菌、猪霍乱沙门氏菌变型、猪伤寒沙门氏菌、猪伤寒沙门氏菌变型、鼠伤寒沙门氏菌、德尔卑沙门氏菌、肠炎沙门氏菌等细菌引起的一种传染病,多发生于2~4月龄仔猪,故又称仔猪副伤寒。该菌两端钝圆,无芽孢无荚膜,有鞭毛,能运动,革兰氏染色阴性。沙门氏菌为需氧或兼性厌氧菌,适宜生长温度为 34 ℃,适宜 pH 为 6.7~7.7,在普通的平板培养基上培养即可,对营养需要不高,菌落呈圆形,直径为2~3 mm,光滑整齐,无色半透明,湿润,对外界因素如光照等有一定的抵抗力,可以生存数周或数月,常用化学消毒剂可以将其杀死,对消毒药抵抗力不强。多数沙门氏菌具有毒素,尤其是肠沙门氏菌、猪霍乱沙门氏菌和鼠伤寒沙门氏菌,具有很强的毒性,75℃加热1 h毒力依然存在,人食用可引发中毒[1]。
1.1 不同类型沙门氏菌感染猪后的临床表现
猪副伤寒沙门氏菌。急性型:又称败血型,多发生于断乳前后的仔猪,常突然死亡。病程稍长者,表现体温升高(41~42 ℃),腹痛,下痢,呼吸困难,耳根、胸前和腹下皮肤有紫斑,多以死亡告终。病程1~4 d。亚急性和慢性型:为常见病型;表现为体温升高,眼结膜发炎,有脓性分泌物;初便秘后腹泻,排灰白色或黄绿色恶臭粪便。病猪消瘦,皮肤有痂状湿疹。病程持续可达数周,终至死亡或成为僵猪。
猪霍乱沙门氏菌。猪霍乱沙门氏菌是副伤寒沙门菌的一种,是引起仔猪副伤寒的主要病原菌,可见病畜体温升高,精神沉郁,食欲减退,发抖,常趴下不起身。
肠炎沙门氏菌。肠炎沙门氏菌是引起急性胃肠炎的主要病原菌,感染后的典型症状包括发热、腹泻和呕吐等。
鼠伤寒沙门氏菌。感染后临床表现可分为4型,即胃肠炎型、败血症型、病灶感染型和无症状带菌型。苍蝇、跳蚤是传播媒介。感染主要通过受污染的食物传播。鼠伤寒沙门氏菌为侵袭性细菌,主要侵犯回肠和结肠,也可侵犯整个胃肠道。
1.2 临床剖检变化
病猪体温高达 40.2~41.4 ℃,精神不振、沉郁、寒颤、食欲降低及下痢,粪便恶臭呈灰黄色水样。眼有黏性分泌物,呼吸困难。一些病猪出现皮肤发绀,在耳根、胸前、腹下等皮肤出现紫红色斑点,多数病例在1~3 d内死亡。剖检可见尸体皮下水肿;皮下有大量出血点;颌下淋巴结肿大、出血坏死;脾脏肿大,颜色较暗带蓝,似橡皮,有大量出血点及坏死灶;肠系膜淋巴结索状肿大、出血;肝肿大、充血或出血,有的肝实质有灰黄色坏死点;肾脏肿大,被膜易剥离,有出血点;胃肠黏膜、浆膜有散在点状出血;胸腔积液,心包积液。肠管内有大量液体蓄积,肠道呈坏死性肠炎,结肠、盲肠壁增厚,黏膜表面覆盖一层弥漫性糠麸样坏死假膜,剥去假膜可见色红、边缘不规则的溃疡面[2]。其中,最典型的特殊病变为肝脏布满灰黄色坏死灶,如图1。
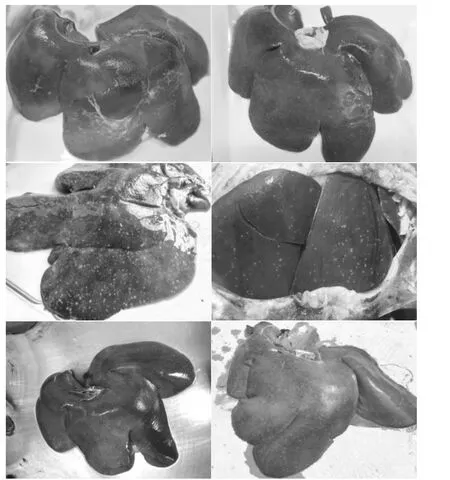
图1 猪沙门氏菌病肝脏剖检变化
2 沙门氏菌的检测方法
由沙门氏菌引起的中毒病在世界各地的食物中毒病例中所占比例非常高。有资料统计,在我国70%~80%细菌性食物中毒事件是由沙门氏菌引起,而由沙门氏菌引起中毒的食品中,约90%是肉、蛋、奶等畜产品。目前,在进行食品质量安全监控的中国计量认证检测时,沙门氏菌的检测已成为必检的卫生指标之一。传统的检测方法是先采用非选择性和选择性增菌,然后分离培养、生化反应和血清学鉴定,检验程序十分繁琐,且肠杆菌科细菌间的生化反应多有交叉,需4~7 d才能完成,因此传统的检测方法在快速、敏感与特异性等方面有自身的局限性。随着分子生物学及分子细菌学的发展,病原菌分离培养鉴定、酶联免疫吸附法(ELISA)、PCR等以其迅速、简便和灵敏等优点成为科研和临床诊断的技术热点,已广泛用于食品中以及临床样品和环境中的沙门氏菌的检测[3]。
2.1 传统分离鉴定培养
首先应采集病变样品,病猪取肝脏,粪便,回肠、盲肠或结肠内容物,然后对样品进行沙门氏菌的分离和鉴定,通常包括4个步骤:①预增菌:将样品置于营养性培养基中,保证正常和受损的沙门氏菌的存活;②选择性富集:保证沙门氏菌的生长并抑制其它微生物生长,多采用两种选择性培养基进行平行试验;③分离纯化:在沙门氏菌选择性平板上划线培养,然后挑取单菌落进行纯培养;④鉴定:方法主要包括显微镜检查、生化鉴定和血清凝集试验。将纯化后的沙门氏菌进行革兰氏染色,以参考菌株为对照在油镜下进行辨别观察。然后进行生化鉴定试验,读取生化鉴定试纸条生化指标,判断是否符合沙门氏菌特性。还可采用诊断血清对纯培养菌株进行玻片凝集试验,以无菌生理盐水为对照,1 min内明显凝集即为阳性,呈均匀浑浊者即为阴性。图2分别列举了沙门氏菌分离纯化(DHL板)、革兰氏染色镜检(双侧对称短杆状)及生化试验结果。

图2 沙门氏菌传统分离鉴定方法
目前,有关动物和动物产品沙门氏菌检测方法中国现行的国家标准为NY/T 550—2002,传统的培养检测方法仍广泛使用。该方法虽然准确度高,但耗时长,至少要3 d才能有初步结果,需要4~7 d才可得到明确的诊断结果,不够方便快捷[4]。
2.2 免疫学方法
由于细菌存在特征性的菌体抗原或鞭毛抗原,制备相应特异性的抗体便可用于快速检测特定的病原。利用抗体抗原结合的特异性和免疫放大技术,可建立十分灵敏的检测方法。目前,免疫学方法被广泛地应用于沙门氏菌检测,主要包括酶联免疫吸附法(ELISA)、斑点酶联免疫吸附法(Dot-ELISA)、免疫荧光标记法(FIA)、免疫磁性分离法(IMS)[5]。
2.3 分子生物学方法
分子生物学方法采用体外分子探针检测细菌核酸某段特异性的序列片段,对探针加以酶标、同位素等标志物,即可达到检测目的。目前主要的技术方法包括:PCR、多重PCR、实时荧光定量PCR、原位荧光环介导等温扩增(LAMP)技术、基因芯片技术、核酸探针技术。盘宝进等[6]对沙门氏菌进行PCR扩增,其产物片段大小为284 bp,引物序列如表1,电泳结果如图3。
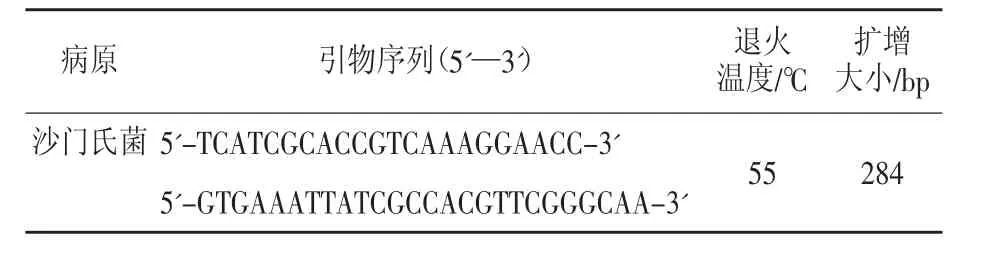
表1 PCR/RT-PCR引物序列
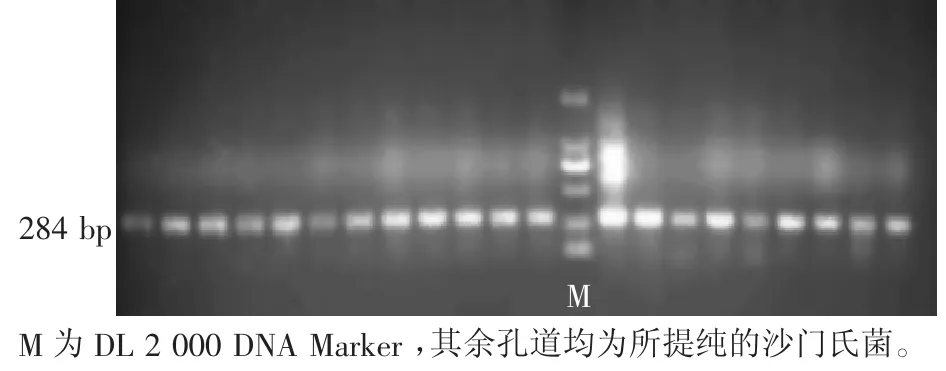
图3 琼脂糖凝胶电泳结果
3 沙门氏菌不同血清型间差异与药敏试验
沙门氏菌具有复杂的抗原结构,一般分为菌体O抗原和鞭毛H抗原,极个别的沙门氏菌含有荚膜Vi抗原。目前,根据Kauffman-White(K-W)血清型分型方法,基于沙门氏菌菌体抗原及鞭毛抗原的差异,可分为2 600种沙门氏菌血清型[7]。O抗原是包含在脂多糖(LPS)中的特异性多糖物质,是革兰氏阴性细菌的一个重要组成部分。编码O抗原的基因通常位于染色体上一个称为rfb的基因簇中,rfb基因参与核普酸糖的生物合成途径以及重复单元组件的转移。Wzx基因(即rfb X基因)可编码一种跨膜蛋白,这种跨膜蛋白由12种跨膜片段组合而成,并存在于所有这些沙门氏菌O抗原基因簇中。不同O抗原簇中的Wzx蛋白具有结构同源性。然而它们在氨基酸序列水平上极少相似[8]。有研究指出,Wzx蛋白的功能就是负责把O-单元从细胞质运送到细胞质膜的周质侧[9]。另一方面,鞭毛抗原H1和H2分别由fliC基因和fljB基因编码,这两个基因的末端都很保守,而在其编码抗原的中心区域却高度可变[10-11]。
人们一直在研究代替或补充传统血清分型方法的分子检测方法,如核糖分型[12]、RAPD分子标记技术[13]、IS200分型技术[14]分析等。随着人们研究的不断深入,PCR及其它以核酸为基础的分子诊断技术在生物学分类鉴定方面应用愈加广泛,大幅缩短了实验室检测时间,而且易于规范化,对人员要求不高,在一定程度上弥补了传统鉴定分型方法的不足[15]。施开创等[16]采用MLST预测及PCR直接测定的方法对沙门氏菌21种常见血清型进行鉴定,其中PCR方法是基于编码不同抗原O抗原、H1抗原和H2抗原的基因设计的,相较于MLST预测方法,PCR方法能够更为准确、直接地鉴定沙门氏菌血清型,具有耗时少、费用低等优点,并能与其它分型方法相结合,具有更为广阔的应用空间。
药敏试验根据血清型的不同,选用34种沙门氏菌病原进行,其中有A群1株、B群15株、C2群1株、D群14株和未定型3株,如表2。
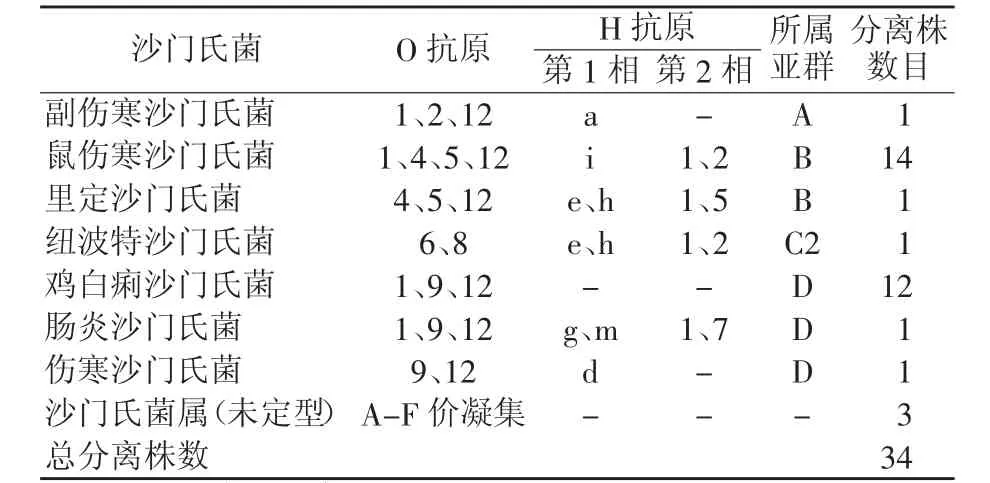
表2 34株沙门氏菌分离株的血清型分析
对已鉴定的34株致病性沙门氏菌分离株采用ATB VET药敏试剂条法和K-B纸片法进行抗菌药物敏感性试验,分别通过ATB仪读取结果和人工游标卡尺测量结果并进行比较分析。由表3可知,34株分离株均对美洛培南、亚胺培南、大观霉素和安普霉素敏感;对氯霉素、卡那霉素、庆大霉素的耐药率小于10%,对阿莫西林、链霉素、氟甲喹、噁喹酸、磺胺甲噁唑、四环素和呋喃妥因耐药率介于50%和90%之间,而对红霉素、林可霉素、原始霉素、泰洛星、青霉素、苯唑西林、夫西地酸、利福平和甲硝唑的耐药率达到100%,耐药性严重,且存在多重耐药现象,如表3。

表3 34株沙门氏菌分离株对30种抗菌药物的敏感性试验
4 沙门氏菌病的防治
4.1 沙门氏菌病的预防
沙门氏菌病的预防措施主要为疫苗接种及日常饲养管理的加强,不建议预防用药。在养猪过程中要定期监测畜舍中致病沙门氏菌(至少包括肠炎沙门氏菌和鼠伤寒沙门氏菌)的状况,有利于避免疾病的暴发。对于养殖使用的水和饲料同样需要注意保存,避免沙门氏菌的污染,若检测结果为阳性,不可继续直接使用。
目前用于预防畜禽沙门氏菌常见的疫苗分为两大类:①灭活疫苗:主要包括肠炎沙门氏菌灭活疫苗和鼠伤寒沙门氏菌灭活疫苗[17];②弱毒活疫苗:多为鼠伤寒沙门氏菌活疫苗、肠炎沙门氏菌活疫苗等。由于弱毒沙门氏菌推荐免疫时间较晚,早期存在免疫缺口,而目前预防沙门氏菌感染最常用的为弱毒沙门氏菌疫苗。弱毒沙门氏菌是指通过理化、基因工程等方法,使某些与其毒力相关的基因发生不可逆突变,达到降低毒力目的而获得的沙门氏菌菌株。目前,沙门氏菌弱毒株还多用作疫苗载体携带外源基因,随着弱毒株的增殖不断表达相应的免疫原性蛋白,从而达到免疫目的。
目前畜禽养殖中针对沙门氏菌病的预防主要采用抗菌药物,而沙门氏菌的感染多伴随混合感染,养殖户大多采用广谱类抗菌药物,如阿莫西林等抗生素进行细菌病预防。
4.2 沙门氏菌的治疗
目前治疗沙门氏菌常见的药物包括:①新霉素:可用于治疗沙门氏菌引起的胃肠道感染,预混剂以新霉素计混饲给药,猪77~154 g/1 000 kg饲料;可溶性粉混饮50~75 mg/L水,连续3~5 d;②土霉素:内服单次量,猪10~25 mg/kg体重,一日2~3次,连用3~5 d。③甲砜霉素:内服单次量,猪5~10 mg/kg体重,一日2次,连用2~3 d。④黏菌素:混饮,以黏菌素计。猪40~200 mg/L水;混饲,猪(哺乳期)2~40 g/1 000 kg饲料,仔猪2~20 g/1 000 kg饲料。⑤磺胺嘧啶:混饲,单日量,猪 15~30 mg/kg 体重,连用 5 d[18]。在此基础上,建议养殖户在治疗沙门氏菌感染时,参考病原菌的体外抗生素敏感试验的结果进行用药,可有效避免滥用抗菌药物导致的疗效差、治疗成本高、产生耐药性等问题。
[1]谢莉莉,黄舒云.猪副伤寒的诊断及防治[J].中国畜禽种业,2015(6):116-117.
[2]何晶,吴凌,王国良,等.仔猪副伤寒的诊断与治疗[J].畜禽业,2008(11):74-75.
[3]Judy S W,Karen L J,Suresh D P,et al.Specific detection of salmonella spp.by muotiplex polymerase chian reaction[J].Applied and Enviromental Microbiology,1993,59(5):1473-1479.
[4]杨怀珍,牟亚,罗薇.食源性沙门氏菌的研究进展[J].黑龙江畜牧兽医,2016(7):69-71.
[5]牛瑞江.沙门氏菌富集及ELISA检测方法的研究[D].南昌:南昌大学,2012.
[6]盘宝进,韦梅良,汪文龙,等.应用二重PCR快速检测实验猴沙门氏菌和志贺氏菌[C].中南地区实验动物科技交流会论文集,2009.
[7]翟立公.沙门氏菌及其致病性血清型分子检测技术研究及在食品中的应用[D].南京:南京农业大学,2015.
[8]Marolda C L,VicarioliI J,Valvano M A.Wzx proteins involved in biosynthesis of O antigen function in association with the first sugar of the O-specific lipopolysaccharide subunit[J].Microbiology,2004,150(12):4095-4105.
[9]Samuel G,Reeves P.Biosynthesis of O-antigens:genes and pathways involved in nucleotide sugar precursorsynthesis and O-antigen assembly[J].Carbohydrate Research,2003,338(23):2503-2519.
[10]Mcquiston J R,Parrenas R,Ortiz-Rivera M,et al.Sequencing and comparative analysis of flagellin genes fli C,flj B,and flp A from Salmonella[J].Journal of Clinical Microbiology,2004,42(5):1923-1932.
[11]Joys T M.The covalent structure of the phase-1 flagellar filament protein of Salmonella typhimurium and its com-parison with other flagellins[J].Journal of Biological Chemistry,1985,260(29):15758-15761.
[12]Estsbane,Snipesk,Hirdd,et al.Use of ribotyping for characterization of Salmonella serotypes[J].Journal of Clinical Microbiology,1993,31(2):233-237.
[13]Shangkuan Y H,Lin H C.Application of random amplified polymorphic DNA analysis to differentiate strains of Salmonella typhi and other Salmonella species[J].Journal of Applied Microbiology,1998,85(4):693-702.
[14]Uzzau S,Hovi M,Stocker B A D.Application of ribotyping and IS200 fingerprinting to distinguish the five Salmonella serotype O6,7:c:1,5 groups:Choleraesuissensustricto,Choleraesuis var.Kunzendorf,Choleraesuis var.Decatur,Paratyphi C and Typhisuis[J].Epidemiology and Infection,1999,123(1):37-46.
[15]Abubakar I,Irvine L,Aldus C F,et al.A systematic review of the clinical,public health and cost-effec-tiveness of rapid diagnostic tests of the detection and identification of bacterial intestinal pathogens in faeces and food[J].Health Technol Assess,2007,11(36):1-216.
[16]施开创,李凤梅,邹联斌,等.鸡源致病性沙门氏菌的分离鉴定及血清型和药物敏感性分析[J].中国畜牧兽医,2015,42(8):2160-2168.
[17]Jawale C V,Lee J H.Characterization of adaptive immune responses induced by a new genetically inactivated Salmonella Enteritidis vaccine[J].Comp Immunol Microbiol Infect Dis,2014,37(3):159-167.
[18]中国兽药典委员会.中国兽药典-兽药使用指南(化学药品卷)[M].北京:中国农业出版社,2015:366-369,20-22,58-61,371-372,446-451.

