不同营养水平饲粮和添加益生菌对生长肥育猪生长性能和养分消化率的影响
敖 翔,周建川,张立泰,李元凤,何 健
(1.四川铁骑力士集团冯光德实验室,四川 绵阳 621006;2.西南科技大学生命科学与工程学院,绵阳 621010)
益生菌是一类活的微生物添加剂,其直接或间接有利于提高宿主肠道微生物区系的平衡[1]。在畜牧业中常用的益生菌包括芽孢杆菌、双歧杆菌、肠球菌、乳酸杆菌、丁酸梭菌以及酵母培养物。有研究表明益生菌有利于维持肠道菌群平衡,提高动物免疫力和健康[2]。益生菌提高仔猪和生长猪的生长性能和饲料转化率[3-4]。Shon等(2005)[5]研究发现益生菌提高了生长肥育猪的生长性能。然而,也有一些试验结果显示,益生菌对断奶仔猪和生长猪生长性能无显著影响[6-7]。上述不同的研究结果可能由于益生菌的种类、活菌数、添加比例以及动物的日龄、生理状态和饲养环境等存在差异。
饲粮营养水平会影响动物的生长性能。然而,目前大多数的研究结果都是在同一营养水平下评估益生菌的效果。因此,本试验旨在探讨不同营养水平饲粮和添加益生菌对生长肥育猪生长性能和养分消化率的影响,为其在生产中的实际应用提供参考。
1 材料与方法
1.1 益生菌来源
试验用益生菌为韩国Woogene B&G公司产品Sporezyme,含有枯草芽孢杆菌和丁酸梭菌,活菌数分别为 1.0×1010和 1.0×1010CFU/g。
1.2 试验设计
试验采用随机试验设计,选择体重相近的健康杜长大三元杂种生长猪150头,平均体重为(47.7±1.1)kg。按体重相近、公母各半的原则随机分为3个处理,每个处理5个重复,每个重复10头生长猪。试验处理如下:高营养组,饲喂高营养水平饲粮;低营养组,饲喂低营养水平饲粮;(低营养+益生菌)组,低营养组饲粮中添加益生菌2 000 g/t。试验期共计70 d。
1.3 试验动物饲养管理
饲养试验于2017年11月至2018年1月在四川铁骑力士实业有限公司花荄试验基地开展。生长猪饲养栏舍为封闭、漏缝地板式猪舍。饲喂、饮水和免疫等饲养管理按商业养殖场规范操作,采用自由采食,鸭舌式自动饮水器饮水。每天密切观察生长肥育猪的采食情况、粪便质量,以及其它异常情况,并作好详细记录。同时每天记录圈舍的温度、湿度和死淘数。
1.4 试验饲粮配制与生产
试验饲粮参考NRC(2012)营养标准配制生长肥育猪饲料。先对玉米、豆粕、玉米蛋白粉等大宗原料采样,分析测定水分、粗蛋白质等,然后设计配方。试验料生产在四川铁骑力士实业有限公司进行,温度控制在70~75℃。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平
1.5 样品采集与处理
1.5.1 饲料样品 每个处理均匀取样品250 g,贮存于冰柜4℃,送检测中心进行饲料常规养分含量测定。1.5.2 生长性能指标 在试验第0天、第35天和第70天的早上8:00,生长猪空腹称量,记录体重数据,计算生长肥育猪 0~35 d、36~70 d 和 0~70 d 的平均日增重(ADG)。在试验期间每天记录生长肥育猪每圈的投料量、余料量、浪费量,计算生长肥育猪0~35 d、36~70 d和0~70 d的平均日采食量(ADFI)。按平均日采食量和平均日增重之比计算料重比(F/G)。
1.5.3 养分表观消化率 每个重复随机选4头猪于试验第35天和第70天采集粪样,加10%盐酸(HCl)进行固氮,混合后保存在-20℃。所采集的粪样在65℃烘干48 h至恒重,粉碎过40目筛后冷藏备测。本试验采用内源指示剂法(酸不溶灰分,AIA)[8]测定消化率,参照美国AOAC(2000)[9]的分析方法测定饲粮和粪便中养分的含量,采用绝热式氧弹热量计测定总能。营养物质表观消化率计算参照Stein等(2001)[10]的方法。
饲料消化率的计算公式为:D=1-FIA/EIA。式中:D为消化率;FIA为食物中酸不溶灰分含量;EIA为粪样中酸不溶灰分含量。

1.6 数据统计与分析
用Excel 2010进行数据统计,应用SAS 8.0统计软件进行方差分析(ANOVA),差异显著采用Duncan's法进行多重比较,以p<0.05作为差异显著性判断标准。
2 试验结果
2.1 不同营养水平饲粮和添加益生菌对生长肥育猪生长性能的影响
由表2可知,0~35 d,高营养组和(低营养+益生菌)组的日增重分别显著高于低营养组90、80 g,而日采食量和料重比分别显著低于低营养组140 g、0.46,135 g、0.43。36~70 d,高营养组的日增重显著高于低营养组105 g,而料重比分别显著低于低营养组和(低营养+益生菌)组 0.27、0.05,各处理组间日采食量无显著差异(p>0.05)。0~70 d,高营养组的日增重显著高于低营养组97 g,而高营养组和(低营养+益生菌)组的料重比分别显著低于低营养组0.37、0.33,各处理组间日采食量无显著差异(p>0.05)。
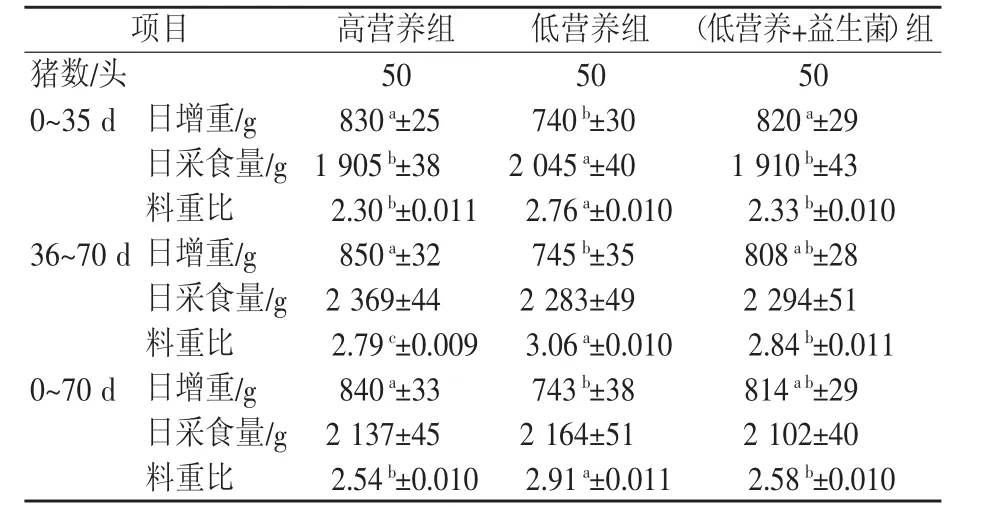
表2 不同营养水平饲粮和添加益生菌对生长肥育猪生长性能的影响
2.2 不同营养水平饲粮和添加益生菌对生长肥育猪养分表观消化率的影响
由表3可知,35 d,高营养组和(低营养+益生菌)组的干物质、氮和总能消化率显著高于低营养组(p<0.05),而(低营养+益生菌)组氮和总能的消化率显著低于高营养组(p<0.05)。70 d,高营养组干物质、氮和总能消化率显著高于(低营养+益生菌)组(p<0.05),而(低营养+益生菌)组干物质、氮和总能消化率显著高于低营养组(p<0.05)。

表3 不同营养水平饲粮和添加益生菌对生长肥育猪养分表观消化率的影响
3 讨论
3.1 不同营养水平饲粮和添加益生菌对生长肥育猪生长性能的影响
如试验预期,本次试验结果显示低营养组降低了生长肥育猪的生长性能。类似地,低营养水平饲粮降低了生长猪日增重[11-12]。Yan等(2009)[13]研究表明增加饲粮营养水平提高了生长肥育猪的日增重,降低了料重比,这可能由于其采食量和养分消化率提高了。本次试验中,在低营养组中添加益生菌提高了前期的日增重,降低了全期的料重比,说明益生菌对生长肥育猪具有有益作用。与本次试验一致,Chen等(2006)[14]研究发现添加 0.2%复合益生菌(乳酸菌、酵母菌和枯草芽孢杆菌)提高了生长猪日增重。然而,也有一些研究未发现益生菌对生长肥育猪的有益作用[15-16]。这可能由于生长肥育猪的消化系统发育较为完善,耐受力较强,因此益生菌对生长性能的提高效果不明显。刘辉等(2015)[4]研究表明0.1%复合益生菌(乳酸杆菌和酵母菌)提高了生长肥育猪的日增重和饲料转化率,且13~30 kg阶段益生菌对日增重和料重比的影响优于30~50 kg阶段,这与之前的研究结果相似[17-18]。
3.2 不同营养水平饲粮和添加益生菌对生长肥育猪表观消化率的影响
本次试验结果显示在35 d和70 d时,与低营养组相比,添加益生菌提高了干物质、氮和总能的消化率。与本次试验结果一致,Jørgensen 等(2016)[19]研究发现低能饲粮显著降低了干物质和氮的消化率,在低能饲粮中添加400 g/t益生菌(枯草芽孢杆菌)显著提高了氮的消化率,说明益生菌的有益作用受饲粮营养水平的影响。类似地,刘辉等(2015)[4]和Kunavue等(2012)[20]报道益生菌显著提高了生长猪养分消化率。而养分消化率的提高可以间接反映其对料重比的改善。益生菌提高养分消化率可能由于其对肠道菌群的有益作用[21]。
4 结论
在本试验条件下,与低营养组相比,高营养组显著提高了生长性能和养分消化率,而在低营养组中添加益生菌可部分改善生长性能和养分消化率,但未达到高营养组水平。
[1]Fuller R.Probiotics in man and animals[J].Journal of Applied Bacteriology,1989,66:365-378.
[2]Ferencik M,Mikes Z,Seman M,et al.Beneficial modification of the human intestinal microflora using orally administered enterococci[J].High Tatras Slovac Republic,2000,46:11-14.
[3]Van Heugtene E,Funderburke D W,Dorton K L.Growth performance,nutrient digestibility,and fecal microflora in weanling pigs fed live yeast[J].Journal of animal science,2003,81(4):1004-1012.
[4]刘辉,季海峰,王四新,等.益生菌对生长猪生长性能、粪便微生物数量、养分表观消化率和血清免疫指标的影响[J].动物营养学报,2015,27(3):829-837.
[5]Shon K S,Hong J W,Kwon O S,et al.Effects of Lactobacillus reuteri-based direct-fed microbial supplementation for growingfinishing pigs[J].Asian-australas Journal of Animal Science,2005,18:370-374.
[6]虞泽鹏,谢启轮,唐举,等.益生素对断乳仔猪生产性能的影响[J].动物科学与动物医学,2002,19(3):49-50.
[7]De Moraes,K M C M T,Berto D A.Probiotics for suckling and weaned piglets[J].Veterinária E Zootecnia,2010,17(4):519-527.
[8]Vogtmann H,Pfirter H P,Prabucki A L.A new method of determining metabolisability of energy and digestibility of fatty acids in broilers chickens[J].British Poultry Science,1975,16(5):531-534.
[9]AOAC.Official Methods of Analysis[J].17th ed.Assoc Off Anal Chem,2000 Gaithersburg,MD.
[10]Stein H H,Kim S W,Nielsen T T,et al.Standardized ileal protein and amino acid digestibility by growing pigs and sows[J].Journal of Animal Science,2001,79(8):2113-2122.
[11]Quiniou N,Dourmad J Y,Noblet J.Effect of energy intake on the performance of different types of pig from 45 to 100 kg body weight[J].Animal Science,1996,63:277-288.
[12]Quiniou N,Noblet J.The effect of energy supply on the contribution of lean tissue to total body protein mass in pigs slaughtered at 100 kg[J].Animal Science,1997,65:509-513.
[13]Yan L,Wang J P,Kim H J,et al.Influence of essential oil supplementation and diets with different nutrient densities on growth performance,nutrient digestibility,blood characteristics,meat quality and fecal noxious gas content in grower-finisher pigs[J].Livestock Science,2009,128:115-122.
[14]Chen Y J,Min B J,Cho J H,et al.Effects of dietary Bacillusbased probiotic on growth performance,nutrient digestibility,blood characteristics and fecal noxious gas content in finishing pigs[J].Asian-australas Journal of Animal Science,2006,19:587-592.
[15]Kornegay E T,Risley C R.Nutrient digestibilities of a cornsoybean meal diet as influenced by Bacillus products fed to finishing swine[J].Journal of Animal Science,1996,74:799-805.
[16]Kornegay E T,Wood C M,Ball G G,et al.Use of Lactobacillus acidophilus for growing and finishing pigs[J].Animal Science Research Report,1990,9:13.
[17]毛倩,陈代文,余冰,等.复合益生素对生长育肥猪生产性能、盲肠菌群及代谢产物的影响[J].中国畜牧杂志,2010,46(17):34-39.
[18]Giang H H,Viet T Q,Ogle B,et al.Effects of Supplementation of Probiotics on the Performance,Nutrient Digestibility and Faecal Microflora in Growing-finishing Pigs[J].Asian Australasian Journal of Animal Sciences,2011,24(5):655-661.
[19]Jørgensen J N,Laguna J S,Millán C.Effects of a Bacillusbased probiotic and dietary energy content on the performance and nutrient digestibility of wean to finish pigs[J].Animal Feed Science and Technology,2016,221:54-61.
[20]Kunavue N,Lien T F.Effects of fulvic acid and probiotic on growth performance,nutrient digestibility,blood parameters and immunity of pigs[J].Journal of Animal Science Advances,2012,2(8):711-721.
[21]Djouzi Z,Andrieux C,Degivry M C,et al.The association of yogurt starters with Lactobacillus casei DN 114.001 in fermented milk alters the composition and metabolism of intestinal microflora in germ-free rats and in human flora-associated rats[J].Journal of Nutrition,1997,127:2260-2266.

