盐胁迫下油菜素内酯对玉米幼苗生理特性的影响
魏 湜,吉 彪,李 赞,顾万荣*
(1.东北农业大学农学院,哈尔滨 150030;2.哈尔滨市农业科学院,哈尔滨 150029)
盐渍化是造成农作物减产主要因素之一。据联合国教科文组织和粮农组织不完全统计,全球范围内可耕地中,灌溉区域的19.5%及非灌溉区域的2.1%,受盐胁迫影响严重[1]。随人口持续增长、工业发展、不合理田间管理等原因,次生盐碱化土地面积增加[2]。因此,提高盐胁迫下作物耐受性及产量是亟待解决问题之一。
玉米是盐敏感作物,盐胁迫影响玉米植株生长发育,导致产量及品质下降;破坏玉米细胞光合色素,导致光合能力下降;减少植株对土壤营养物质吸收与同化,出现营养失衡,抑制生长[3];大量积累细胞自由基及活性氧,细胞膜完整性受破坏[4]。植物适应盐胁迫环境时可形成耐受调控机理,包括对离子稳态调节、有机渗透物质积累和活性氧清除等[5]。盐胁迫造成伤害如超过其自身调控能力,导致植株死亡。因此,研究玉米耐盐能力具有重要意义。外源施加植物生长调节剂和渗透调节物质可显著缓解盐胁迫对植株影响。水杨酸、细胞分裂素和赤霉素等植物激素可显著缓解盐胁迫对玉米离子毒害,渗透调节物质可维持植物细胞膨压、促进营养物质吸收、缓解活性氧毒害作用,维持细胞膜稳定性[6]。油菜素内酯(Brassinolide,BRs),又名芸苔素内酯,是以甾醇为骨架的植物激素,不仅可调节植株生长发育,且显著缓解盐胁迫对植株毒害作用[7]。研究表明,油菜素内酯可显著缓解茄子(Solanum melongena)[8]、水稻(Oryza sativa)[9]种子萌发及幼苗期盐抑制;保护小麦(Triticum aestivum)细胞膜盐胁迫下完整性,防止叶绿素降解,促进植株生长[10];提高黄瓜(Cucumis sativus)盐处理下抗氧化酶活性,降低细胞活性氧含量[11];外源油菜素内酯施加降低水稻丙二醛含量并改变油菜素内酯合成基因(OsDWF4)表达,提高其耐盐性[12]。
综上所述,盐胁迫下,外源油菜素内酯施加可调控植物生理功能,显著缓解盐胁迫对植株毒害,改善植株生长状态,提高存活率。本试验以150 mmol·L-1NaCl模拟盐胁迫,研究盐胁迫下外源施用油菜素内酯对玉米幼苗抗氧化酶系统、渗透调节物质、光合能力和内源激素含量影响,旨在明确油菜素内酯提高玉米耐盐能力生理途径。
1 材料与方法
1.1 材料培养及处理
1.1.1 试验材料
供试玉米品种先玉335由东北农业大学农学院玉米研究室提供,油菜素内酯购自上海威敌生物公司。
1.1.2 玉米幼苗培养及处理
试验于2016、2017年在东北农业大学农学院温室完成。籽粒饱满、尺寸一致玉米种子经0.1%HgCl2消毒、无菌水浸泡24 h后,播种在放有蛭石,直径0.5 m,深度7 cm圆盘中培养。待幼苗生长至2叶1心时移至装有15 L 1/2霍格兰营养液水培槽中,24 h通气以保持含氧量,16 h/8 h光照周期,每3 d更换一次营养液。玉米幼苗生长至3叶1心时试验处理,处理前更换营养液。油菜素内酯采用叶面喷施,浓度分别为0和0.15 mg·L-1,每个水培槽施加100 mL。施加油菜素内酯24 h后,每隔12 h在水培槽中添加43.83 g NaCl,分3次加入NaCl至终浓度为0和150 mmol· L-1,NaCl浓度为150 mmol· L-1时即为0 h。四个处理分别为:0 mg·L-1BRs+0 mmol·L-1NaCl(CK),0 mg·L-1BRs+150 mmol·L-1NaCl(N),0.15 mg·L-1BRs+0 mmol· L-1NaCl(B),0.15 mg·L-1BRs+150 mmol·L-1NaCl(NB)。分别于处理后0、12、24、36、48 h摘取玉米幼苗第2片叶用于测定,液氮速冻后于-80℃保存待用,每个试验处理3次重复。
1.2 氧化损伤及抗氧化酶活性指标测定
采用硫代巴比妥酸法测定丙二醛(MDA)含量[13];采用羟氨氧化法测定超氧阴离子(O2-)含量[14];采用NBT还原法测定超氧化物歧化酶(SOD)活性[15];采用愈创木酚法测定过氧化物酶(POD)活性[16];采用紫外吸收法测定过氧化氢酶(CAT)活性[17]。
1.3 光合能力指标测定
SPAD数值采用CCM-220+手持叶绿素仪测定;LCPRO+便携式光合作用测定仪测定玉米幼苗光合速率、蒸腾速率、气孔导度和胞间CO2浓度。
1.4 内源激素含量测定
采用酶联免疫(ELISA)吸附法测定生长素(IAA)、赤霉素(GA3)、脱落酸(ABA)和玉米素核苷(ZR),试剂盒购自上海恒远生化试剂有限公司。
1.5 数据分析统计
采用Microsoft Excel 2010处理数据和作图,SPSS 17.0软件作多重比较与方差分析(α=0.05)。
2 结果与分析
2.1 外源BRs对盐胁迫下玉米幼苗叶片损伤及抗氧化酶活性影响
本研究测定不同处理下玉米幼苗叶片MDA和O2-含量及抗氧化酶SOD、POD及CAT活性,结果见图1。盐胁迫下,MDA及O2-含量相比对照组均显著增加,且随处理时间增加呈上升趋势。胁迫48 h后,与CK相比,N处理MDA含量升高90.91%,O2-含量升高195.56%,差异显著。施用BRs降低叶片MDA及O2-含量。胁迫48 h后,与N处理相比,NB处理MDA含量下降30.74%,胁迫36 h后,NB处理O2-含量相比N处理下降36.38%。盐胁迫下,玉米叶片SOD、POD和CAT活性均显著升高,缓解盐胁迫所致的氧化胁迫。胁迫12 h后,与CK相比,N处理SOD、POD和CAT活性分别提高111.56%、95.50%和85.47%。未胁迫生长条件下,BRs施加对抗氧化酶活性无显著影响,而盐胁迫下,BRs可进一步提高玉米叶片抗氧化酶活性。胁迫48 h后,与N处理相比,NB处理SOD、POD及CAT活性分别提高15.22%、39.16%和37.61%。结果表明,BRs可显著降低盐胁迫下玉米叶片MDA及O2-含量,提高抗氧化酶活性,缓解活性氧对细胞毒害并维持细胞膜稳定性。
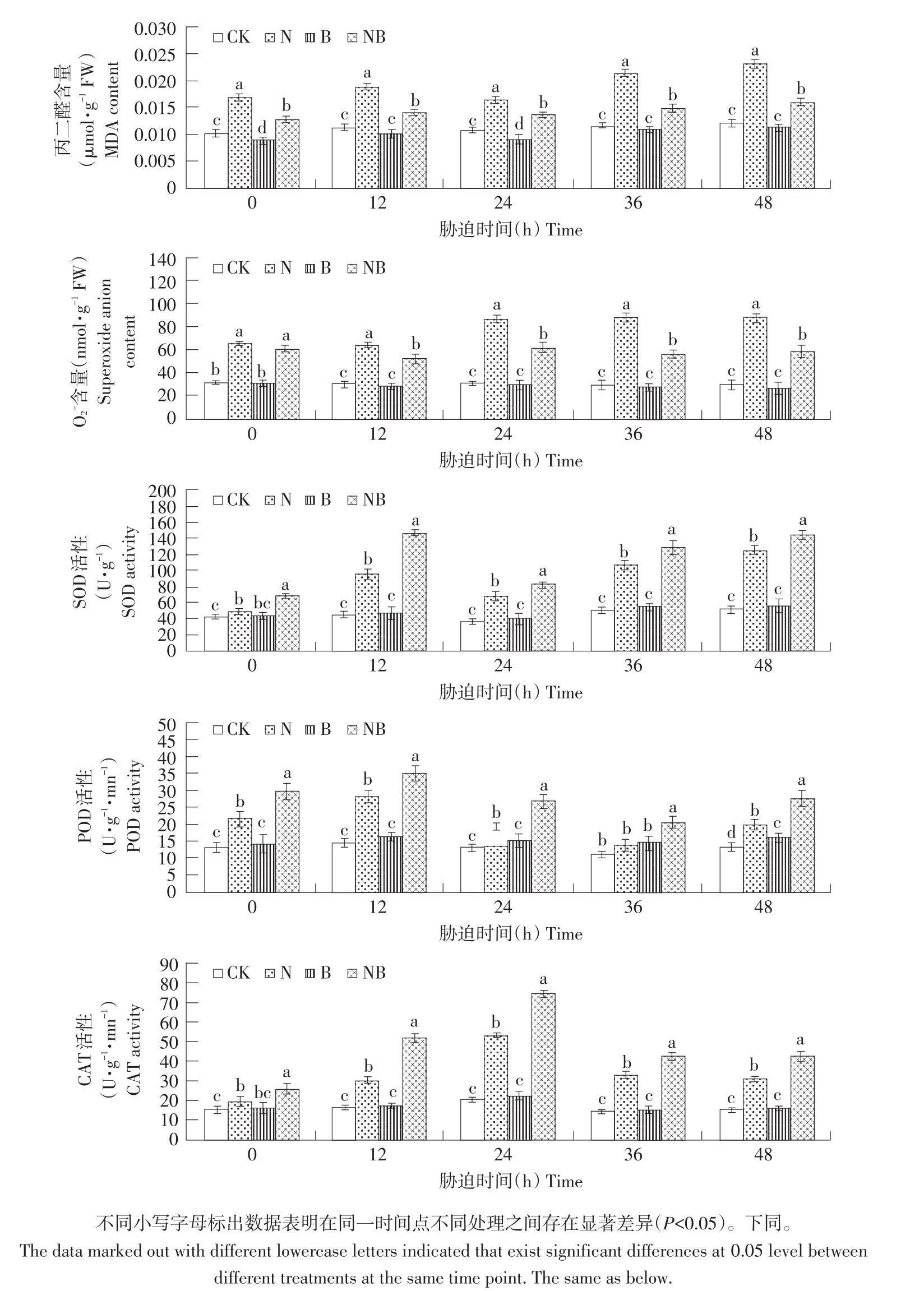
图1 外源BRs对盐胁迫下玉米幼苗叶片损伤及抗氧化酶活性影响Fig.1 Effects of exogenous BRs on leaf injury and antioxidant enzyme activity of maize seedlings under salt stress
2.2 外源BRs对盐胁迫下玉米幼苗渗透调节物质影响
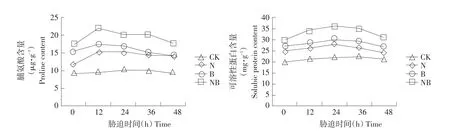
图2 外源BRs对盐胁迫下玉米幼苗叶片脯氨酸及可溶性蛋白含量影响Fig.2 Effects of exogenous BRs on proline and soluble protein content in leaves of maize seedlings under salt stress
如图2所示,随盐胁迫时间增加,N处理玉米叶片脯氨酸及可溶性蛋白含量均呈先升后降趋势。盐胁迫下,细胞脯氨酸与可溶性蛋白含量增加,参与维持细胞渗透平衡。脯氨酸含量处理12 h时达峰值随后下降,可溶性蛋白含量处理24 h时达峰值。随BRs外源施用,玉米叶片脯氨酸及可溶性蛋白含量进一步升高。相比N处理,NB处理脯氨酸与可溶性蛋白含量48 h时分别提升27.25%和29.02%。较高脯氨酸及可溶性蛋白含量可维持细胞渗透调节稳定,抵御盐胁迫伤害。
2.3 外源BRs对盐胁迫下玉米幼苗叶片光合作用影响
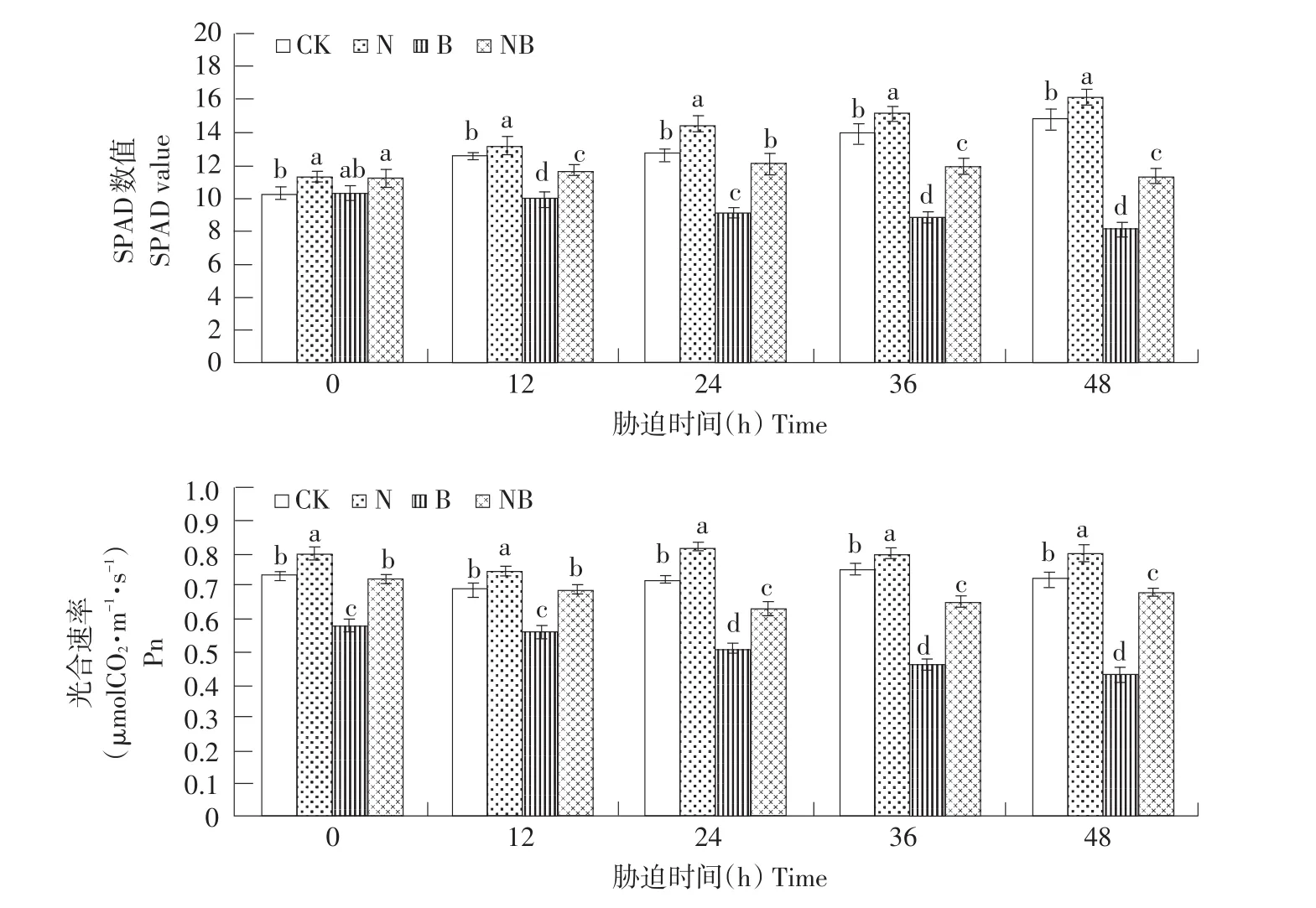
如图3所示,与CK相比,N处理玉米幼苗SPAD数值、光合速率、蒸腾速率、气孔导度均呈下降趋势,胞间二氧化碳浓度呈上升趋势,且随处理时间增加,差异显著。相比CK,B处理植株光合能力显著增强。由此可见,非胁迫生长条件下,施用BRs可促进植株光合作用,利于生长。盐胁迫下,玉米叶片细胞活性氧增加,光和色素受到破坏,叶绿素含量下降,植株光合作用能力减弱。BRs施加显著改善盐胁迫所致的光合能力限制。如图3所示,相比N处理,NB处理玉米幼苗SPAD数值、光合速率、蒸腾速率、气孔导度均显著上升,胞间二氧化碳浓度呈下降趋势。处理48 h后,NB处理植株SPAD数值、光合速率、蒸腾速率、气孔导度相比N处理分别提高28.09%、58.14%、54.54%、85.74%,胞间二氧化碳浓度下降12.56%。
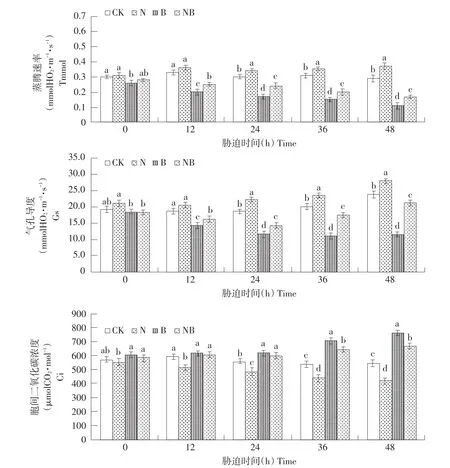
图3 外源BRs对盐胁迫下玉米幼苗叶片光合作用影响Fig.3 Effects of exogenous BRs on photosynthesis of maize seedling leaves under salt stress
2.4 外源BRs对盐胁迫下幼苗叶片内源激素含量影响
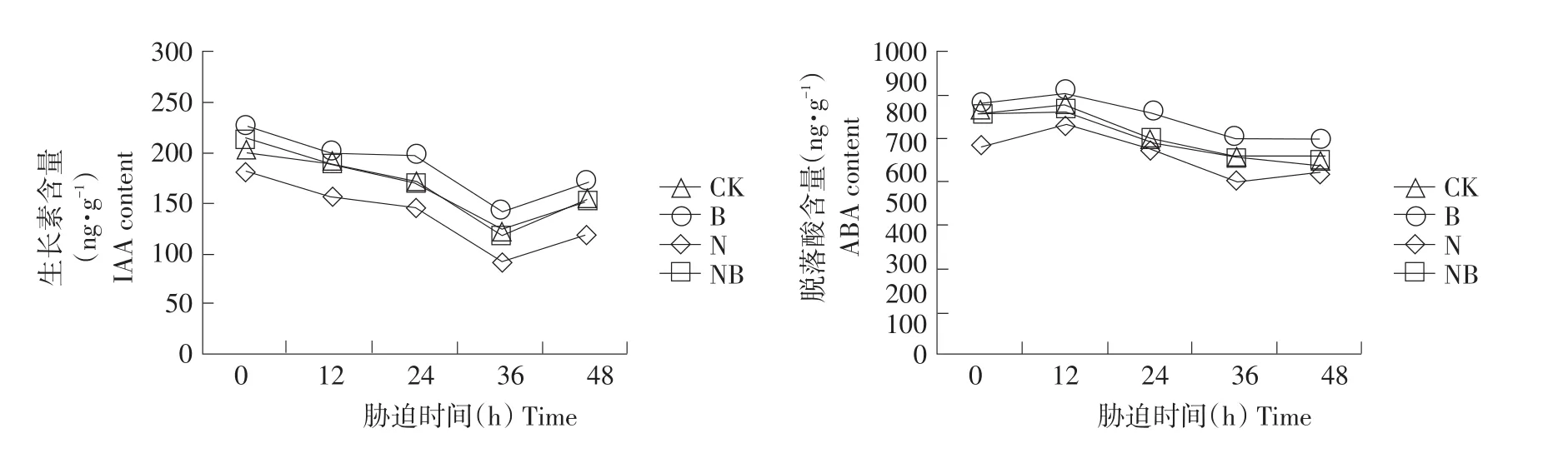
测定不同处理下玉米幼苗叶片内源生长素、赤霉素、玉米素核苷、脱落酸含量,结果见图4。随处理时间增加,植株生长素含量呈先降后升趋势。与CK相比,N处理生长素含量减少,处理12 h后下降16.93%;与N处理相比,BRs施用增加植株生长素含量。处理48 h后,NB处理生长素含量升高26.89%。赤霉素具有促进细胞生长和种子萌发作用,也参与植株对外界胁迫响应。盐胁迫生长条件下,玉米幼苗叶片赤霉素含量下降。胁迫36 h后,与CK相比,N处理赤霉素含量下降13.42%。BRs可促进盐胁迫下玉米幼苗叶片赤霉素含量上升。处理48 h后,与N处理相比,NB处理赤霉素含量升高34.69%。

图4 外源BRs对盐胁迫下玉米幼苗叶片内源激素含量影响Fig.4 Effects of exogenous BRs on endogenous hormones in maize seedling leaves under salt stress
随处理时间增加,玉米幼苗叶片玉米素核苷含量先降再小幅上升。盐胁迫下,玉米素核苷含量小幅降低,处理48 h后,与CK相比,N处理玉米素核苷含量降低8.51%。BRs施用可一定程度增加玉米幼苗叶片玉米素核苷含量。相比CK和N处理,B处理及NB处理玉米素核苷含量均升高。随处理时间增加,脱落酸含量呈先升后降趋势,36 h时最高。与其他处理相比,N处理脱落酸含量一直处于较高水平,与CK相比,36 h时提高36.02%。BRs施用下,玉米幼苗叶片脱落酸含量下降。与N处理相比,48 h时NB处理脱落酸含量下降23.50%。
3 讨论
盐胁迫下,植株体内产生大量活性氧(ROS),造成过氧化物积累和细胞膜损伤。丙二醛(MDA)作为膜脂过氧化产物呈显著升高趋势,丙二醛含量是衡量植株细胞损伤程度重要指标之一。MDA是膜脂过氧化物,在细胞中积累会损伤细胞膜,导致细胞膜透性增加,破坏细胞功能。O2-是一种游离态氧自由基,在细胞内作为一种氧化剂,对细胞膜等细胞器产生损伤。清除ROS过程中,抗氧化酶系统发挥重要作用,其中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)三种酶尤为重要。SOD是一种保护酶,可清除活性氧降低氧自由基对细胞膜系统损害,POD和CAT具有分解H2O2功能,对保护细胞膜完整性有积极作用。玉米幼苗抗氧化酶活性在盐胁迫下升高,盐胁迫下CAT活性呈下降趋势,SOD活性升高[18]。本研究结果显示,盐胁迫下玉米幼苗叶片内MDA和O2-含量及抗氧化酶活性均高于对照组。胡春红等研究表明,油菜素内酯(BRs)明显缓解防腐剂对玉米胁迫作用,降低MDA积累,减少玉米氧化损伤,质量浓度0.12 mg·L-1时效果最佳[19]。本试验中BRs施用显著降低盐胁迫下玉米幼苗叶片MDA和O2-含量,提高抗氧化酶活性,对抵御盐胁迫所致的ROS具有积极作用。
盐胁迫下,植株渗透反应包括脱水和吸水、细胞体积变化和胞内溶质主动积累及释放。植物主要通过以下两种方式渗透调节,一种是通过无机盐离子(K+、Ca2+、Cl-、Mg2+等)吸收和积累,另一种是通过合成和积累有机小分子物质(可溶性糖、脯氨酸、游离有机酸等)以保持细胞渗透势稳定,维持细胞正常结构和功能[20]。脯氨酸具有较强亲水性,是玉米中重要渗透调节物质。盐胁迫下,其在维持玉米幼苗水分平衡、稳定原生质胶体和组织内代谢过程发挥重要功能,保证植株正常生长[21]。可溶性蛋白参与渗透调节,反映植物器官功能变化[22]。本研究盐胁迫导致玉米幼苗脯氨酸和可溶性蛋白含量升高,但小分子物质增加是因盐胁迫损伤,还是盐胁迫促进合成该物质基因过表达,需进一步探讨。靳开川等研究表明,BRs显著增加高温胁迫下黄瓜和烟草幼苗脯氨酸含量;0.08 mg·L-1BRs处理高温胁迫的草莓幼苗,一定时间内增加叶片脯氨酸和可溶性蛋白含量,有利于提高细胞渗透调节能力以抵抗高温[23];干旱胁迫下,经BRs处理辣椒叶片脯氨酸和可溶性糖含量均明显升高[24],以上结果表明BRs可促进植物体内渗透调节物质积累,增强植株对外界非生物胁迫抵抗能力。本试验BRs增加盐胁迫下玉米幼苗脯氨酸和可溶性蛋白含量,对维持细胞渗透压稳定和水分平衡起关键作用。
光合作用是绿色植物吸收光能,将CO2和H2O合成有机物并释放氧的重要生理过程。叶绿素是植物光合作用主要色素,其含量直接反映叶片生理活性变化与光合作用强弱。SPAD数值可表达叶片叶绿素含量。同样,光合速率、蒸腾速率、气孔导度与胞间二氧化碳浓度也是反映植株光合能力相关指标。盐胁迫下,玉米幼苗水分和养分吸收受影响,细胞叶绿素含量减少,气孔导度和蒸腾作用降低,CO2固定减少,光合作用受明显抑制[25]。盐胁迫会导致放氧复合物损伤,光系统Ⅱ量子产量下降,光化学效率及电子传输受到影响[26]。盐胁迫下,位于类囊体膜色素蛋白复合体结构发生变化,光系统Ⅱ活性下降,植株光合能力减弱。BRs作为固醇类植物激素,参与植物一系列生理生化和生命过程[27]。逆境胁迫下,BRs可提高叶片叶绿素含量,改善逆境胁迫下叶片光合作用,提高有机物质积累[28]。本研究中,外源BRs显著增加盐胁迫下玉米叶片SPAD数值,提高光合速率、蒸腾速率及气孔导度,明显改善光合作用,提高植物干物质积累能力。此外,叶片胞间二氧化碳浓度降低,可能是外源BRs可解除盐胁迫对光合作用非气孔限制,光合作用改善所致。
植物通过激素调控体内大部分代谢,激素间配合维持代谢平衡。生长素(IAA)促进植株生长,刺激愈伤组织生成、促进形成层细胞分裂[29]。赤霉素(GA)调控细胞伸长、种子萌发、植株衰老,也参与植物对外界胁迫响应[30]。玉米素核苷(ZR)是一种细胞分裂素,一般产生于植物根部,促进组织分化和生长,在植物生长中促进叶绿体发育、提高气孔开放程度、抑制光合色素降解[31]。脱落酸(ABA)作为一种重要植物激素,可调控植物生长发育进程,在植株抵御外界胁迫中起重要作用[32]。当植物处于非生物胁迫下,其内源激素含量会发生相应变化。张敏等研究表明,盐胁迫提高小麦幼苗叶片及根系内源ABA和ZR含量并降低GA及IAA含量[33]。本试验中,盐胁迫显著降低两个玉米品种IAA、GA和ZR含量,增加ABA含量,且随胁迫时间增加呈逐渐升高趋势。研究表明,BRs作为一种植物激素,也可通过改变植株内源激素水平参与调控植株生长。康宗利等研究认为,外源BRs明显增加黄瓜根系IAA和ZR含量,降低GA和ABA含量,且ZR含量随黄瓜幼苗生长呈逐渐下降趋势[34];张明才等研究外源BRs对大豆根瘤内源激素影响表明,外源BR提高根瘤菌IAA和GA含量,降低ABA含量[35]。对弱光生长番茄喷施外源BRs,番茄叶片IAA和GA含量均增加,而ABA含量下降,缓解弱光对番茄幼苗抑制作用,促进番茄生长[36]。本研究中,外源BRs明显提高玉米叶片IAA、GA和ZR,降低ABA含量,促进玉米幼苗叶片生长。但BRs影响植物内源激素含量机制仍不明确,是今后研究方向和重点。
[1] Carvalho F R,Piotto F A,Schmidt D,et al.Seed priming with hormones does not alleviate induced oxidative stress in maize seedlings subjected to salt stress[J].Scientia Agricola,2011,68(5):598-602.
[2] 谷洪彪,王子佳,徐贵新,等.防治次生盐碱化的灌区水资源利用研究——以松原灌区为例[J].工程勘察,2011,39(2):40-46.
[3] Gunes A,Inal A,Alpaslan M,et al.Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress and mineral nutrition in maize(Zea mays L.)grown under salinity[J].Journal of Plant Physiology,2007,164(6):728-736.
[4] Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology&Biochemistry,2010,48(12):909-930.
[5] Zhu J K.Regulation of ion homeostasis under salt stress[J].Current Opinion in Plant Biology,2003,6(5):441-445.
[6] Anjum S A,Wang L C,Farooq M,et al.Brassinolide application improves the drought tolerance in maize through modulation of enzymatic antioxidants and leaf gas exchange[J].Journal of Agronomy&Crop Science,2011,197(3):177-185.
[7] 任鸿雁,王莉,马青秀,等.油菜素内酯生物合成途径的研究进展[J].植物学报,2015,50(6):768-778.
[8] Xue-Xia W U,Zha D S,Zhu Z W.Effects of Exogenous 24-epibrassinolide on seed germination,physiological characteristics of eggplant seedlings under NaCl stress[J].Plant Physiology Journal,2011,47(6):607-612.
[9]王丽.水稻OsGSR1调控赤霉素和油菜素内酯信号互信的分子机理研究[D].北京:中国科学院,2009.
[10] Shahbaz M,Ashraf M,Athar H U R.Does exogenous application of 24-epibrassinolide ameliorate salt induced growth inhibition in wheat(Triticum aestivum L.)[J].Plant Growth Regulation,2008,55(1):51-64.
[11] Lu X M,Yang W.Alleviation effects of brassinolide on cucumber seedlings under NaCl stress[J].Chinese Journal of Applied Ecology,2013,24(5):1409.
[12] Sharma I,Ching E,Saini S,et al.Exogenous application of brassinosteroid offers tolerance to salinity by altering stress responses in rice variety Pusa Basmati-1[J].Plant Physiol Biochem,2013,69(8):17-26.
[13] Kuk Y I,Shin J S,Burgos N R,et al.Antioxidative enzymes offer protection from chilling damage in rice plants[J].Crop Science,2003,43(6):2109-2117.
[14] Xie Z,Duan L,Tian X,et al.Coronatine alleviates salinity stress in cotton by improving the antioxidative defense system and radical-scavenging activity[J].Journal of Plant Physiology,2008,165(4):375-384.
[15] 郝再彬.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2006.
[16] 布坎南B B,格鲁依森姆W,琼斯R L.植物生物化学与分子生物学[M].北京:科学出版社,2004.
[17] 赵爽,王琦,李艳红.植物生理与分子生物学[J].植物生理学报,2007(2):384-390.
[18] 贾佳.NO2-源的NO缓解玉米幼苗盐胁迫和低温胁迫的作用研究[D].杨凌:西北农林科技大学,2015.
[19] 胡春红,郭婕,陈龙,等.防腐剂胁迫下外源芸苔素内酯对玉米幼苗生长及抗性的影响[J].湖南农业大学学报:自然科学版,2014,40(2):113-116.
[20] 田晓艳,刘延吉,郭迎春.盐胁迫对NHC牧草Na+、K+、Pro、可溶性糖及可溶性蛋白的影响[J].草业科学,2008,25(10):34-38.
[21] 史玉炜,王燕凌,李文兵,等.水分胁迫对刚毛柽柳可溶性蛋白、可溶性糖和脯氨酸含量变化的影响[J].新疆农业大学学报,2007,30(2):5-8.
[22] Cernusak L A,Aranda J,Marshall J D,et al.Large variation in whole-plant water-use efficiency among tropical tree species[J].New Phytologist,2007,173(2):294-305.
[23] 靳开川,何金环.油菜素内酯在植物抗逆中的作用及信号传导机制综述[J].江苏农业科学,2017,45(14):4-7.
[24] 钟杨,陈洪国.芸苔素内酯水剂对辣椒幼苗水分胁迫生理的影响[J].北方园艺,2011(2):42-44.
[25] 郑世英,商学芳,王丽燕,等.盐胁迫对不同基因型玉米生理特性和产量的影响[J].干旱地区农业研究,2010,28(2):109-112.
[26] Stepien P,Johnson G N.Contrasting responses of photosynthesis to salt stress in the glycophyte Arabidopsis and the halophyte the llungiella:Role of the plastid terminal oxidase as an alternative electron sink[J].Plant Physiology,2009,149(2):1154-1165.
[27] Sasse J M.Physiological Actions of brassinosteroids:An update[J].Journal of Plant Growth Regulation,2003,22(4):276-288.
[28] Xia X J,Huang L F,Zhou Y H,et al.Brassinosteroids promote photosynthesis and growth by enhancing activation of rubisco and expression of photosynthetic genes in Cucumis sativus[J].Planta,2009,230(6):1185-1196.
[29] Im K J,Murphy A S,Dongwon B,et al.YUCCA6 over-expression demonstrates auxin function in delaying leaf senescence in Arabidopsis thaliana[J].Journal of Experimental Botany,2011,62(11):3981-3992.
[30] Rodrigues C,Oliveira J D,Soccol C R.New perspectives of gibberellic acid production:A review[J].Critical Reviews in Biotechnology,2012,32(3):263-273.
[31] Ha S,Vankova R,Yamaguchi-Shinozaki K,et al.Cytokinins:Metabolism and function in plant adaptation to environmental stresses[J].Trends in Plant Science,2012,17(3):172-179.
[32] Lee S C,Luan S.ABA signal transduction at the crossroad of biotic and abiotic stress responses[J].Plant Cell&Environment,2012,35(1):53-60.
[33] 张敏,蔡瑞国,李慧芝,等.盐胁迫环境下不同抗盐性小麦品种幼苗长势和内源激素的变化[J].生态学报,2008,28(1):310-320.
[34] 康宗利,杨玉红,郝建军,等.BR与S3307复合剂对黄瓜壮苗及内源激素含量的影响[J].北方园艺,2006(4):4-6.
[35] 张明才,何钟佩,田晓莉,等.植物生长调节剂BR和SHK-6对大豆生物产量和根瘤固氮活性的激素调控研究[J].大豆科学,2004,23(2):96-100.
[36] 李宁,苏晓琼,孙锦,等.外源24-表油菜素内酯对弱光胁迫下番茄叶片内源激素和碳水化合物代谢及果实的影响[J].南京农业大学学报,2014,37(3):51-56.

