低温胁迫对玉米发芽及幼苗生理特性的影响
杨德光,孙玉珺,Ali Raza Irfan,刘昕萌,吕金莹,尉菊萍,宫 磊,刘 哲,白 冰
(东北农业大学农学院,哈尔滨 150030)
玉米(Zea mays L.)为广泛种植的粮食、饲用和工业作物,生长状况与环境因素关系密切[1]。玉米为C4喜温作物,生长发育各阶段均对低温高度敏感[2-3]。低温影响种子萌发、幼苗生长、早叶发育,诱导生理、分子和生物化学变化,干扰细胞和作物生长,对作物发育和产量产生负面影响。幼苗期温度较低,玉米出现生长抑制、萎黄、萎蔫、坏死等症状,甚至死亡[4];低温胁迫下细胞膜结构和渗透压发生改变、蛋白质失活或变性、较高活性氧(ROS)导致氧化损伤[5]。细胞变化导致细胞膜完整性受损,抑制光合作用和新陈代谢。扰乱植物生长发育,降低生育力,引起作物过早衰老甚至死亡[6]。
本试验以玉米杂交品种天农9号和天合1号为试验材料,研究低温胁迫对玉米发芽期和幼苗期生理特性影响,为解决玉米低温冷害问题提供参考。
1 材料与方法
1.1 材料
供试品种为黑龙江地区主栽玉米杂交种天农9、天合1,购自黑龙江省农业科学院种子市场。
1.2 方法
2017年5月在东北农业大学农学院低温人工气候室开展盆栽试验。
芽期:挑选尺寸一致饱满种子,0.5%次氯酸钠溶液消毒种子3 min,清水冲洗3次,浸种24 h后放入垫有湿润滤纸培养皿中,加入等量蒸馏水,水层深度为1 mm。每个品种设两个处理,低温发芽温度为6℃,常温对照为25℃。每个处理选取20粒种子,3次重复,黑暗条件下萌发,统计发芽率。
苗期:挑选尺寸一致饱满种子,0.5%次氯酸钠溶液消毒种子3 min,清水冲洗3次,浸种24 h待播种。使用培养钵(90 mm✕100 mm)点播播种,土质为草碳土。每个品种设置两个处理,低温处理为4℃,常温对照为25℃,每个处理保苗200棵,3次重复。玉米幼苗在对照处理下培养至三叶一心时期,将处理组转移到低温下继续培养3 d,后恢复生长3 d;分别在三叶一心时期(S1)、低温胁迫第1天(S2)、低胁迫第3天(S3)、恢复生长第1天(S4)、恢复生长第3天(S5)取两处理代表性植株测定生理生化指标。
1.3 测定指标
种子发芽率测定:上述处理不同品种玉米种子发芽数(调查15 d),计算发芽率。
发芽率%=发芽规定日期内正常发芽种子数/供试种子数×100%
农艺指标测定:待选定时期处理结束后立即取样,取新鲜叶片测定相关指标。选择玉米幼苗完全展开同位叶测定每个指标。株高为根基部到生长点高度,根长为根基部到根尖生长点长度,均随机选取5株测量株高和根长,求平均值;植株地上部和地下部干鲜重用JA2603B型电子天平(购自上海精密科学仪器有限公司)测定,105℃下杀青15 min后于80℃烘至恒重测定干重。
生理指标测定:叶绿素计SPAD-520Plus于09:00~12:00测玉米幼苗叶片SPAD值;光合速率测定:选取距离生长点第2片完全展开叶,LI-6400便携式光合仪于09:00~12:00测定玉米幼苗叶片净光合速率(Pn),每处理3次重复;硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量[7];氮蓝四唑法测定SOD活性[8];愈创木酚法测定POD活性[9]。酸性茚三酮法测定脯氨酸含量(Pro)。考马斯亮蓝法测定可溶性蛋白含量[10]。
1.4 数据统计与分析
数据取3次重复平均值,SPSS 22.0作方差分析和差异显著性检验,用Microsoft Excel 2016软件数据统计分析作图。
2 结果与分析
2.1 低温胁迫对不同玉米种子发芽影响
由表1可知,6℃低温胁迫下两玉米品种发芽率均低于对照。对照下两品种3 d时开始发芽,6 d时达完全发芽状态;低温处理下天农9在13 d开始发芽,15 d发芽结束,天合1在14 d时开始发芽,15 d发芽结束。低温处理下天农9较天合1发芽提前1 d,且天农9和天合1发芽结束时发芽率与对照处理相比分别下降3.33%和96.67%。低温胁迫下天合1发芽率下降幅度大于天农9。结果说明,天合1芽期对低温胁迫较敏感,天农9耐低温发芽能力较强,低温发芽能力天农9>天合1。
2.2 低温胁迫对玉米幼苗农艺性状影响
由表2可知,低温胁迫对两品种玉米幼苗株高、根长、地上和地下部干鲜重均有影响。两品种玉米幼苗各农艺指标在两温度下均随处理S1~S4过程逐渐增加,低温胁迫处理两品种幼苗各指标增长幅度小于对照处理。
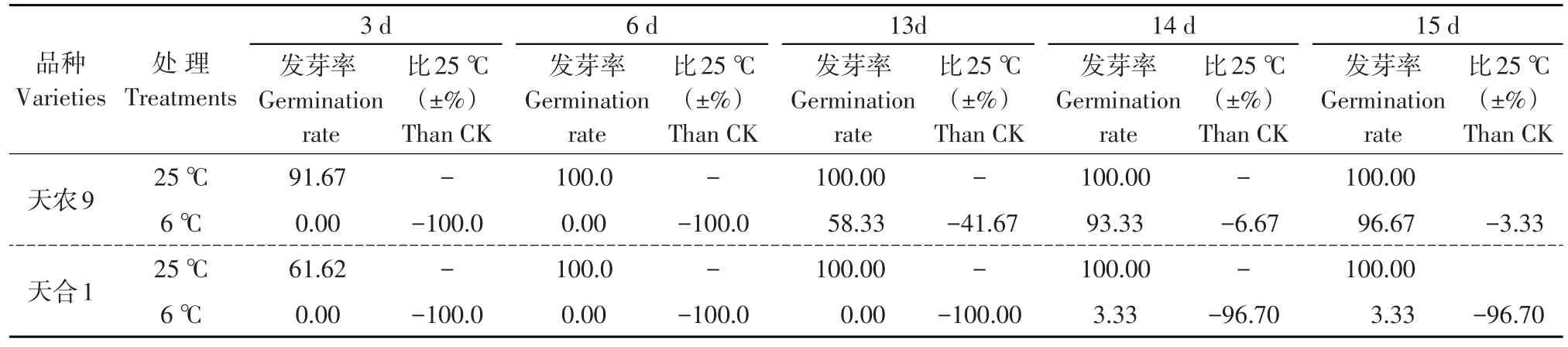
表1 低温胁迫对种子发芽影响Table 1 Effects of low temperature stress on germination of seeds (%)
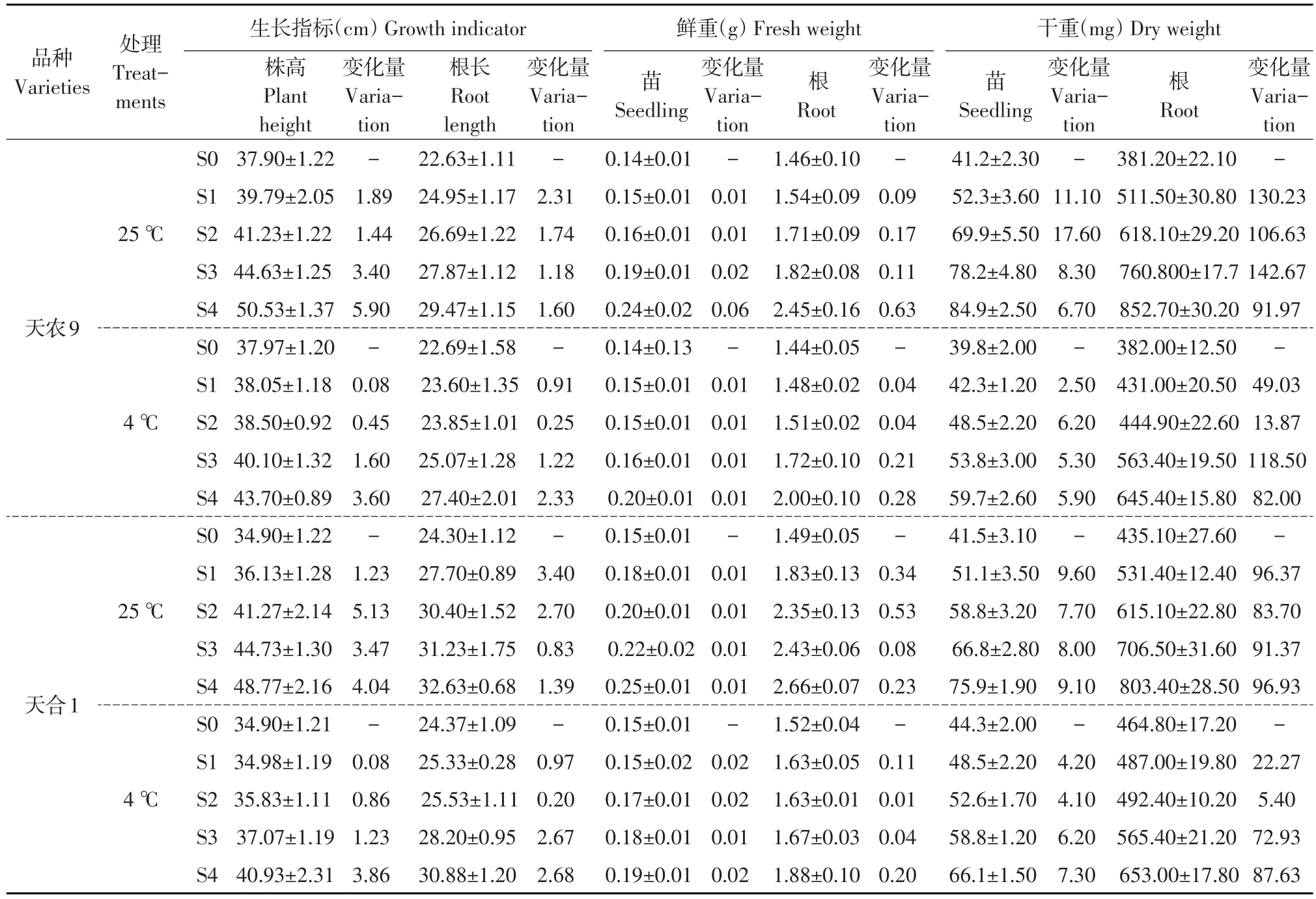
表2 低温胁迫对玉米苗期农艺性状影响Table 2 Effects of low temperature stress on agronomic characters of maize seedling
低温胁迫下两品种幼苗株高变化量均小于对照,其中天农9在处理S0~S4过程中变化量分别为0.08、0.23、1.90、3.60,分别比对照下降95.6%、68.9%、52.9%、39.0%;天合1在处理S0~S4过程中变化量分别为0.08、0.86、1.23、3.86,分别较对照下降96.8%、83.3%、64.4%、4.3%。由此可知,两品种幼苗株高均在S0~S1时期,即低温胁迫初期抑制程度最大,在S3~S4时期,即后期恢复生长能力最强。低温胁迫下天农9幼苗根长在处理S0~S4过程中变化量分别为0.91、0.25、1.22、2.33,分别比对照下降5.4%、10.6%、10.0%、7.0%;天合1幼苗根长在处理S0~S4过程中变化量分别为0.97、0.20、2.69、2.68,分别比对照下降8.5%、16.0%、9.7%、5.45%。以上结果说明,两品种幼苗根长均在S1-S2时期,即低温胁迫后期抑制程度最大,S3-S4时期,即恢复后期生长能力最强。两品种幼苗地上、地下部干鲜重变化趋势一致。低温胁迫下,天农9幼苗地上部鲜重在S0~S1和S3~S4时期分别比对照降低70.83%和31.94%,干重分别降低77.48%和11.94%。天合1幼苗地上部鲜重在S0~S1和S3~S4时期分别比对照降低93.00%和25.30%,干重分别降低56.25%和19.78%;天农9幼苗地下部鲜重在S1~S2和S3~S4时期分别比对照降低79.04%和55.10%,干重分别降低87.00%和10.84%。天合1幼苗地下部鲜重在S1~S2和S3~S4时期分别比对照降低99.43%和12.55%,干重分别降低93.55%和9.59%;以上结果说明,低温胁迫下两品种地上部生长在S0~S1时期,即低温胁迫初期抑制程度最大,地下部生长在S1~S2时期,即低温胁迫后期抑制程度最大;两品种地上、地下部均在S3~S4时期,即恢复后期生长能力最强,且两品种抗低温生长能力为天农9>天合1。
2.3 低温胁迫对玉米幼苗SPAD值影响
叶绿素是光合作用必需色素,SPAD值可直观反映植物叶片叶绿素相对含量。由图1可知,低温胁迫下两品种幼苗SPAD值随处理S1~S4过程呈先降后升趋势,S2时达最小值,且天农9>天合1;对照处理幼苗SPAD值则随处理S1~S4过程逐渐升高。低温胁迫下SPAD值变化量在不同处理阶段差异显著,变化速率 S0~S1<S1~S2,S2~S3>S3~S4。恢复生长后SPAD值仍低于对照。结果表明,低温胁迫下,玉米幼苗叶绿素含量主要在S1~S2阶段,即低温胁迫后期受抑制;S2~S3阶段,即恢复初期恢复能力较强。
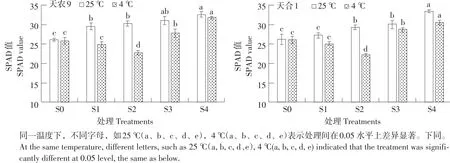
图1 低温胁迫对玉米幼苗SPAD值影响Fig.1 Effects of low temperature stress on SPAD value of maize seedlings
2.4 低温胁迫对玉米幼苗净光合速率影响
光合作用易受低温胁迫影响,最直观反应为植物净光合速率(Pn)变化。由图2可知,低温胁迫下,两品种幼苗Pn随处理S1~S4过程呈先降后升趋势,两品种均在S2时下降到最小值,且天农9>天合1;对照处理幼苗Pn则随处理S1~S4过程呈逐渐升高趋势。低温胁迫下Pn变化量在不同处理阶段差异显著,变化速率S0~S1<S1~S2,S2~S3>S3~S4。恢复生长后Pn仍低于对照处理。结果表明,在低温胁迫下,玉米幼苗Pn主要在S1~S2阶段,即低温胁迫后期受抑制;而S2~S3阶段,即初期恢复能力较强。天合1Pn受低温影响更显著。
2.5 低温胁迫对玉米幼苗MDA含量影响
MDA含量是非生物胁迫性细胞膜损伤标志。如图3所示,低温胁迫下,两品种幼苗MDA含量随处理S1~S4过程呈先升后降趋势,两品种均在S2时升至最大值,且天农9<天合1;对照处理幼苗MDA含量则随处理S1~S4过程无明显变化。低温胁迫下MDA含量变化量在不同处理阶段差异显著,变化速率S0~S1>S1~S2,S2~S3与 S3~S4基本一致。恢复生长后幼苗MDA含量仍高于对照处理。结果表明,低温胁迫下,玉米幼苗MDA含量主要在S0~S1阶段,即低温胁迫初期上升较快;S2~S3和S3~S4阶段,恢复能力基本一致。天合1 MDA含量受低温影响显著。
2.6 低温胁迫对玉米幼苗SOD活性影响
低温胁迫下,两品种幼苗SOD活性随处理S1~S4过程呈先升后降趋势(见图4),均在S2时升至最大值,且天农9>天合1;对照处理幼苗SOD活性则随处理S1~S4过程趋于稳定。低温胁迫下SOD活性变化量不同处理阶段差异显著,变化速率S0~S1>S1~S2,S2~S3>S3~S4。恢复生长后幼苗SOD活性仍高于对照处理。结果表明,低温胁迫下,玉米幼苗SOD活性主要在S0~S1阶段,即低温胁迫初期上升较快;而在S2~S3阶段,即恢复初期下降较快。天农9 SOD活性受低温影响更明显。
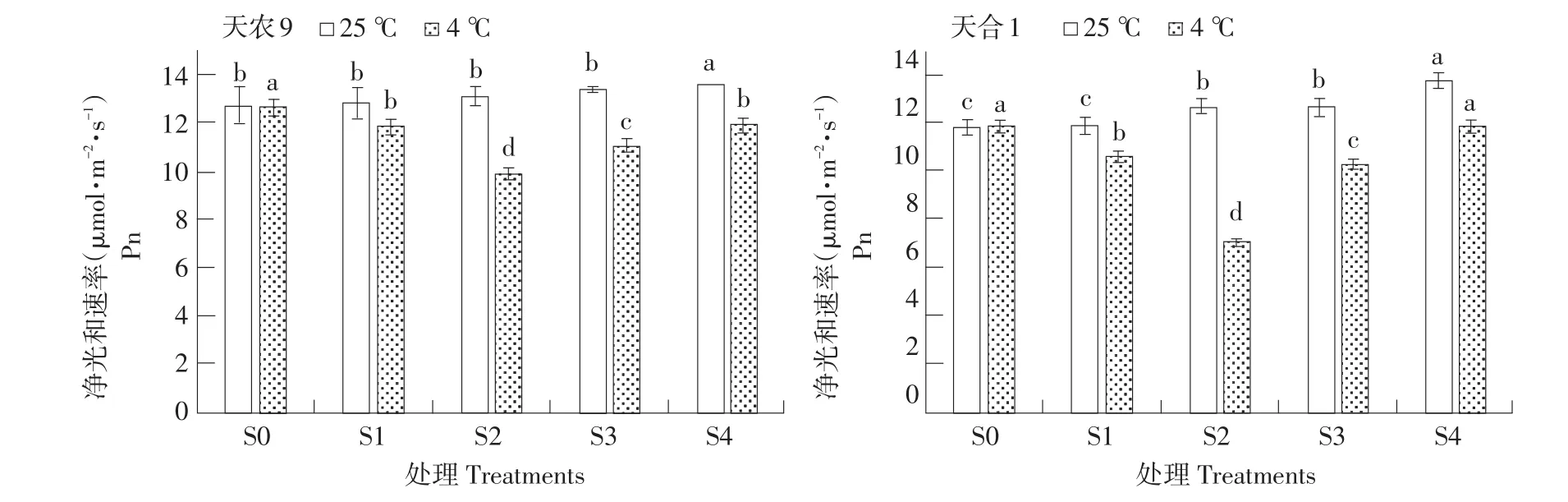
图2 低温胁迫对玉米幼苗Pn影响Fig.2 Effects of low temperature stress on Pn of maize seedlings
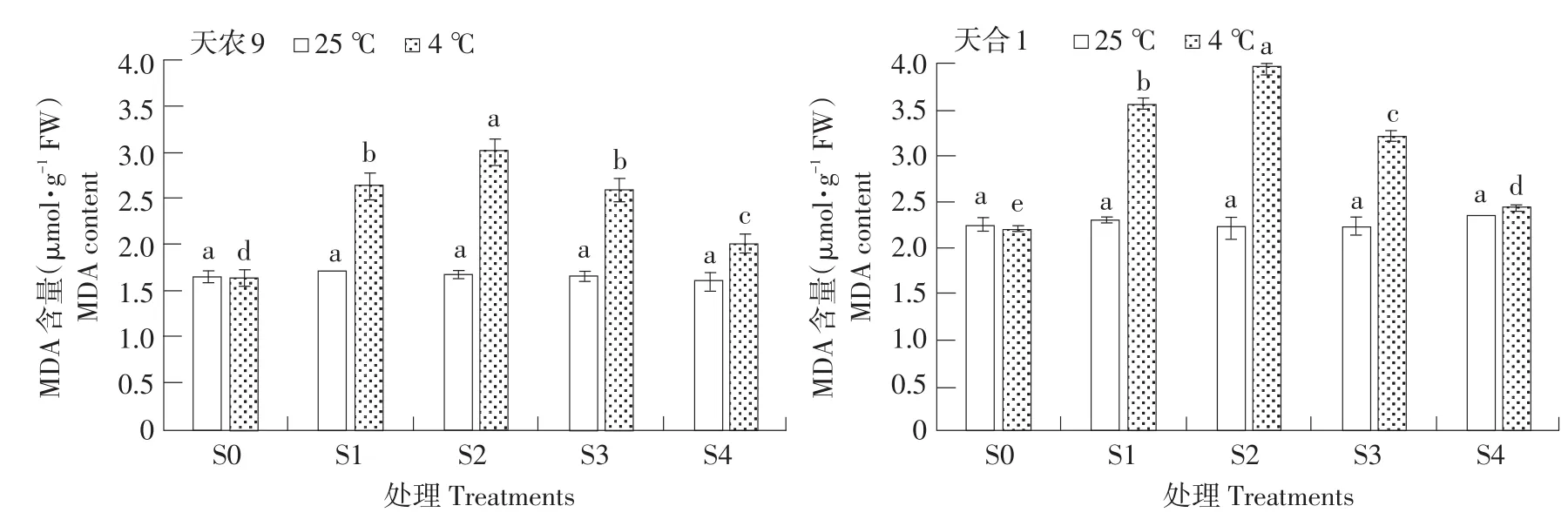
图3 低温胁迫对玉米幼苗MDA含量影响Fig.3 Effects of low temperature stress on MDA content of maize seedlings
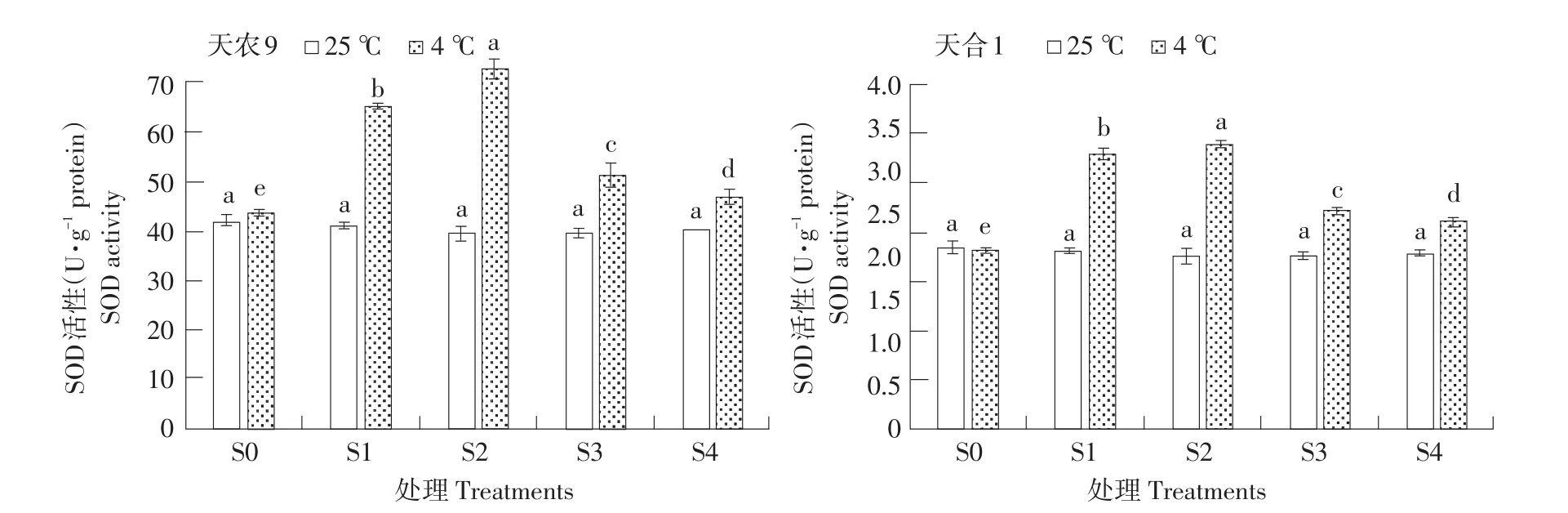
图4 低温胁迫对玉米幼苗SOD活性影响Fig.4 Effects of low temperature stress on SOD activity of maize seedlings
2.7 低温胁迫对玉米幼苗POD活性影响
低温胁迫下,两品种幼苗POD活性随处理S1~S4过程呈先升后降趋势(见图5),两品种均在S2时升至最大值,且天农9>天合1;对照处理幼苗POD活性则随处理S1~S4过程基本不变。低温胁迫下POD活性变化量不同处理阶段差异显著,变化速率S0~S1>S1~S2,S2~S3>S3~S4。恢复生长后天农9幼苗POD活性仍高于对照处理,天合1与对照处理基本持平。结果表明,在低温胁迫下,玉米幼苗POD活性主要在S0~S1阶段,即低温胁迫初期上升较快;而在S2~S3阶段,即恢复初期下降较快。天农9 POD活性受低温影响显著。
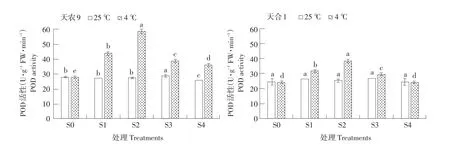
图5 低温胁迫对玉米幼苗POD活性影响Fig.5 Effects of low temperature stress on POD activity of maize seedlings
2.8 低温胁迫对玉米幼苗脯氨酸含量影响
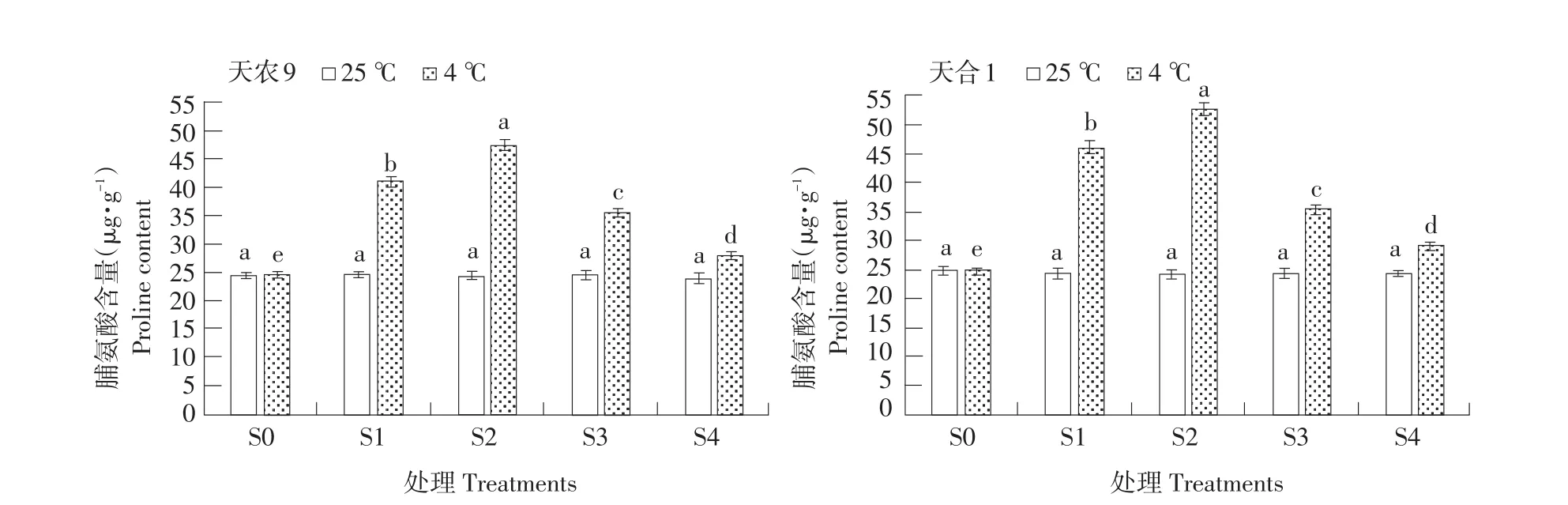
图6 低温胁迫对玉米幼苗脯氨酸含量影响Fig.6 Effects of low temperature stress on proline content of maize seedlings
脯氨酸为广泛存在于植物体中一种蛋白质组分,其含量一定程度上反映植物抗逆程度。低温胁迫下,两品种幼苗脯氨酸含量随处理S1~S4过程呈先升后降趋势(见图6),两品种均在S2时上升至最大值,且天农9>天合1;对照处理幼苗脯氨酸含量则随处理S1~S4过程基本不变。低温胁迫下脯氨酸含量变化量不同处理阶段差异显著,变化速率S0~S1>S1~S2,S2~S3>S3~S4。恢复生长后幼苗脯氨酸含量仍高于对照处理。结果表明,低温胁迫下,玉米幼苗脯氨酸含量主要在S0~S1阶段,即低温胁迫初期上升较快;而在S2~S3阶段,即恢复初期下降较快。天农9脯氨酸含量受低温影响显著。
2.9 低温胁迫对玉米幼苗可溶性蛋白含量影响
由图7可知,在低温胁迫下,两品种幼苗可溶性蛋白含量随处理S1~S4过程呈先升后降趋势,两品种均在S2时升至最大值,且天农9>天合1;对照处理幼苗可溶性蛋白含量则随处理S1~S4过程基本不变。低温胁迫下可溶性蛋白含量变化量不同处理阶段差异显著,变化速率S0~S1>S1~S2,S2~S3>S3~S4。恢复生长后幼苗可溶性蛋白含量仍高于对照处理。结果表明,低温胁迫下,玉米幼苗可溶性蛋白含量主要在S0~S1阶段,即低温胁迫初期上升较快;而在S2~S3阶段,即恢复初期下降较快。天农9可溶性蛋白含量受低温影响显著。
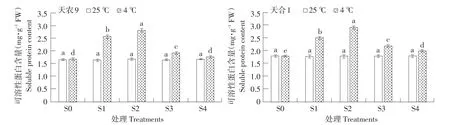
图7 低温胁迫对玉米幼苗可溶性蛋白含量影响Fig.7 Effects of low temperature stress on soluble protein content of maize seedlings
3 讨论与结论
玉米在28~35℃时发芽最快[11-12]。低温胁迫对玉米种子发芽率抑制作用显著[13-14]。本研究6℃低温胁迫下,两品种玉米种子发芽率显著下降,发芽延迟。玉米芽期生长阶段对低温胁迫较敏感,不同品种抗低温程度不同[15],品种基因型差异对种子低温发芽能力起决定作用[16]。本研究中,天农9低温发芽能力较强,天合1芽期对低温胁迫较敏感,耐低温发芽能力天农9>天合1。
低温胁迫对玉米苗期生长影响较大,影响植株叶片形态和根系生长发育。史占忠等研究表明,玉米幼苗经低温处理后,株高降低,干物质积累减少,叶片出现中脉突出、叶片萎缩现象,与本文低温胁迫降低两品种玉米幼苗株高和地上部干鲜重研究结果一致[17-18];玉米幼苗不同阶段对低温处理敏感性不同,幼苗低温胁迫初期敏感性大于后期,且不同品种间存在差异。根系为玉米吸收水分和养分重要器官,根系生长受温度影响。Kerstina等研究发现,玉米根系在低温处理后与常温对照相比,主根长、侧根数、根干鲜重显著下降[19]。曹宁等研究发现,玉米苗期低温处理明显降低根表面积、根体积和根总长,与本研究结果一致[20-21]。本研究还发现,两品种幼苗根系对不同低温胁迫阶段敏感性不同,低温胁迫后期对根系生长抑制程度更大,且不同品种间存在差异;恢复生长后,植株地上、地下部均在恢复后期生长能力最强。两品种幼苗地上部和地下部对不同低温处理时期敏感性不同,植物叶片光合系统受抑制,影响地上部生长发育。
玉米光合作用器官对低温敏感。低温会引起光合器官发生变化,叶绿素含量降低,光合速率下降[22]。即使温度恢复正常后,光合速率仍较低,叶片发育延迟[23]。本研究发现,与对照相比,低温胁迫降低叶绿素相对含量和净光合速率,且胁迫后期对两指标影响更显著;恢复生长后两指标值仍低于对照。说明低温对光合作用影响为持续性伤害,且随作用时间延长,抑制程度增强。
低温胁迫条件下,细胞活性氧(ROS)增加,引起脂质过氧化作用,植物膜系统氧化损伤,影响细胞膜稳定性,MDA含量则是植物细胞脂质过氧化指标[24-26]。马凤鸣等研究表明,玉米幼苗4℃低温胁迫下,MDA含量和保护酶活性随处理时间呈先升后降趋势,且不同品种间存在差异,与本试验结果一致[27-28],同时低温处理对幼苗MDA含量和保护酶活性影响随处理时间延长而减弱,即低温处理初期敏感性大于后期,品种间存在差异。POD、SOD和CAT等保护酶可消除ROS,在ROS产生和清除间保持平衡,减少或避免细胞损伤[29]。本研究中恢复生长后MDA含量和保护酶活性下降因生长条件恢复造成;前人研究多集中于胁迫后期,植物体内产生保护酶活性难以维持ROS平衡关系,ROS过盛损伤植物体。
植物受胁迫后合成强烈亲水的脯氨酸和可溶性蛋白,维持植物细胞膨胀状态,通过降低水势和保持某些生物大分子活性减轻植物细胞胁迫损伤[29-30]。因此脯氨酸和可溶性蛋白质含量与植物胁迫耐受性密切相关。王瑞等研究表明,低温胁迫下玉米幼苗脯氨酸含量呈单峰曲线趋势,且不同品种极值不同[31];高桂花等和郝小琴等对玉米幼苗低温胁迫处理,结果显示脯氨酸含量逐渐增加[32-33]。本研究中玉米幼苗低温胁迫下脯氨酸含量变化规律与前人研究结果相同;可溶性蛋白含量胁迫期间也持续增加,与胡海军等结论相同[34]。两指标在植株恢复生长后有所下降,由于随胁迫程度减弱而减小;同时两指标在不同低温处理阶段变化量不同,均为低温处理初期较敏感,且不同品种间存在差异。
综上所述,低温胁迫显著抑制不同品种玉米幼苗发芽和生长。降低玉米发芽率、幼苗株高、根长和地上及地下部生物量;降低玉米幼苗叶绿素相对含量和净光合速率;提高玉米幼苗MDA含量、POD和SOD活性、脯氨酸和可溶性蛋白含量。低温胁迫不同阶段不同品种各指标变化量差异显著。未来将进一步研究低温胁迫对玉米损伤是否可通过化学调控缓解,可否利用分子生物学方法确定调控植物体内ROS平衡基因。
[1] Gong F,Yang L,Tai F,et al."Omics"of maize stress response for sustainable food production:Opportunities and challenges[J].Omics-a Journal of Integrative Biology,2014,18(12):714-732.
[2] Rivaroveda L,Perilleux C.Effects of cold temperatures on the early stages of maize(Zea mays L.).A review[J].Biotechnologie Agronomie Société Et Environnement,2012,23(4).
[3] Holá D,Langrová K,Kocová M,et al.Photosynthetic parameters of maize(Zea mays L.)inbred lines and F 1 hybrids:Their different response to,and recovery from rapid or gradual onset of low-temperature stress[J].Photosynthetica,2003,41(3):429-442.
[4] Janowiak F,Maas B,Dörffling K.Importance of abscisic acid for chilling tolerance of maize seedlings[J].Journal of Plant Physiology,2002,159(6):635-643.
[5] Zelicourt A D,Colcombet J,Hirt H.The Role of MAPK modules and ABA during abiotic stress signaling[J].Trends in Plant Science,2016,21(8):677-685.
[6] Hussain S S,Ali M,Ahmad M,et al.Polyamines:Natural and engineered abiotic and biotic stress tolerance in plants[J].Biotechnology Advances,2011,29(3):300-311.
[7] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2001.
[8] Giannopolitis C N,Ries S K.Superoxide dismutases:I.Occurrence in higher plants[J].Plant Physiology,1977,59(2):309-314.
[9] Kochba J,Lavee S,Spiegelroy P.Differences in peroxidase activity and isoenzymes in embryogenic and non-embryogenic'Shamouti'orange ovular callus lines[J].Plant and Cell Physiology,1977,18(2):463-467.
[10] Monreal J A,Jiménez E T,Remesal E,et al.Proline content of sugar beet storage roots:Response to water deficit and nitrogen fertilization at field conditions[J].Environmental and Experimental Botany,2007,60(2):257-267.
[11] Klepper B.The effects of low temperature on seedling growth of maize genotypes[J].Field Crops Research,1987,19(4):317.
[12] 温万里,郑颖坤,艾莉,等.玉米抗冷性研究进展[J].作物杂志,2014(4):16-21.
[13] 张海艳.低温对鲜食玉米种子萌发及幼苗生长的影响[J].植物生理学报,2013,49(4):347-350.
[14] 彭云玲,王亚昕,赵小强,等.不同玉米自交系耐寒性评价及差异分析[J].干旱地区农业研究,2016,34(3):267-280.
[15] 晋鹏宇,赵鑫,赵丽晓,等.芽苗期低温对玉米生长的影响及抗逆栽培措施[J].华北农学报,2012,27(增1):139-143.
[16] Janowiak F,Markowski A.Effect of chilling on germination,growth,survival and membrane permeability in seedlings of different breeding forms of maize(Zea mays L.)[J].Acta Physiologiae Plantarum,1987,9(2):77-87.
[17] 史占忠,贲显明,张敬涛,等.三江平原春玉米低温冷害发生规律及防御措施[J].黑龙江农业科学,2003(2):7-10.
[18] 王洪刚,李丹,李杨.温度对玉米种子发芽及苗期生长的影响[J].黑龙江农业科学,2008(1):37-39.
[19] Kerstina N,Bernd K,Siegfried J,et al.Temperature responses of roots:impact on growth,root system architecture and implications for phenotyping[J].Functional Plant Biology,2009,36(10-11):947-959.
[20] 曹宁,符力,张玉斌,等.低温对玉米苗期根系生长及磷养分吸收的影响[J].玉米科学,2008,16(4):58-60.
[21] 曹宁,张玉斌,闫飞,等.低温胁迫对不同品种玉米苗期根系性状的影响[J].中国农学通报,2009,25(16):139-141.
[22] Aroca R,Irigoyen J J,Sánchez-DíAz M.Photosynthetic characteristics and protective mechanisms against oxidative stress during chilling and subsequent recovery in two maize varieties differing in chilling sensitivity[J].Plant Science,2001,161(4):719-726.
[23] Rymen B,Fiorani F,Kartal F,et al.Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes[J].Plant Physiology,2007,143(3):1429-1438.
[24] Wise R R.Chilling-enhanced photooxidation:The production,action and study of reactive oxygen species produced during chilling in the light[J].Photosynthesis Research,1995,45(2):79-97.
[25] Feng Z,Guo A,Feng Z.Amelioration of chilling stress by triadimefon in cucumber seedlings[J].Plant Growth Regulation,2003,39(3):277-283.
[26] Fu J,Huang B.Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress[J].Environmental and Experimental Botany,2001,45(2):105-114.
[27] 马凤鸣,王瑞,石振.低温胁迫对玉米幼苗某些生理指标的影响[J].作物杂志,2007(5):41-45.
[28] 王金胜,郭春绒,张述义.低温对不同抗冷性玉米幼苗H2O2及其清除酶类的影响[J].山西农业大学学报:自然科学版,1993,13(3):240-243.
[29] Hu J,Xie X J,Wang Z F,et al.Sand priming improves alfalfa germination under high-salt concentration stress[J].Seed Science and Technology,2006,34(1):199-204.
[30] Rathinasabapathi B.Metabolic engineering for stress tolerance:installing osmoprotectant synthesis pathways[J].Annals of Botany,2000,86(4):709-716.
[31] 王瑞,马凤鸣,李彩凤,等.低温胁迫对玉米幼苗脯氨酸、丙二醛含量及电导率的影响[J].东北农业大学学报,2008,39(5):20-23.
[32] 高桂花,王瑞兵,刘艳芳,等.低温胁迫下玉米幼苗生理变化的研究[J].河北农业科学,2006,10(4):16-19.
[33] 郝小琴,姚鹏鹤,高峥荣,等.低温胁迫对微胚乳超甜超高油玉米耐寒性生理生化特性的影响[J].作物学报,2014(8):1470-1484.
[34] 胡海军,王志斌,陈凤玉,等.玉米冷害生理机制研究进展[J].玉米科学,2009,17(2):149-152.

