二甲双胍药理作用及其机制研究进展
,
(南华大学药物药理研究所,湖南 衡阳 421001)
二甲双胍为双胍类口服降血糖药,已被证明可以降低空腹血糖,自1957年问世,已经在临床使用了五十多年,在我国也已有近20年的使用历史[1]。目前,二甲双胍是治疗Ⅱ型糖尿病的首选药,并且被联合共识声明及糖尿病指南推荐为Ⅱ型糖尿病的一线治疗药物。它可以预防由糖尿病引起的各种并发症,能降低血浆胰岛素水平和减少胰岛素抵抗、降低总胆固醇和低密度脂蛋白胆固醇含量,逆转前期糖尿病,它的价格低廉,不良反应较少,所以是临床治疗Ⅱ型糖尿病最常用的药物。另外,最近的基础和临床研究显示,二甲双胍除了降低血糖[2]作用外,还存在降糖外作用。现将其药理作用及其相关机制综述如下。
1 二甲双胍的降血糖作用特点及机制
二甲双胍首选用于单纯饮食控制及体育锻炼治疗无效的Ⅱ型糖尿病,特别是肥胖的Ⅱ型糖尿病,是当前全球应用最广泛的口服降糖药之一。二甲双胍改善高血糖的作用机制主要包括抑制肝脏葡萄糖的产生,促进肌肉中葡萄糖的吸收,延缓葡萄糖经由胃肠道的吸收,增加胰岛素敏感性,增加周围组织葡萄糖的无氧酵解,增加外周葡萄糖的利用,以及抑制肝、肾过度的糖原异生[3]。它可以降低糖尿病患者血糖水平,但不会降低非糖尿病患者的血糖水平。已有研究表明[1]二甲双胍可以抑制线粒体复合物1,进而抑制复杂的线粒体电子传递链,这些电子传递链是细胞用来产生能量的。而二甲双胍作为一个弱“线粒体毒素”来抑制氧化磷酸化,这意味着三磷酸腺苷(Adenosine triphosphate,ATP)的合成减少,二磷酸腺苷(ADP)/三磷酸腺苷(ATP)、单磷酸腺苷(AMP)/三磷酸腺苷(ATP)的比值升高,因此间接地激活了单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路,从而减少肝糖原的输出,降低血糖。AMPK是一种保守的丝氨酸/苏氨酸蛋白激酶,充当细胞能量和营养的传感器,在调节细胞代谢途径扮演着关键角色。此外,二甲双胍诱导线粒体活动的减少也刺激细胞吸收葡萄糖,这也导致了治疗效果,也就是说,它会降低血糖水平。
2 二甲双胍的降糖外作用
2.1二甲双胍的抗肿瘤作用
2.1.1 子宫内膜癌 AMPK的下游哺乳动物雷帕霉素靶蛋白(mammalian target of rapmycin,mTOR)是细胞生长和蛋白合成的关键激酶。有最新的研究表明[4],超过一半的恶性肿瘤存在mTOR信号通路的过度激活现象,而在子宫内膜癌中,mTOR信号通路异常激活的比率是最高的。mTOR蛋白的C末端能通过PI3K/AKT或Ras/ERK信号通路抑制mTOR信号通路使细胞的生长在G1期停止进而引起细胞的凋亡。mTOR蛋白的C末端具有激酶活性,能接收许多信号分子如营养成分、生长因子等等,它是调节细胞生长和增殖的关键分子。有研究表明,二甲双胍能剂量依赖地促进子宫内膜癌细胞中AMPK信号通路的激活、抑制mTOR信号通路进而抑制子宫内膜癌细胞的生长。另已证明,二甲双胍能逆转子宫内膜的增生[5]。pS6K1蛋白是子宫内膜增生的关键蛋白,二甲双胍可以通过减少pS6K1的表达从而减少子宫内膜的增生,进而减少子宫内模样癌发生的几率[6]。
2.1.2 结直肠癌 有数据表明,高游离水平的胰岛素样生长因子1(IGF1)能增加患结直肠癌的风险[7]。胰岛素和胰岛素样生长因子1是促进肿瘤发生和发展的重要因子,它们能刺激血管平滑肌细胞的增殖,激活血管内皮生长因子,促进血管的生成从而促进肿瘤细胞的生长,进而来增加结直肠癌的发病率。二甲双胍可以抑制mTOR信号通路进而抑制胰岛素及胰岛素受体导致的肿瘤细胞的增殖和生长。二甲双胍治疗结直肠癌的效果与它的使用剂量有关,有研究表明,高剂量的二甲双胍才能有效的降低结直肠癌的发病率[8]。
2.1.3 肺癌 JNK被称为应激活化蛋白激酶,与p38MAPK一样都是丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)中的一个亚族。JNK与p38MAPK通路能调节各种不同的细胞功能,并且在细胞的凋亡中发挥着重要作用。二甲双胍可以通过抑制MAPK信号传导通路使肺癌细胞的生长周期停止,从而抑制肺癌细胞的生长、增殖、促进肺癌细胞的凋亡[9]。二甲双胍也可以通过降低机体内胰岛素和胰岛素样生长因子结合蛋白(IGFBP)的水平,降低IGF1的水平来抑制肺癌细胞的生长与增殖。
2.1.4 卵巢癌 已经证明,p38MAPK信号通路激活转录因子Ap-1,增强up A蛋白的表达,从而促进卵巢癌细胞的生长[10]。二甲双胍可以降低胰岛素水平,减少IGF1的合成,抑制MAPK信号通路的激活从而抑制卵巢癌细胞的生长与增殖。RATTAN[11]等提出的二甲双胍可以通过活化AMPK/mTOR信号通路抑制卵巢癌微血管的生成和减少微血管的密度,并且抑制卵巢癌的生成和发展。虽然对于二甲双胍抗卵巢癌的机制存在诸多假设,包括抑制MAPK信号通路、激活AMPK通路、抑制线粒体电子传递链等。但是二甲双胍抗卵巢癌的具体作用机制还不是很清楚,希望能有更多更深层次的研究。
2.1.5 乳腺癌 线粒体作为细胞所拥有的一种独特的细胞器,是细胞制造能量的地方,也在细胞的凋亡和自噬中发挥着关键的作用。有研究表明[12],线粒体的代谢活动在肿瘤细胞的增殖过程中起关键的作用。线粒体功能的损伤抑制了乳腺癌细胞的发生和发展。然而二甲双胍在肿瘤细胞中是否作用于线粒体复合物1,取决于有没有可供细胞转换的葡萄糖的数量,而没有涉及到线粒体能量[13]。癌细胞的生长是需要营养物质的,而它的营养物质主要是通过旁分泌的方式提供的,从而促进肿瘤细胞的生长和增殖。但是如果线粒体的活动受到抑制或者线粒体的功能发生障碍与损伤的话,那么肿瘤细胞生长所需的营养物质也会被阻断或终止,其生长和增殖也会被抑制。二甲双胍也正是通过抑制线粒体的活动,使线粒体的功能发生障碍从而抑制乳腺癌细胞的生长,二甲双胍也可以通过改变线粒体的功能,进而抑制乳腺癌细胞的增殖。
2.2二甲双胍的抗炎作用
2.2.1 减少促炎因子的释放、促进抗炎因子的合成
炎症因子主要是指参与炎症反应的各种细胞因子。二甲双胍主要通过激活AMPK进而抑制NF-κB的活化来减少炎症因子IL-1β、IL-6、IL-8 的释放,另有研究表明,二甲双胍还能促进抗炎因子IL-10 的释放。这一结果就提示二甲双胍并非是通过控制体重、血脂、血糖等的综合作用来达到抗炎的目的,而是二甲双胍具有直接的抗炎作用。
2.2.2 激活AMPK途径 二甲双胍激活AMPK进而抑制NF-κB来抑制炎症。已经证实,在人类的血管平滑肌细胞中二甲双胍阻断PI3K/AKT途径来抑制NF-κB的激活[14]。二甲双胍也可剂量依赖地抑制因子IκB激酶IKK的活性,降低IκB的磷酸化和降解,降低促炎因子IL-1β和TNF-α的水平以及依赖两者的NF-κB的激活,抑制血管内皮细胞分泌黏附分子,抑制蛋白酶的释放以及氧自由基的合成,进而减少血管内皮的损伤和炎症的发生。
2.2.3 抑制mTOR信号通路 mTOR信号通路是细胞内非常重要的一条信号通路,它在细胞的存活、自噬、凋亡过程中发挥着重要的作用,是蛋白合成的关键调节器。mTOR能抑制NF-κB介导的前炎症细胞因子IL-12合成,促进抗炎因子IL-10的产生,说明mTOR有抗炎作用。而二甲双胍可以抑制mTOR信号通路。
2.2.4 抗氧化应激 氧化应激是指当机体内氧化与抗氧化的失衡,ROS等高活性分子产生过多,超出机体的清除能力,氧化系统和抗氧化系统失衡,引起机体的氧化损伤,是体内的一个负面作用,是炎症的一个重要因素[15]。二甲双胍通过激活AMPK激酶活性,升高谷胱甘肽还原酶、谷胱甘肽过氧化物酶的活性,恢复SOD的活性,降低ROS的水平,提高总巯基、氧化氮的水平,并且通过抑制NADPH氧化酶的活性和牛主动脉内皮细胞线粒体呼吸链来减少ROS的产生。二甲双胍可以增加H9c2细胞的活力,降低细胞内ROS的水平,和吡格列酮有协同作用。有研究[16]证明,二甲双胍动物实验模型内皮细胞中氧化应激标志性产物的表达均明显降低,有可能是因为AMPK信号通路的激活抑制了细胞内的氧化应激反应,减轻了氧自由基引起的血管内皮的损伤。
2.3二甲双胍抗衰老作用二甲双胍的抗衰老作用近来引起了大家的注意,EVI M等[17]的研究表明,小剂量的二甲双胍可以通过模仿能量限制来保护线粒体功能,抑制慢性炎症来增加老鼠的健康和寿命。世界首例抗衰老药二甲双胍于2016年进行临床试验。细胞是构成生物体基本单位,是生物体功能的基本单位,也是生物体衰老的基本单位。细胞衰老是以细胞生长、增殖能力不可逆的丧失为主要特征的一个过程,主要表现为细胞停止复制、细胞周期停滞在G0/G1期、衰老基因的表达上调等。AMPK是一种存在于大多数细胞中的保守的蛋白激酶,它参与细胞的各种代谢活动,维持细胞的能量供求平衡。现在,公认的唯一延缓衰老的方式就只有减少能量的摄入。它的抗衰老机制包括激活AMPK通路,激活SIRT1通路等。二甲双胍通过激活AMPK信号通路、抑制mTOR及其下游相关分子延缓衰老并延长寿命[18]。目前,二甲双胍抗衰老的机制是研究者们的研究热点,其作用机制可能是二甲双胍通过激活AMPK信号通路、降低氧化应激损伤程度、影响微生物代谢、减少细胞自噬和介导基因表达等方面发挥作用,从而延缓衰老,延长预期寿命。但其确切机制尚未十分明确,甚至其延寿作用仍然受到争议。
3 结语与展望
随着经济社会的发展,糖尿病已经成为一个日益严重的公共卫生问题,糖尿病在中国的严峻形势更是应该值得我们深思。而在糖尿病治疗方面,二甲双胍是一个经典有效的药物,并且随着研究的不断深入,二甲双胍的疗效以及其它的临床应用一步一步的得到更多的体现,它的作用机制也必将逐步得到阐明,目前其作用机制总结如图1。二甲双胍作为一种实惠、不良反应少、有效、广泛使用的药物,将不仅在治疗糖尿病领域发挥其特殊的作用,还将在降糖外作用领域及对其他内分泌疾病方面发挥其作用。
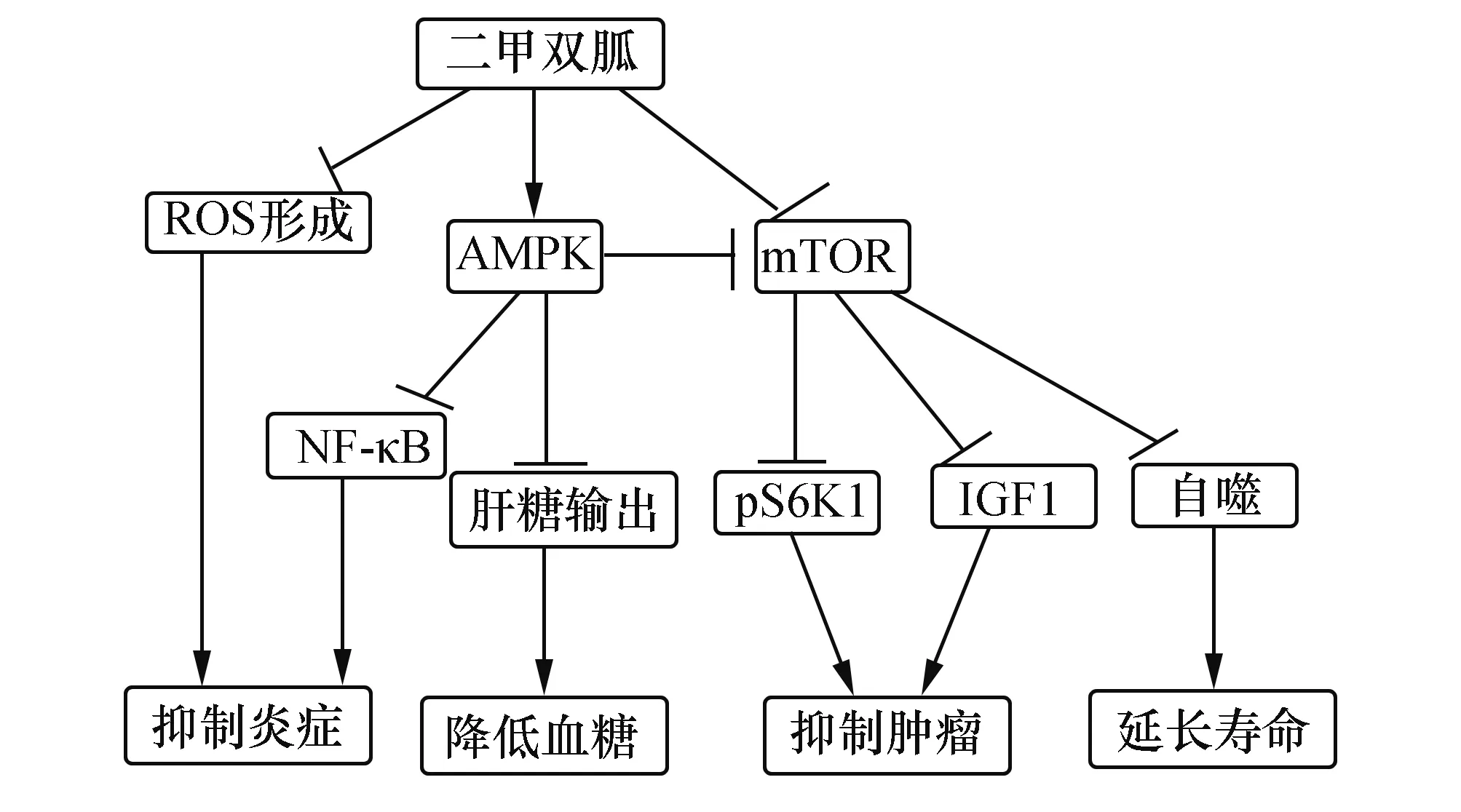
图1 二甲双胍药理作用所涉及的信号通路
参考文献:
[1] KINAAN M,DING H.Metformin: an old drug for the treatment of diabetes but a new drug for the protection of the endothelium[J].Med Princ Pract,2015,24(5):401-15.
[2] WRBEL MP,MAREK B,KAJDANIUK D,et al.Metformin-a new old drug[J].Endokrynol Pol ,2017,68(4):482-96.
[3] CHAE YK,ARYA A,MALECEK MK,et al.Repurposing metformin for cancer treatment: current clinical studies[J].Oncotarget,2016,7(26):40767-80.
[4] YERAMIAN A,MORENO-BUENO G,DOLCET X,et al.Endometrial carcinoma: molecular alterations involved in tumor development and progression[J].Oncogene,2013,32(4) : 403-13.
[5] CLEMENT NS,OLIVER TR,SHIWANI H,et al.Metformin for endometrial hyperplasia[J].Cochrane Database Syst Rev,2017,10:CD012214.
[6] TAS M,KUTUK MS,SERIN IS,et al.Comparison of antiproliferative effects of metformine and progesterone on estrogen-induced endometrial hyperplasia in rats[J].Gynecol Endocrinol,2013,29(4) : 311-4.
[7] ABDELSATIR AA,HUSAIN NE,HASSAN AT,et al.Potential benefit of metformin as treatment for colon cancer: the evidence so far[J].Asian Pac J Cancer Prev,2015,16(18) : 8053-8.
[8] MEI ZB,ZHANG ZJ,LIU CY,et al.Survival benefits of metformin for colorectal cancer patients with diabetes: a systematic review and meta-analysis[J].PLoS One,2014,9(3): e91818.
[9] WU N,GU C,GU H,et al.Metformin induces apoptosis of lung cancer cells through activating JNK / p38 MAPK pathway and GADDl53[J].Neoplasma,2011,58(6):482-90.
[10] 盛梅,张海燕,宋冬冬,等.卵巢癌细胞及组织中P38MAPK信号通路调控uPA蛋白的表达及临床意义[J].肿瘤防治研究,2015,42(8):789-93.
[11] RATTAN R ,GIRI S,HARTMANN LC. Metformin attenuates ovarian cancer cell growth in anAMP-kinase dispensable manner[J].J Cell Mol Med,2011,15(1):166-78.
[12] HE H,KE R,LIN H,et al.Metformin, an old drug, brings a new era to cancer therapy[J].Cancer J,2015,21(2):70-4.
[13] ORECCHIONI S,REGGIANI F,TALARICOG.Mechanisms of obesity in the development of breast cancer[J].Discovery medicine,2015,20(109):121-8.
[14] SAISHO Y.Metformin and inflammation: its potential beyond glucose-lowering effect[J].Endocr Metab Immune Disord Drug Targets,2015,15(3):196-205.
[15] 欧奇林,曾泗宇,秦旭平,等.CGRP通过抑制p38MAPK/NOX4通路保护氧化应激诱导的血管内皮细胞损伤[J].中南医学科学杂志,2015,43(4):374-8.
[16] 梁斌,袁松,刘艳敏,等.二甲双胍激活AMPK对高糖诱发内皮细胞氧化应激的影响[J].中国组织化学与细胞化学杂志,2015,24(4):302-6.
[17] MARTIN-MONTALVO A,MERCKEN EM,MITCHELL SJ,et al. Metformin improves healthspan and lifespan in mice[J]. Nature Communications ,2013,4:2192.
[18] PODHORECKA M,IBANEZ B.Metformin-its potential anti-cancer and anti-aging effects[J].PostepyHig Med Dosw (Online),2017,71:170-5.

