山羊脊柱融合生物力学体内模型的研究进展
,王军
(南华大学附属第一医院脊柱外科,湖南 衡阳 421001)
脊柱生物力学模型是研究脊柱相关疾病发生、发展的重要基础,因此其在脊柱相关研究中扮演重要角色[1]。通过对模型的观察和测试,可探索脊柱在疾病演变过程中以及受到人为干预时所发生的病理生理改变,并研究其机制。根据模型的应用方向以及研究目的的不同,Panjabi[2]将其大致分为物理学模型,体外模型,体内模型和计算机模型,共四大类。其中,仅有脊柱生物力学体内模型可有效模拟脊柱融合手术干预下脊柱植骨融合的生理病理过程[3],因此在研究脊柱融合过程中,通过实验动物构建一种能够更加准确模拟人类脊柱融合生理过程的生物力学体内模型成为进行相关试验的前提。
大量学者已通过体外实验证实山羊脊柱生物力学模型在生物力学属性上与人类有一定相似度[4-5],可以进行相关器械评价。基于以上理由,部分学者利用山羊构建脊柱生物力学体内模型并进行脊柱融合相关研究[6],本文将对不同手术方式构建的山羊脊柱融合生物力学体内模型的研究进展进行详细阐述。见表1。
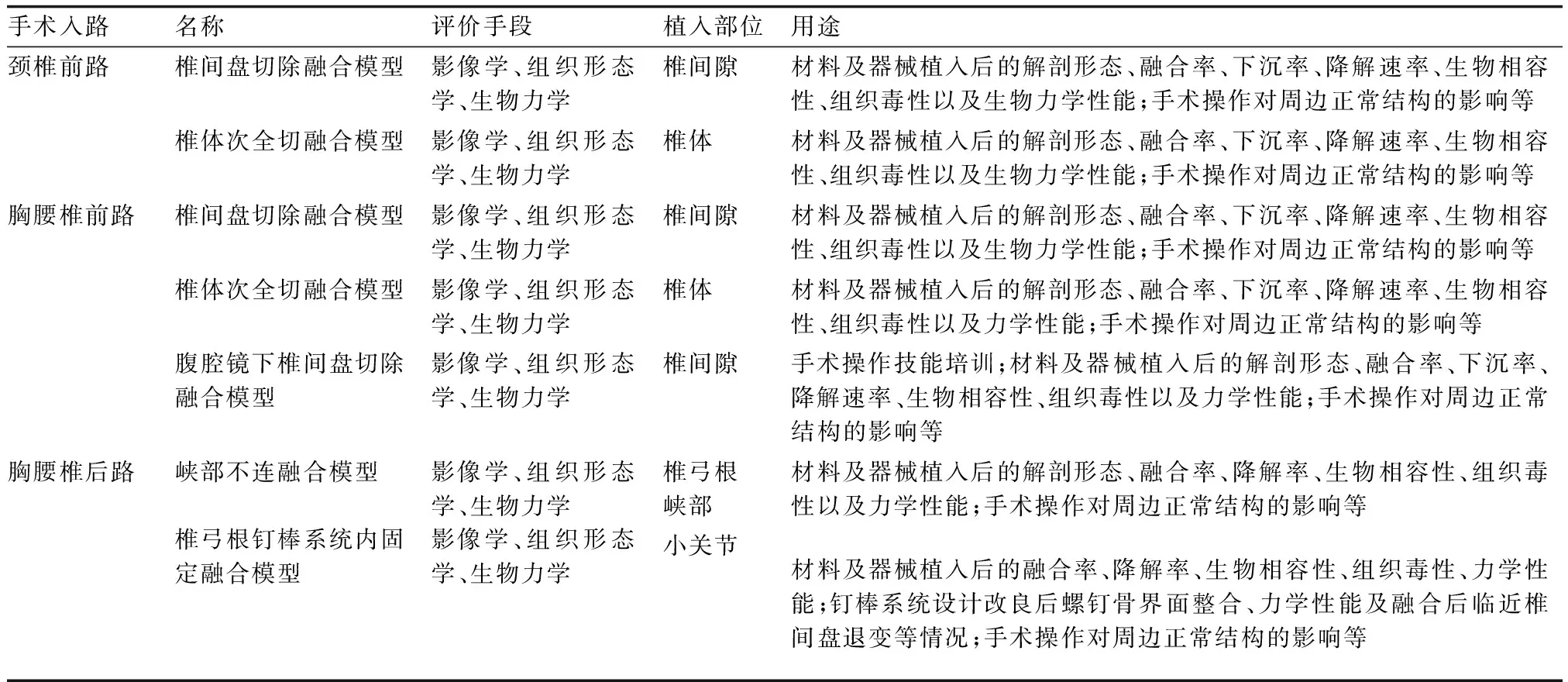
表1 山羊脊柱融合生物力学体内模型汇总
1 颈椎前路
山羊颈部粗壮,且平静时与地面呈垂直的直立状态,大多学者认为其颈部生物力学环境及局部解剖与人类大致相同[7],因此在早期便通过山羊构建颈椎脊柱融合生物力学模型。同时Kandziora等[8]学者通过详细对比了羊和人的颈椎生物力学、解剖形态、影像学和骨密度等,验证了前人的观点,认为羊和人颈椎具有良好的可比性和相似性,是一种用于颈椎疾病相关研究可行的动物模型。
1.1颈椎前路椎间盘切除融合模型最早于1992年Zdeblick TA等[9]首次构建21只山羊颈椎前路椎间盘切除椎间植骨/不植骨融合生物力学体内模型,实验过程中共63个颈椎手术节段,通过影像学及组织形态学发现其中不植骨的21个节段无明显融合现象出现,植入自体骨的21个节段有10个节段出现融合,而植入新鲜冰冻异体骨的21个节段中有8个节段出现融合,并通过简单的轴向压缩实验评估了各手术节段的轴向抗压缩性能,验证了自体骨植骨融合术后椎间隙融合率及轴向抗压缩性能最佳的结论。此后再次于1993年构建35只山羊颈椎前路椎间盘切除椎间植骨融合内固定/非内固定生物力学动物模型[10],通过之前类似的评价手段对手术节段进行评估,率先验证颈椎前路椎间盘切除椎间植骨融合辅以钢板内固定的手术方式较传统手术具有明显的轴向抗压缩生物力学性能。在以上两篇文章中,Zdeblick TA均描述到山羊椎体解剖形态上虽与人体不完全相同,但其与人类相似的颈椎直立状态能为作者提供相对合适的实验条件,并且该模型得到的融合率与人体实验结果相似。因此上述动物模型的成功构建,不光为沿用至今的颈椎前路椎间盘切除植骨融合内固定手术提供了详细的动物实验资料以及理论依据[11],同时也为后期大量学者研究颈椎前路植骨融合术相关的手术植入器械、生物工程植入材料、生长促进因子等实验研究提供了一种切实可行的颈椎椎间盘切除融合生物力学体内模型以及系列相关评价手段。
随着山羊颈椎前路脊柱融合生物力学体内模型的深入应用,大量学者开始更加详细地研究该动物模型并对其手术节段的选择、融合率以及生物力学评价手段进行了完善。Zdeblick TA等[12]也意识到在早期的实验设计中因技术限制,导致在评价山羊手术节段的融合率以及生物力学稳定性时,评价指标过于简单。因此,该研究团队后期逐步对模型的评价指标进行了完善,在融合率的评价中引入了免疫组化、免疫荧光等多种评价手段,并在生物力学稳定性评价中进行了前屈后伸、侧弯、旋转等接近正常生理活动的多轴运动评估。而2006年Pascal-Moussellard H等[13]学者,通过对山羊颈椎前路椎间盘切除植骨融合动物模型评价手段进行改进,首次采用了显微骨扫描显示植骨界面及周围骨组织骨小梁显微结构,进行骨组织骨量三维定性和定量分析,为山羊脊柱融合动物模型提供了一项更为有效,并且可定量的评估手段。Agazzi S等[14]学者则针对颈椎前路手术相关解剖学基础,基于颈椎前路手术的需求对山羊颈椎结构进行更为详细的解剖学研究,其研究结果表明山羊颈部较长,且颈前组织结构简单,寰椎位置容易触及,无论是定位还是暴露均相对容易。而山羊颈2/3椎体终板平坦,互相平行,并垂直于椎管长轴,远端椎体终板大多呈穹窿状,和终板角度明显大于90°,这一解剖形态与人体相似。因此认为山羊颈椎前路椎间盘切除植骨融合生物力学体内模型在解剖特点上比较适于进行相关研究,同时手术节段应确立在颈2~3节段为宜,该结论为大多学者进行山羊颈椎前路脊柱融合模型应用的节段选择提供了充分的理论依据。
1.2颈椎前路椎体次全切除融合模型基于前人在山羊颈椎前路脊柱融合生物力学体内模型的深入研究,目前该生物力学模型已十分成熟。近年来随着3D打印技术的迅速发展,3D打印人工椎体或椎间融合器目前已开展了动物实验。刘忠军教授团队作为进行世界上首例3D打印人工椎体临床应用的研究团队[15],在其自主设计的3D打印微孔结构人工椎体的动物实验中[16],考虑到颈椎序列、骨骼结构、生物力学特征以及对感染的抵抗力等问题,选择了山羊颈椎前路脊柱融合生物力学动物模型对3D打印微孔结构人工椎体通过Micro-CT、免疫组化以及扫描电镜评价其融合情况,同时利用生物力学试验机对融合节段进行压缩、拉伸、前屈、后伸、侧屈、旋转等生物力学测试,并且进行了2 500次的反复疲劳试验,以评估其生物力学稳定性。其实验结果表明3D打印微孔人工椎体安全、可靠,同时该人工椎体因其独特的微孔结构具有可观的植骨融合率以及稳定的生物力学强度。
2 胸腰椎前路
在山羊颈椎前路脊柱融合模型应用的同一时期,因山羊的胸腰椎椎体解剖形态、大小以及数目均与人类大致相同[17],便有学者尝试通过构建山羊胸腰椎前路脊柱融合动物模型,来评价胸腰椎融合材料或器械的植骨融合率等指标,并获得成功。
2.1胸腰椎前路椎间盘切除/椎体次全切除融合模型最早于1994年Brantigan JW等[18]便通过构建27只西班牙山羊腰椎前路椎间盘切除植骨融合模型,用以验证碳纤维椎间融合器的植骨融合效率。其实验结果表明碳纤维椎间融合器在脊柱椎间融合器植骨融合率上较传统同种异体骨具有更快、更可靠的优势,同时也验证了山羊腰椎前路椎间盘切除椎间植骨融合模型的可行性,但该实验中单纯通过对大体标本进行观察、X线和CT等影像学评价以及组织形态学等相关评价手段,并未针对山羊脊柱融合生物力学模型的优势进行全方位的生物力学分析,从抗压缩、抗旋转等生物力学指标分析椎间融合后的应力强度。随后Pintar FA等[19]重复了以上部分实验,用以评估羟基磷灰石与自体骨椎间植骨脊柱融合上的区别,在此研究中第一次将生物力学评价指标引入山羊腰椎前路脊柱融合模型融合效果的评价,对手术节段标本进行轴向压缩、前屈、后伸、侧弯及旋转强度等评价,其生物力学实验结果表明在任何运动加载状况下,实验组与对照组之间均不存在统计学差异。该模型的成功构建以及该实验中体现出良好的生物力学测试可靠性再一次说明了山羊脊柱融合生物力学模型具有一定优势。自此山羊腰椎前路脊柱融合动物模型开始大范围推广,并且得到了国际上大多数学者的认可。其中具有代表性的是荷兰阿姆斯特丹自由大学骨科研究中心于2002年~2007年与Skeletal Tissue Engineering Group Amsterdam (STEGA)合作,均通过构建山羊腰椎前路椎间融合器植骨脊柱融合模型来评价其研发的可吸收聚左旋乳酸椎间融合器或其他椎间融合系统的可靠性,并完成长达3年的动物实验体内研究,这为后期进行相关材料的研发与评价提供了可靠的实践基础[20-22]。并且目前比较热门的由纳米羟基磷灰石等可吸收材料制备的胸腰椎椎间融合器,均通过山羊胸腰椎前路椎间融合模型进行长期的动物实验,通过该模型验证可吸收材料在生理条件下降解的速率、吸收后的周边组织反应以及完全吸收后骨替代后的生物力学性能[23-24]。
在椎间盘内压力直接测量装置研究早期,传统观念认为四足动物因其四足着地脊柱呈水平位与人类具有明显差异,因此认为其椎间盘内压力远远小于人体椎间盘所承受的轴向压力。但是,也有学者持相反观点,认为羊因其胸腰背部肌肉呈持续收缩状态,且其背最长肌为全身肌肉力量最强的肌群,在此基础上肌肉的被动张力使得大量负荷作用于脊柱,而对椎间盘产生高强度的压力,因此认为羊的椎间盘内压力并不低于人类,甚至更高。Reitmaier等[25]通过在羊的腰椎间盘内安装压力感应装置,24 h监测羊的日常活动后发现,在安静状态下羊椎间盘内压接近于人类。而强制站立时,羊椎间盘内压远远高于人类椎间盘内压。由此认为,羊的生理状况下椎间盘内压力与人较为相似,且椎间盘生理结构及形态基本类似,所以羊是研究压力相关的椎间盘退变的理想模型。基于此理论近年大多学者开始利用山羊构建胸腰椎融合生物力学模型,以研究脊柱融合后邻近关节退变的机制及影响。2008年荷兰阿姆斯特丹自由大学骨科研究中心Hoogendoorn RJ等[26]构建了13只山羊腰椎前路椎间融合器植骨脊柱融合模型,并对其随访6个月,通过磁共振影像学、组织形态学等相关评价指标,用以研究山羊前路胸腰椎融合模型相邻节段椎间盘退变的发展以及相关机制。该模型的成功构建为未来构建山羊脊柱融合邻近椎间盘退变模型提供了理论基础,同时也有望通过该方式构建山羊压力诱导椎间盘退变模型。
2.2腔镜下胸腰椎前路椎间盘切除融合模型随着腔镜技术在脊柱外科的迅速发展以及广泛应用,大量胸腰椎前路手术采用腔镜辅助下完成,因此部分学者通过腔镜技术构建山羊胸腰椎前路脊柱融合模型,并且通过山羊与人类较为类似的解剖结构,进行手术方式以及手术操作本身对椎间融合率影响等相关研究。Sucato DJ等[27]于2002年将12只山羊随机分为部分血管结扎组及血管不结扎组,其实验第一步通过针对腹腔镜下部分血管结扎与血管不结扎组不同的手术操作,验证以上两种情况下椎间盘切除的效果,其实验结果表明两组无统计学意义。第二步则是通过腹腔镜辅助下构建胸椎前路椎间盘切除髂骨植骨融合模型,术后4个月对实验动物手术节段标本进行椎间融合效果的组织学、影像学及生物力学评价。其结论显示腹腔镜下山羊胸椎前路椎间盘切除髂骨植骨融合模型构建过程中,术中选择性血管结扎可能导致椎间隙植骨块供血缺失,从而导致植骨不融合或其他并发症的发生。该模型的成功构建不仅说明了可以通过腔镜技术构建山羊胸腰椎前路脊柱融合模型,同时也说明了山羊较人类相似的解剖结构,可以提供给脊柱外科医生更加真实的模拟效果以及更加广阔的实验空间,可广泛应用于未来腔镜下胸腰椎前路手术的操作培训和临床研究。
3 胸腰椎后路
山羊胸腰椎后路脊柱融合模型较通过其他方式构建的脊柱融合模型应用更少,这可能是胸腰椎后路进行椎间盘切除椎间植骨融合手术损伤大,风险高。并且山羊椎弓根形态成扁平状,可容纳的椎弓根螺钉直径较小[28],与人类相比具有一定差异。但仍有部分学者在山羊胸腰椎后路横突间融合模型以及其他类型的模型进行了一些尝试。
山羊胸腰椎后路脊柱融合生物力学模型应用过程中,部分学者针对了山羊胸腰椎后路与人类较为相似的解剖结构与椎间盘生物力学属性构建了相关模型用于相关研究。国内学者郝永宏等[29]通过行山羊后路正中切口,充分暴露腰4、5节段,将腰5双侧峡部用磨钻磨断,并在双侧峡部断裂处各放置一阻止其骨折愈合的金属片,并于术后喂养8周的方式,构建了16只山羊第5腰椎峡部不连模型,用以验证其自行研发的腰椎峡部重建内固定器具有明显的稳压和加压的双重力学功效。通过该方式构建山羊腰椎峡部不连模型,再通过后路手术对峡部不连进行修复融合处理,该动物模型研究方案较为新颖,且手术难度及术后护理等方面相对简单,是一种专门针对腰椎峡部裂修补融合术的动物模型,具有一定可行性和有效性。而顾军等人[30]则利用山羊腰椎椎间盘生物力学属性与人类基本一致的优势,采用不同长度的5.0 mm椎弓根螺钉进行后路固定,再通过小关节融合,构建12只波尔杂交山羊腰椎后路椎弓根钉棒系统内固定脊柱融合模型,用于观察脊柱内固定术中不同椎弓根螺钉植入深度对邻椎生物力学环境和退行性变的影响,探讨腰椎后路内固定系统力学强度与邻近椎体椎间盘退变之间的取舍。其实验结果显示在山羊腰椎内固定融合术中,长椎弓根螺钉提供的局部坚强固定可能增加上位未融合节段的活动和承受的应力,促进椎间盘退行性变,导致邻近椎间盘退变性疾病的发生。但山羊椎弓根呈扁平状的独特解剖结构带来的胸腰椎后路椎弓根钉棒系统内固定融合模型更大的手术置钉难度在该文中也有体现,顾军等人则通过减少螺钉直径来避免术中椎弓根螺钉突破椎弓根内侧皮质造成的神经损伤。以上阐述的两种较为新颖的山羊后路脊柱融合生物力学模型,均充分利用了山羊胸腰椎解剖结构以及生物力学属性与人类相似的优点,从不同角度进行脊柱融合相关生物力学分析,此构建模式也带来了更多的思路。
4 问题与展望
虽然目前采用山羊脊柱融合生物力学体内模型的相关文献报道尚不多,但从其呈逐年增加的趋势可以明确,山羊脊柱融合生物力学体内模型逐渐受到国内外学者的重视。同时因山羊其直立颈椎所带来的力学性能、比例相近的胸腰椎椎体结构以及与人类相似的胸腰椎椎间盘内压力等,不难看出山羊脊柱融合生物力学模型的优势。虽然目前在构建山羊脊柱融合生物力学体内模型中或多或少存在一些问题,但通过逐渐实现山羊脊柱融合生物力学体内模型手术构建中麻醉控制安全化、手术操作精细化、实验动物生产和饲养规模化以及对山羊种系研究的逐渐深入,山羊脊柱融合生物力学模型必将在3D打印、干细胞、组织工程、生物力学等多个新兴技术领域扮演重要角色。总之,近20余年来山羊脊柱融合模型的发展趋势,让作者看到了该动物模型未来的潜力,作为一种多功能新型脊柱融合生物力学体内模型广泛应用于实验研究一线。
参考文献:
[1] 文彬, 邓鑫. 生物力学模型在医学研究中的应用与展望[J].医学研究杂志,2014,43(1):142-4.
[2] PANJABI MM. Cervical spine models for biomechanical research[J]. Spine, 1998,23(24):2684-700.
[3] 昌耘冰. 颈椎生物力学模型的应用及进展[J].中国临床解剖学杂志,2003(2):187-9.
[4] PETERSON JM, CHLEBEK C, CLOUGH AM,et al.Stiffness matters: part I-the effects of plate stiffness on the biomechanics of ACDF in vitro[J]. Spine,2018.
[5] 黄师, 侯铁胜, 赵鑫, 等. 山羊颈椎能成为人类颈椎的良好模型吗?[J].中国临床解剖学杂志,2008(3):329-31.
[6] MACEWAN MR, TALCOTT MR, MORAN DW, et al. Novel spinal instrumentation to enhance osteogenesis and fusion: a preliminary study[J]. J Neurosurg Spine, 2016,25(3):318-27.
[7] 娄纪刚, 刘浩, 武文杰, 等. 新型人工颈椎间盘山羊模型的建立及其研究[J].实用骨科杂志,2017,23(5):426-9.
[8] KANDZIORA F, PFLUGMACHER R ,SCHOLZ M, et al. Comparison between sheep and human cervical spines: an anatomic, radiographic, bone mineral density, and biomechanical study[J]. Spine,2001,26(9):1028-37.
[9] ZDEBLICK TA, WILSON D, COOKE ME, et al. Anterior cervical discectomy and fusion. A comparison of techniques in an animal model[J]. Spine , 1992,17(10):S418-26.
[10] ZDEBLICK TA, COOKE ME, WILSON D, et al. Anterior cervical discectomy, fusion, and plating. A comparative animal study[J]. Spine, 1993,18(14):1974-83.
[11] LI XH, SONG YM, DUAN H. Reconstruction of segmental stability of goat cervical spine with poly (D, L-lactic acid) cage[J]. Orthop Surg, 2015,7(3):266-72.
[12] ZDEBLICK TA,COOKE ME, KUNZ DN, et al. Anterior cervical discectomy and fusion using a porous hydroxyapatite bone graft substitute[J]. Spine, 1994,19(20):2348-57.
[13] PASCAL-MOUSSELLARD H,BRUNET-IMBAULT B,AGUADO EPascal-Moussellard H, et al. Experimental evaluation of microscan assessment of bone fusion[J]. Rev Chir Orthop Reparatrice Appar Mot, 2006,92(6):535-42.
[14] AGAZZI S,VANLOVEREN HR, TRAHAN CJ, et al. Refinement of interbody implant testing in goats: a surgical and morphometric rationale for selection of a cervical level. Laboratory investigation[J]. J Neurosurg Spine, 2007,7(5):549-53.
[15] XU N, WEI F, LIU X, et al. Reconstruction of the upper cervical spine using a personalized 3D-printed vertebral body in an adolescent with ewing sarcoma[J]. Spine, 2016,41(1):E50-4.
[16] YANG J, CAI H, LV J, et al. In vivo study of a self-stabilizing artificial vertebral body fabricated by electron beam melting[J]. Spine (Phila Pa 1976), 2014,39(8):E486-92.
[17] WILKE HJ, KETTLER A, WENGER KH, et al. Anatomy of the sheep spine and its comparison to the human spine[J]. Anat Rec, 1997,247(4):542-55.
[18] BARANTIGAN JW, MCAGFEE PC, CUNNINGHAM BW, et al. Interbody lumbar fusion using a carbon fiber cage implant versus allograft bone. An investigational study in the Spanish goat[J]. Spine, 1994,19(13):1436-44.
[19] PINTAR FA, MAIMAN DJ, HOLLOWELL JP, et al. Fusion rate and biomechanical stiffness of hydroxylapatite versus autogenous bone grafts for anterior discectomy. An in vivo animal study[J]. Spine, 1994,19(22):2524-8.
[20] MULLENDER MG, KRIJNEN MR, HELDER MN, et al. Lumbar body fusion with a bioresorbable cage in a goat model is delayed by the use of a carboxymethylcellulose-stabilized collagenous rhOP-1 device[J]. J Orthop Res, 2007,25(1):132-41.
[21] KRIJNEN MR, MULLENDER MG, SMIT TH, et al. Radiographic, histologic, and chemical evaluation of bioresorbable 70/30 poly-L-lactide-CO-D, L-lactideinterbody fusion cages in a goat model[J]. Spine (Phila Pa 1976), 2006,31(14):1559-67.
[22] SMIT TH, THOMAS KA,HOOGENDOOM RJ, et al. Sterilization and strength of 70/30 polylactide cages: e-beam versus ethylene oxide[J]. Spine (Phila Pa 1976), 2007,32(7):742-7.
[23] 薛有地, 宋跃明, 刘立岷, 等. 聚氨基酸/纳米羟基磷灰石/硫酸钙融合器在山羊腰椎椎间融合中的作用研究[J].中国修复重建外科杂志,2015,29(8):972-7.
[24] 滕海军, 周跃, 范丽静, 等. 可吸收腰椎间融合器降解过程的动物实验研究[J].颈腰痛杂志,2010,31(1):16-9.
[25] REITMAIER S, SCHMIDT H, IHLER R, et al. Preliminary investigations on intradiscal pressures during daily activities: an in vivo study using the merino sheep[J]. PLoS One, 2013,8(7):e69610.
[26] HOOGENDOOM RJ, HELDER MN, WUISMAN PI, et al. Adjacent segment degeneration: observations in a goat spinal fusion study[J]. Spine, 2008,33(12):1337-43.
[27] SUCATO DJ, WELCH RD, PIERCE B, et al. Thoracoscopic discectomy and fusion in an animal model: safe and effective when segmental blood vessels are spared[J]. Spine, 2002,27(8):880-6.
[28] 田勇, 王阳, 夏长丽, 等. 鹿、羊和人腰椎形态计量学关联性分析[J].吉林大学学报(医学版),2010,36(1):163-8;217.
[29] 郝永宏, 邓树才, 赵合元, 等. 腰椎峡部重建内固定器的设计及应用实验[J].中国修复重建外科杂志,2009,23(4):408-11.
[30] 顾军, 王以进, 端木群力, 等. 山羊腰椎内固定术中椎弓根螺钉植入深度对邻椎的影响[J].中国骨伤,2010,23(11):845-8.

