Nanog高表达可能是急性髓系白血病预后较好的生物标志
周娇, 汤茜, 张静, 周凌宇, 翟玲玲, 易云云,易晶, 林江, 钱军, 邓兆群*
(1. 江苏大学附属人民医院中心实验室, 江苏 镇江 212002; 2. 镇江市精确诊断与治疗重点实验室, 江苏 镇江 212002; 3. 江苏大学附属人民医院血液内科, 江苏 镇江 212002)
Nanog基因位于12号染色体12P13.31[1],最初由Chambers等[2]和Mitsui等[3]在小鼠胚胎干细胞内发现。Nanog基因通常被认为是一种促进肿瘤转移的关键干细胞基因。Nanog在NIH3T3细胞中的致癌潜力主要表现在促进细胞生长、病灶形成和集落生长[4]。Nanog基因是乳腺癌[5]、肺癌[6]等许多实体肿瘤预后不良因素之一。此外,Nanog还可能促进低分化肿瘤及肿瘤耐药性的形成。
急性髓系白血病(acute myeloid leukemia, AML)由分化障碍和不受控制的异常造血细胞增殖或积累引起,主要通过骨髓和外周血的形态学检查明确诊断[7]。虽然AML的治疗方案很多,但5年总生存率低于50%,老年患者诊断后2年内仅20%存活[8-9]。近年来,分子学异常与疾病预后的关系越来越受到关注,而Nanog是否影响AML患者预后的报道尚不多见。
目前认为,SOX2基因与肿瘤的侵袭性表型和不良预后相关[10-11],但有研究显示,在非小细胞肺癌和肺鳞状细胞癌中,高表达SOX2基因的患者较低表达患者有相对好的预后。由此,其他基因在肿瘤中的表现是否可能与SOX2相似仍需要更深入的研究。
本研究检测了初诊AML患者中Nanog基因的表达水平,并通过分析临床资料以确定Nanog与AML患者预后的关系。
1 对象与方法
1.1 标本来源
146例初诊AML患者治疗前骨髓标本以及其中11例治疗后完全缓解患者随访骨髓标本,均取自于2003年6月至2015年7月期间在江苏大学附属人民医院血液内科获得诊断并接受治疗的病例。另以来自骨髓捐献者或胸外伤患者的31份健康骨髓样本作为对照标本。随访患者均接受了长期标准化治疗,并达到完全缓解。患者的诊断和分型依据FAB分型和2008年WHO标准。每位患者的治疗计划、相关检查报告及疾病情况均记录在各自的医嘱单和病历上,病历均完整留存于病案室。另外,所有骨髓标本捐献者均签署了知情同意书。本研究经江苏大学附属人民医院伦理审查委员会批准。
1.2 细胞遗传学检查
用直接法和24 h短期培养法常规制备骨髓细胞染色体并分析R显带核型,根据《人类细胞遗传学国际命名体制(ISCN)》,依据染色体和预后的关系,将患者分为3个组别:低危组、中危组及高危组。
1.3 单个核细胞分离、RNA制备、反转录合成cDNA
抽取骨髓并使用肝素抗凝,使用Ficoll分离出AML患者和健康供体的单个核细胞,此后用Trizol试剂(美国Invitrogen公司)从单个核细胞中分离总RNA,再利用随机引物将总RNA反转录形成cDNA。
1.4 实时定量PCR检测Nanog mRNA的表达
Nanog的引物序列是5′-CTCCTCTTCCTCTAT-ACTAACATG-3′(正向)和5′-AGAATCAGGGCTGTC-CTGAATAAG-3′(反向)。实时定量PCR反应均在实时定量PCR仪(7500 Thermo cycler,美国APPlied Biosystems公司)上进行,扩增条件:95 ℃ 5 min,95 ℃10 s,53 ℃ 30 s和72 ℃ 32 s,45个循环,以无菌超纯水作为阴性对照。在实施PCR后,进行解链曲线分析以证明PCR产物作为单峰的特异性。通过以下公式计算Nanog转录物的相对水平:NNanog=(ENanog)ΔCT Nanog (对照-实验)÷(EABL)ΔCT ABL(对照-实验)。参数效率(E)通过公式E=10(-1/斜率)计数(斜率参照CT对cDNA浓度图)。按照文献[12]报道的方法,通过高分辨率熔解分析检测Nanog突变,利用DNA直接测序确认阳性样品。
1.5 统计学分析
所有数据分析采用SPSS 20.0软件实施。利用卡方检验及方差检验来比较分类变量之间的差异,以Mann-WhitneyU检验比较两组连续变量之间的差异。使用受试者工作特征(ROC)曲线和ROC曲线下面积分析Nanog表达对AML的诊断价值。采取生存分析(Kaplan-Meier)和多因素分析评估不同水平的Nanog表达对AML患者生存的影响。所有结果均以双尾P值<0.05为差异具有统计学意义。
2 结果
2.1 初诊AML患者Nanog mRNA的表达
初诊AML患者Nanog mRNA表达水平(0.0002~136.307,中位数0.263)明显高于健康对照组(0.0012~3.593,中位数0.084,P<0.01);非低危组Nanog mRNA表达明显高于低危组(P<0.05)。见图1、表1。

图1 Nanog mRNA在AML患者中的相对表达量
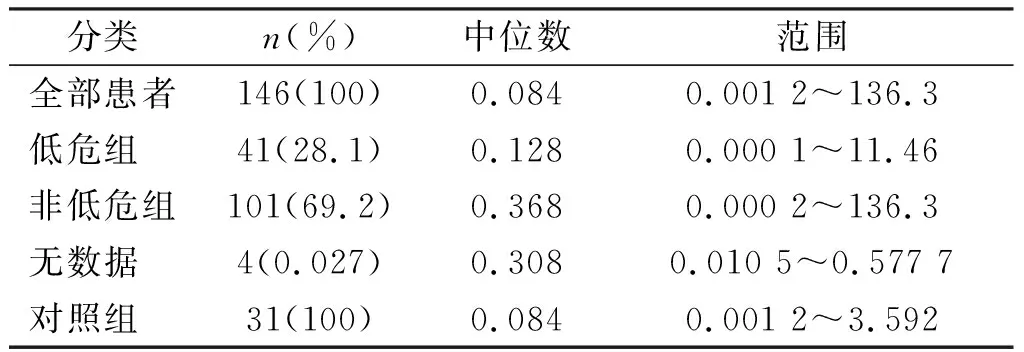
表1 不同风险水平组中Nanog mRNA的表达
2.2 Nanog表达的高低分组
AML患者Nanog mRNA表达的ROC曲线下面积为0.644(95%CI0.556~0.731,P=0.012;图2)。敏感性和特异性分别为46.9%和87.1%,因此,Nanog表达的截止值为0.324。按照此截断值,将AML患者分为高表达组(≥0.324)、低表达组(<0.324)。
2.3 Nanog表达与AML患者临床资料特征的相关分析
通过分析临床资料显示,Nanog高表达组与低表达组间在性别、年龄、白细胞计数、血红蛋白、血小板计数、骨髓原始细胞比例、FAB分型差异无统计学意义(P均>0.05)。 染色体分析结果显示,高表达Nanog主要出现在非低危组(78%,P=0.027)。8个基因突变(CEBPA,NPM1,FLT3-ITD,c-KIT,N/K-RAS,IDH1/2,DNMT3A,U2AF1)在Nanog高、低表达组间差异无统计学意义。见表2。
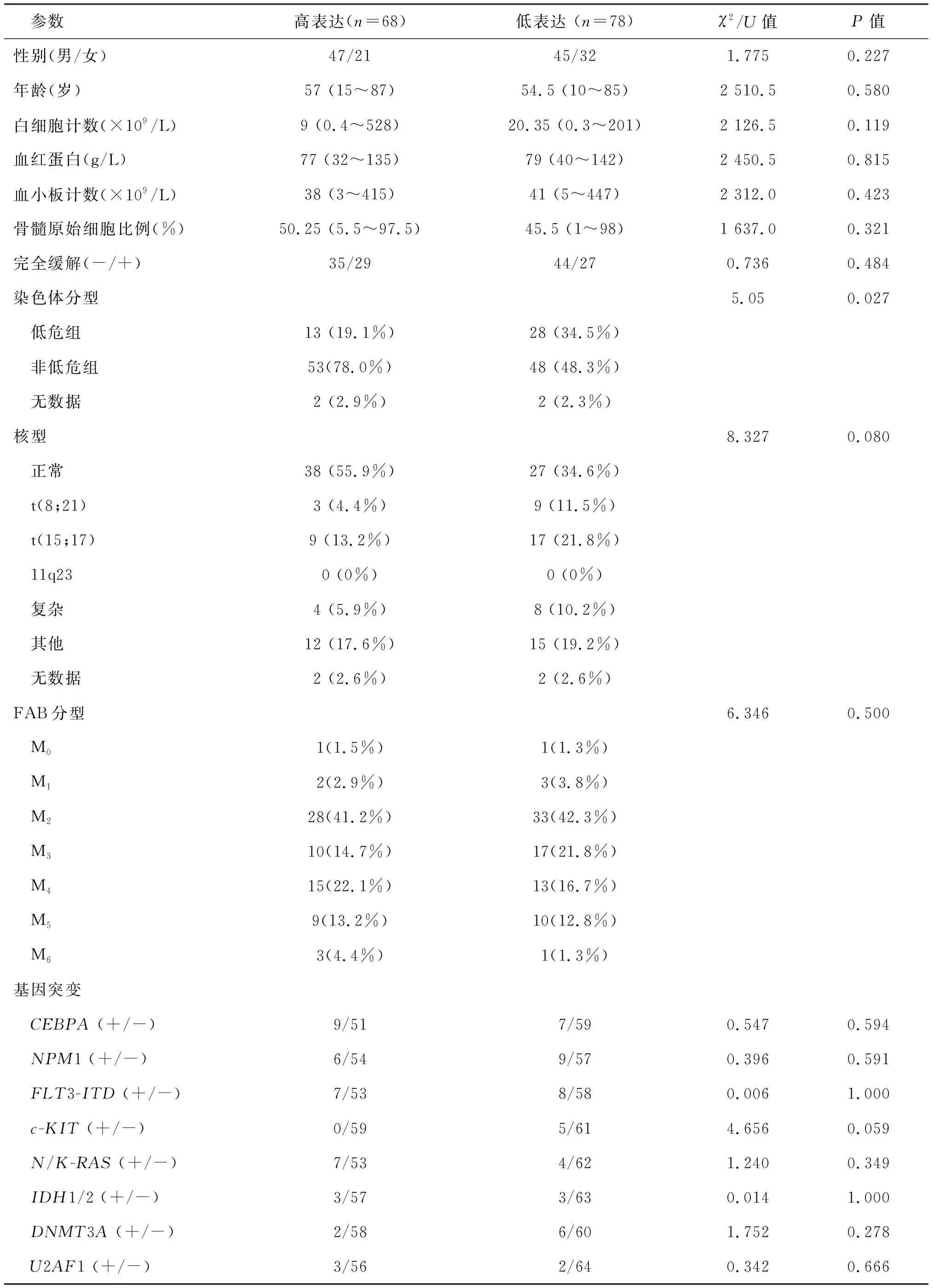
表2 急性髓系白血病患者Nanog表达与临床特征的关系
2.4 Nanog表达与临床预后的关系
146例初发AML患者均按照白血病治疗指南接受了标准治疗。全部患者的中位随访时间为7.00个月,Kaplan-Meier生存分析结果提示高表达组的生存时间(95%CI4.775~15.225,中位数10个月)比低表达组(95%CI4.45~9.55,中位数7个月)长,但差异无统计学意义(P=0.484)。见图3。
然而,在非M3患者中,低表达组的生存时间有短于高表达组的趋势,但差异无统计学意义(P=0.126)。在非低危组患者中,Nanog高表达组患者(95%CI5.876~16.124,中值为11个月)存活时间明显比低表达组患者(95%CI2.551~5.449,中值4个月)更长(P=0.031)。见图3。
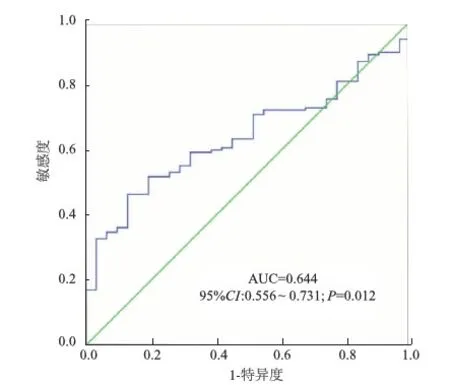
图2 利用ROC曲线确定Nanog表达的截止值
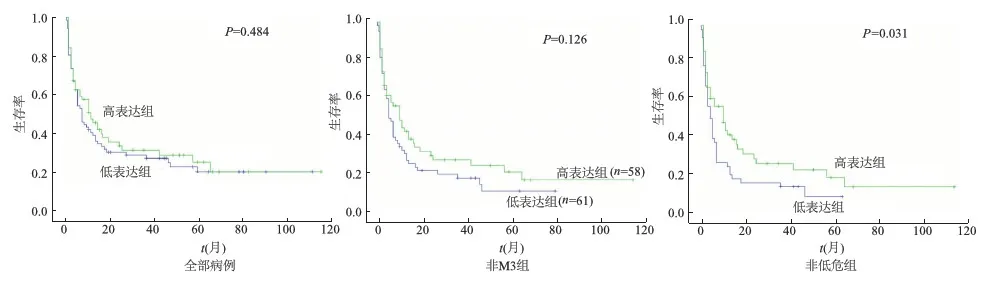
图3 Nanog表达对AML患者总生存期的影响
我们还检测了11例得到随访患者的样本,结果显示,AML患者完全缓解后的Nanog表达水平明显高于初诊时的表达水平(P=0.002)。见图4。
多因素分析结果显示,以白细胞计数(≥30×109/L与<30×109/L)、血红蛋白(<110 g/L与≥110 g/L)、年龄(<60岁与≥60岁),血小板计数(<100×109/L与≥100×109/L),染色体分型(低危与非低危),基因突变(突变与野生型)和Nanog表达状态(高与低)等作为协变量,显示Nanog表达是影响AML患者预后的独立因素。见表3。
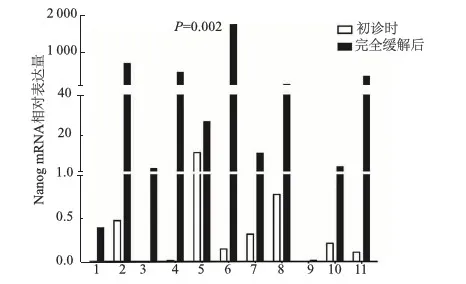
图4 11例随访患者Nanog mRAN表达水平

表3 多因素分析非低危组患者和AML患者的总生存预后因素
3 讨论
WHO分型将AML患者分为不同的风险群组(低危,中危,高危)[13]。不同的群组有着不同的预后,如利用现有的治疗方案,t(8; 21)和inv(16)染色体重排的AML患者通常可以接受蒽环类和阿糖胞苷诱导化疗以达到完全缓解[14]。
Nanog是一个独特的同源结构域蛋白,其基因与其他核心胚胎转录基因的分类(OCT4和SOX2)一致[15-16]。有研究发现SOX2基因在一些实体肿瘤,如肺癌、头颈部癌、食管癌、乳腺癌、胃癌和结肠癌等[17-22]中过表达,并且与肿瘤的侵袭性表型和不良预后相关[23-27]。然而Wilbertz等[28]发现过表达SOX2基因的肺鳞状细胞癌患者有着较好的预后,认为SOX2基因可能在正常鳞状细胞前体细胞中过度表达,从而消除混乱的恶性去分化。另外,由于基因失活,SOX2表达水平在早期肺鳞状细胞癌中增加,而在疾病进展期间可能减少[28],Velcheti等[29]对非小细胞肺癌患者的研究也显示了类似结果。在本研究也出现了类似的现象,即使Nanog是许多实体瘤中的致癌基因[5-6],而本研究非低危组中高表达Nanog的AML患者同样有着良好的预后,我们还分析了Nanog在随访患者标本中的表达,包括初诊及其相对应的完全缓解的标本预后。因此,我们推测,在肿瘤中过表达的基因可能并不全是致癌基因。
本研究146例AML患者中存在Nanog过度表达的趋势,且生存分析显示高表达组生存时间长于低表达组(P=0.484),然而,这个结果无统计学意义。通过分析原因,我们认为这样的结果可能是由于标本量较少所致。而另一方面,Nanog不仅在AML患者中表达较高,在非低危组患者中更是如此。生存分析显示,Nanog高表达组患者生存期有长于低表达组患者的趋势。这个结果与以往认为Nanog是癌症不良因素的研究[5-6]结论相反。此外,在非M3患者中,高表达组的患者总体生存趋势较低表达组长,但差异无统计学意义(P=0.126)。我们推测造成这种现象的原因可能是样本数量太少而不能代表整体情况。我们还发现,在非低危组患者中,低表达组的患者预后较差。根据我们的结果,可以认为,Nanog高表达是非低危组AML患者预后良好的生物学标志。此外,多因素分析也显示Nanog表达是影响AML患者预后的独立影响因素。
为了求证Nanog是否为AML患者预后良好的生物学标志,我们还比较了患者初诊和完全缓解后的骨髓标本中Nanog的表达情况,结果发现每个初诊样本的Nanog表达量低于所对应的完全缓解后的样本。
这样的情况不仅仅在我们的研究中存在,在其他研究中也一样[30]。例如,尽管Twist1被认为是乳腺癌、胃癌、前列腺癌和鼻咽癌的侵袭性转移性因子[31-34],但Twist1高表达的AML患者总体生存时间反而较长[30]。为了解释这个现象,Chen等[30]使用两种标准的诱导化疗剂阿糖胞苷或柔红霉素来处理AML细胞系,以研究细胞系对这两种药物的敏感性。结果显示,与转染空载体的细胞相比,过表达Twist1的KG1a细胞对阿糖胞苷的治疗更敏感;另外他们还发现,Twist1可以通过抑制P14ARF和P16INK4A的表达,促进细胞进入细胞周期,使白血病细胞更容易受到特异性化疗药阿糖胞苷的细胞毒作用。因此,高表达Twist1的AML患者对治疗的反应率更高,且存活率更高[30]。因此,我们推测,类似的生物学机制可能也存在于Nanog对AML患者的影响之中,但尚需更深入的研究证实。
正如前面提到的许多研究显示,Nanog是肿瘤患者的不良预后因子,而影响肿瘤患者预后的不单单只有基因型,患者的生活环境、性别、年龄、基础疾病以及身体状况以及其他一些生物学机制也可能会影响预后。一些研究认为,Nanog的基础水平对于癌细胞增殖可能是必需的,并且可部分增加Nanog介导的克隆形成和成瘤性质;但过度表达的Nanog可能并不是在所有条件下均促进肿瘤细胞增殖[35]。我们认为,不同的结果可能取决于不同的细胞类型,以及与肿瘤微环境中的其他因素的不同组合,但均需进一步的研究证实。
综上,我们推测Nanog是一个判断AML预后的生物学新标志物,可预测非低危组患者的预后。
[ 1 ] Gawlik-Rzemieniewska N, Bednarek I. The role of NANOG transcriptional factor in the development of malignant phenotype of cancer cells[J]. Cancer Biol Ther,2016,17(1):1-10.
[ 2 ] Chambers I,Colby D,Robertson M,et al.Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells[J]. Cell,2003,113(5):643-655.
[ 3 ] Mitsui K,Tokuzawa Y,Itoh H, et.al.The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells[J]. Cell,2003,113(5):631-642.
[ 4 ] Piestun D, KochuPurakkal BS,Jacob-Hirsch J, et al. Nanog transforms NIH3T3 cells and targets cell-type restricted genes[J]. Biochem Biophys Res Commun,2006,343(1):279-285.
[ 5 ] Ezeh UI, Turek PJ, Reijo RA et.al. Human embryonic stem cell genes OCT4, NANOG, STELLAR, and GDF3 are expressed in both seminoma and breast carcinoma[J]. Cancer,2005,104(10):2255-2265.
[ 6 ] Karoubi G, Cortes-Dericks L, Gugger M, et.al. Atypical expression and distribution of embryonic stem cell marker, OCT4, in human lung adenocarcinoma[J]. J Surg Oncol,2010,102(6):689-698.
[ 7 ] Prada-Arismendy J, Arroyave JC, Rothlisberger S. Molecular biomarkers in acute myeloid leukemia[J]. Blood Rev,2017,31(1):63-76.
[ 8 ] Gregory TK, Wald D, Chen Y, et.al. Molecular prognostic markers for adult acute myeloid leukemia with normal cytogenetics[J]. J Hematol Oncol,2009, 2:23.
[ 9 ] Riva L, Luzi L, Pelicci PG. Genomics of acute myeloid leukemia: the next generation[J]. Front Oncol, 2012,2:40.
[10] Saigusa S, Mohri Y, Ohi M, et.al. Podoplanin and SOX2 expression in esophageal squamous cell carcinoma after neoadjuvant chemo-radiotheraPy[J]. Oncol Rep,2011,26(5):1069-1074.
[11] Ge N, Lin HX, Xiao XS, et.al.Prognostic significance of Oct4 and Sox2 expression in hypopharyngeal squamous cell carcinoma[J]. J Transl Med,2010,8:94.
[12] Slomka M,Sobalska-Kwapis M, Wachulec M, et al. High resolution melting(HRM) for high-throughput genotyping-limitations and caveats in practical case studies[J]. Int J Mol Sci,2017,18(11).pii:E2316
[13] Campo E, Swerdlow SH, Harris NL, et al. The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications[J]. Blood,2011,117(19):5019-5032.
[14] Paschka P, Dohner K. Core-binding factor acute myeloid leukemia: can we improve on HiDAC consolidation?[J]. Hematology Am Soc Hematol Educ Program,2013,2013:209-219.
[15] Chambers I,Tomlinson SR.The transcriptional foundation of pluripotency[J].Development,2009, 136(14):2311-2322.
[16] Young RA. Control of the embryonic stem cell state[J]. Cell,2011,144(6):940-954.
[17] Freier K, Knoepfle K, Flechtenmacher C, et al.Recurrent copy number gain of transcription factor SOX2 and corresponding high protein expression in oral squamous cell carcinoma[J].Genes Chromosomes Cancer, 2010,49(1):9-16.
[18] Long KB, Hornick JL. SOX2 is highly expressed in squamous cell carcinomas of the gastrointestinal tract[J]. Hum Pathol,2009,40(12):1768-1773.
[19] Maier S, Wilbertz T, Braun M, et al. SOX2 amplification is a common event in squamous cell carcinomas of different organ sites[J]. Hum Pathol,2011,42(8):1078-1088.
[20] Zhang X,Yu H,Yang Y,et al.SOX2 in gastric carcinoma, but not Hath1, is related to patients′ clinicopathological features and prognosis[J]. J Gastrointest Surg,2010,14(8):1220-1226.
[21] Lengerke C, Fehm T, Kurth R, et al. Expression of the embryonic stem cell marker SOX2 in early-stage breast carcinoma[J]. BMC Cancer,2011,11:42.
[22] Neumann J, Bahr F, Horst D, et al. SOX2 expression correlates with lymph-node metastases and distant spread in right-sided colon cancer[J]. BMC Cancer,2011,11:518.
[23] Wang X,Liang Y,Chen Q,et al.Prognostic significance of SOX2 expression in nasopharyngeal carcinoma[J]. Cancer Invest,2012,30(1):79-85.
[24] Saigusa S,Mohri Y,Ohi M,et al.Podoplanin and SOX2 expression in esophageal squamous cell carcinoma after neoadjuvant chemo-radiotherapy[J]. Oncol Rep,2011,26(5):1069-1074.
[25] Matsuoka J, Yashiro M, Sakurai K, et al. Role of the stemness factors sox2, oct3/4, and Nanog in gastric carcinoma[J]. J Surg Res,2012,174(1):130-135.
[26] Ge N, Lin HX, Xiao XS, et al.Prognostic significance of Oct4 and Sox2 expression in hypopharyngeal squamous cell carcinoma[J]. J Transl Med,2010,8:94.
[27] Huang P, Qiu J, Li B, et al. Role of Sox2 and Oct4 in predicting survival of hepatocellular carcinoma patients after hepatectomy[J]. Clin Biochem,2011,44(8/9):582-589.
[28] Wilbertz T, Wagner P, Petersen K, et al. SOX2 gene amplification and protein overexpression are associated with better outcome in squamous cell lung cancer[J]. Mod Pathol,2011,24(7):944-953.
[29] Velcheti V, Schalper K, Yao X, et al.High SOX2 levels predict better outcome in non-small cell lung carcinomas[J]. PLoS One,2013,8(4):e61427.
[30] Chen CC, You JY, Gau JP, et al.Favorable clinical outcome and unique characteristics in association with Twist1 overexpression indenovoacute myeloid leukemia[J].Blood Cancer J,2015,5:e339.
[31] Yang J, Mani SA, Donaher JL, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis[J]. Cell, 2004,117(7):927-939.
[32] Kwok WK, Ling MT, Lee TW, et al. Up-regulation of TWIST in prostate cancer and its implication as a therapeutic target[J]. Cancer Res,2005,65(12):5153-5162.
[33] Horikawa T,Yang J, Kondo S, et al. Twist and epithelial-mesenchymal transition are induced by the EBV oncoprotein latent membrane protein 1 and are associated with metastatic nasopharyngeal carcinoma[J]. Cancer Res,2007,67(5):1970-1978.
[34] Rosivatz E, Becker I, Specht K, et al. Differential expression of the epithelial-mesenchymal transition regulators snail, SIP1, and twist in gastric cancer[J]. Am J Pathol,2002,161(5):1881-1891.
[35] Jeter CR, Liu B, Liu X, et al.NANOG promotes cancer stem cell characteristics and prostate cancer resistance to androgen deprivation[J]. Oncogene,2011,30(36):3833-3845.

