HMGB2启动子报告基因载体的构建、活性验证及与其结合的转录因子的预测
王飞, 冯奇, 秦杰, 李婉, 卢春
(南京医科大学病原生物学系, 江苏 南京 211166)
高迁移率族蛋白(high mobility group,HMG)于1973年被发现,因其特殊的溶解性和在SDS-PAGE中的高迁移率而得名。HMG蛋白是含量仅次于组蛋白的染色质蛋白,分布在细胞核内,主要行使调节染色质结构的功能;此外,它还参与转录、染色质重组和DNA修复等细胞生物学过程[1-2]。HMG蛋白根据其同源性可进一步分为HMGA、HMGB、HMGN 3个家族[3],其中HMGB家族的HMGB1和HMGB2具有很高的同源性。研究显示,HMGB1蛋白参与调节免疫系统功能及炎症反应,促进多种肿瘤形成与血管生成[4-5]。近来研究发现HMGB2在乳腺癌、恶性胶质瘤和肝癌[6]等多种肿瘤中呈高表达,且在肿瘤的发生和发展过程中起重要作用[7-9]。启动子是具有调节功能的DNA序列,位于基因5′端上游,具有可以与反式作用因子结合的顺式作用元件结构。启动子就像“开关”,能够活化RNA聚合酶并使之与模板DNA准确结合,起始转录,其本身并不影响基因的表达,而是通过与转录因子结合而控制基因转录起始[10-14]。
本研究拟构建含有HMGB2启动子序列的荧光素酶报告基因重组质粒,并对其进行功能活性鉴定。同时,通过软件分析预测可能与HMGB2启动子序列结合的转录因子,为进一步研究调控HMGB2基因转录活性的转录因子提供依据。
1 材料与方法
1.1 质粒和细胞
pGL3-Basic、pCMV6-Entry-C-Flag、pCMV6-Entry-C-Flag-p53和海肾荧光素酶报告质粒pRL-TK为本实验室保存。本实验所使用的细胞包括人胚肾上皮细胞(293T细胞)和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),分别培养在含有10%和20%血清(美国Gibco公司)的DMEM(美国Gibco公司)中;培养基中含10 μg/mL链霉素和100 U/mL青霉素,所有细胞均培养在37 ℃、5%CO2条件下的恒温培养箱中。
1.2 试剂
本实验所用的PCR引物由南京擎科生物科技有限公司合成;PCR高保真酶(Fanta酶)购自南京诺唯赞科技有限公司;血液/细胞/组织基因组DNA提取试剂盒及感受态大肠埃希菌DH5α购自北京天根生化科技有限公司;质粒小提试剂盒及凝胶纯化试剂盒(美国Omega公司);限制性内切酶XhoⅠ和KpnⅠ(日本TaKaRa公司);T4DNA连接酶(美国Thermo Scientific公司);质粒转染试剂LipofectamineTM2000(美国Invitrogen公司);Dual-Glo Luciferase Assay System(美国Promega公司);p53抗体(美国Santa Cruz公司);辣根过氧化物酶标记的羊抗鼠IgG购自南京巴傲得生物科技有限公司。
1.3 方法
1.3.1 全基因组DNA的提取 提取HUVECs的全基因组DNA作为HMGB2启动子区域序列PCR扩增的模板。首先,选取汇合度为80%的HUVECs,经胰酶消化后,用含有20%血清的完全DMEM终止消化,室温800×g离心5 min,弃上清液;PBS重悬后再次离心弃上清液,根据血液/细胞/组织基因组DNA提取试剂盒说明书提取HUVECs基因组DNA。
1.3.2 PCR扩增HMGB2启动子序列 在NCBI Genbank数据库中查询HMGB2启动子序列,设计PCR扩增引物。上游引物:5′-CGGGGTACCACCAAAGAGCATAGTCTTAACATGTGCCAA-3′(下划线部分为保护性碱基,斜体部分为KpnⅠ限制性核酸内切酶识别序列),下游引物:5′-CCGCTCGAGCC-CCAAATGCCGCTCGC-3′(下划线部分为保护性碱基,斜体部分为XhoⅠ限制性核酸内切酶识别序列)。以提取的HUVECs全基因组DNA为模版,PCR扩增HMGB2启动子序列,通过1%琼脂糖凝胶电泳鉴定PCR产物条带在正确的位置后,进行切胶回收纯化。
1.3.3 pGL3-HMGB2-promoter质粒的构建及鉴定 将上述切胶回收产物和pGL3-Basic质粒分别用KpnⅠ和XhoⅠ双酶切后,进行琼脂糖凝胶电泳分离、切胶回收纯化和T4连接酶连接。将连接产物转化感受态大肠埃希菌DH5α,涂布于具有氨苄西林抗性的LB平板,37 ℃培养过夜。次日,随机挑选单克隆菌落于LB培养基中振荡培养、大量扩增并提取质粒。将提取的重组质粒进行双酶切鉴定,同时,测定核酸序列,并利用APE软件比对测序结果。
1.3.4 虫荧光素酶报告实验检测p53对HMGB2启动子活性的影响 将293T细胞接种在48孔板中,次日,使用LipofectamineTM2000将pGL3-HMGB2-promoter重组质粒、pGL3-Basic空载体分别与pCMV6-Entry-C-Flag-p53、pCMV6-Entry-C-Flag以及内参pRL-TK质粒共转入293T细胞,pCMV6-Entry-C-Flag-p53质粒与空载质粒pCMV6-Entry-C-Flag以及pGL3-HMGB2-promoter重组质粒与其空载质粒pGL3-Basic的质量比为4 ∶1。24 h后,根据Dual-Glo Luciferase Assay System试剂盒说明书检测相应组别的荧光素酶活性,每组相对荧光素酶活性的值等于每组中每个独立实验的虫荧光素酶与海肾荧光素酶检测值比值的平均值。
1.3.5 蛋白质免疫印迹法检测p53蛋白的表达 收集“1.3.4”中重组质粒pGL3-HMGB2-promoter分别共转染pCMV6-Entry-C-Flag-p53和pCMV6-Entry-C-Flag的293T细胞,提取总蛋白,取100 μg样品进行SDS-PAGE并转膜;经5%脱脂牛奶封闭1 h后,将PVDF膜孵育在p53和内参GAPDH的一抗中(稀释比为1 ∶500),4 ℃孵育过夜。次日,TBST洗膜3次,每次5 min。用相应的二抗37 ℃孵育1 h后(稀释比为1 ∶10 000);TBST洗膜3次,每次5 min,于化学发光仪下显影。
1.3.6 与HMGB2启动子结合的转录因子的预测 将HMGB2启动子序列输入在线软件PROMO(http:∥alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3)中,根据网站提示进行操作,输出可以与HMGB2启动子序列结合的转录因子的预测结果。
1.4 统计学方法
使用统计学软件SPSS 19.0对数据进行统计分析,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 pGL3-HMGB2-promoter重组质粒的构建及鉴定
通过查询NCBI数据库以及相关资料,获得HMGB2启动子的范围,为HMGB2 mRNA转录起始位点上游-1 379 bp到下游+292 bp的位置。根据该序列设计扩增引物,以HUVECs全基因组DNA为模版进行PCR扩增,1%琼脂糖凝胶电泳结果显示,扩增片段约1 684 bp,与目标DNA长度一致(图1)。
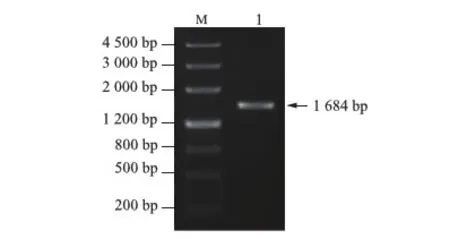
M:DNA标准参照物;1:HMGB2基因启动子扩增产物
对pGL3-HMGB2-promoter重组质粒进行KpnⅠ和XhoⅠ双酶切鉴定,结果可见2条特异性片段,分别约为4 817 bp(载体片段)和1 684 bp(HMGB2启动子片段,图2a)。重组质粒测序比对结果显示,插入的HMGB2启动子序列与理论序列一致(图2b),表明pGL3-HMGB2-promoter重组质粒构建成功。

M:DNA标准参照物;1:重组质粒pGL3-HMGB2-promoter双酶切产物;A: 重组质粒pGL3-HMGB2-promoter的双酶切鉴定;B: 重组质粒部分测序结果
2.2 pGL3-HMGB2-promoter重组质粒活性的验证
虫荧光素酶报告实验结果显示,pGL3-HMGB2-promoter报告质粒的活性明显高于pGL3-Basic对照组(t=4.587,P<0.01,图3),表明pGL3-HMGB2-promoter质粒具有转录活性。
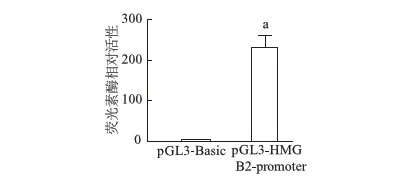
a:P<0.01,与pGL3-Basic比较
2.3 p53对HMGB2启动子活性的影响
免疫印迹结果证实,pGL3-HAGB2-promoter+pCMV6-Entry-C-Flag-p53共转染组成功过表达p53;虫荧光素酶报告实验结果显示,过表达p53的pGL3-HAGB2-promoter+pCMV6-Entry-C-Flag-p53共转染组重组质粒的虫荧光素酶活性明显低于pGL3-HMGB2-promoter+pCMV6-Entry-C-Flag共转染组(图4)。由此进一步说明本实验构建的pGL3-HMGB2-promoter报告质粒具有转录活性。
2.4 与HMGB2启动子结合的转录因子的预测
运用在线软件PROMO对HMGB2启动子区域(-1 379 bp~+292 bp)进行分析,预测出72个可能与HMGB2启动子序列结合的转录因子,其中TFIID[16]、LEF-1[17-18]、POU2F2(Oct-2)[19]、NFI/CTF[20]、FOXP3[21]、STAT4[22]等与肿瘤发生发展密切相关(表1)。这些转录因子的预测为我们进一步探索调控HMBG2表达的分子机制奠定了基础。
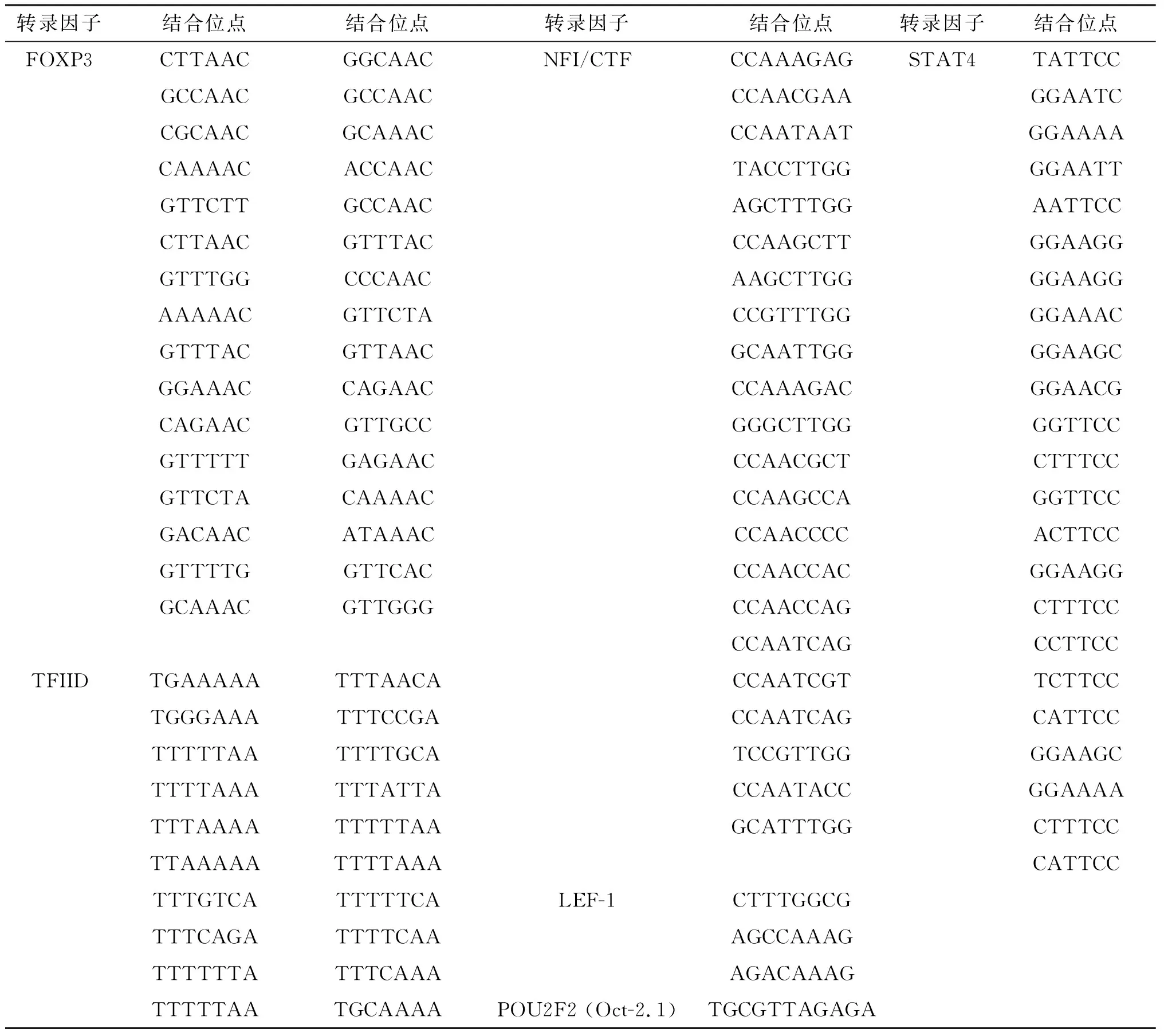
表1 HMGB2启动子转录因子结合位点的部分预测结果
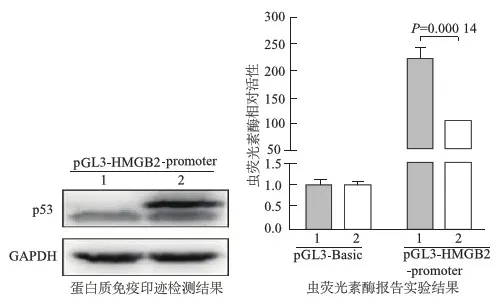
1:pCMV6-Entry-C-Flag; 2:pCMV6-Entry-C-Flag-p53
3 讨论
先前的研究发现,HMGB2可与雌激素受体结合,竞争性抑制内分泌治疗药物对乳腺癌的治疗作用,促进乳腺癌的发展[9]。另外,HMGB2可以通过调控p53的表达增强肿瘤细胞的生存、侵袭能力以及对化疗药物的拮抗作用,从而促进骨肉瘤、恶性胶质瘤的发生与发展[23-24]。另有研究表明,HMGB2可以促进Oct4的小泛素相关修饰物(SUMO)化,从而抑制其被磷酸化降解,进一步激活AKT通路,促进细胞增殖和抑制细胞凋亡[25]。
本研究扩增了HMGB2启动子所在区域的DNA片段,成功构建了含有HMGB2启动子序列的荧光素酶报告基因重组质粒。p53可通过结合HMGB2启动子区抑制其转录[15],本实验所构建的pGL3-HMGB2-promoter报告质粒活性能够被p53抑制,与之一致。该质粒的构建有助于寻找能够与HMGB2启动子结合并促进HMGB2表达的转录因子,进而阐明HMGB2参与肿瘤发生发展过程的具体分子机制。
通过在线软件PROMO对HMGB2启动子序列进行分析预测,获得72个可能作用于HMGB2的转录因子,其中p53已被报道可以转录调控HMGB2[15]。另外,预测结果中的许多转录因子可以与HMGB2直接结合,或者受HMGB2调控从而影响其行使转录功能。例如,HMGB2可以促进转录因子TFⅡD-TFⅡA与其调控的目的基因的启动子区结合从而促进下游基因的转录[26]。HMGB2可以促进转录因子Lef-1的表达及其与β-catenin复合物的形成,进而诱导下游基因的表达[17-18]。HMGB2还可以通过促进转录因子Oct2的表达,抑制正常B淋巴细胞的分化、维持B淋巴瘤细胞的存活导致B淋巴瘤的发生[19, 27]。这些转录因子是否能够调控HMGB2转录,目前尚不清楚。我们下一步将以这些可能作用于HMGB2启动子区域的转录因子为基础,探究其在HMGB2转录过程中的作用,从而有助于阐明HMGB2参与肿瘤发生发展的具体机制。
[ 1 ] Thomas JO, Travers AA.HMG1 and 2, and related ‘architectural’ DNA-binding proteins[J]. Trends Biochem Sci, 2001, 26(3): 167-174.
[ 2 ] Reeves R. Nuclear functions of the HMG proteins[J]. Biochim Biophys Acta, 2010, 1799(1/2): 3-14.
[ 3 ] Bustin M,Reeves R.High-mobility-group chromosomal proteins:architectural components that facilitate chromatin function[J]. Prog Nucleic Acid Res Mol Biol, 1996, 54: 35-100.
[ 4 ] Bianchi ME, Manfredi AA. High-mobility group box 1(HMGB1) protein at the crossroads between innate and adaptive immunity[J]. Immunol Rev, 2007, 220: 35-46.
[ 5 ] Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J]. Nature, 2002, 418(6894): 191-195.
[ 6 ] Kwon JH, Kim J, Park JY, et al. Overexpression of high-mobility group box 2 is associated with tumor aggressiveness and prognosis of hepatocellular carcinoma[J]. Clin Cancer Res, 2010, 16(22): 5511-5521.
[ 7 ] Zhao XL, Lin Y, Jiang J, et al. High-mobility group box 1 released by autophagic cancer-associated fibroblasts maintains the stemness of luminal breast cancer cells[J]. J Pathol, 2017, 243(3): 376-389.
[ 8 ] Taniguchi N, Caramés B, Hsu E, et al. Expression patterns and function of chromatin protein HMGB2 during mesenchymal stem cell differentiation[J]. J Biol Chem, 2011, 286(48): 41489-41498.
[ 9 ] Redmond AM, Byrne C, Bane FT, et al. Genomic interaction between ER and HMGB2 identifies DDX18 as a novel driver of endocrine resistance in breast cancer cells[J]. Oncogene, 2015, 34(29): 3871-3880.
[10] McGhee JD, Krause MW. Transcription factors and transcriptional regulation[M]. Riddle DL, Blumenthal T, Meyer BJ, et al.C.elegansⅡ. 2nd. New York: Cold Spring Harbor Laboratory Press, 1997:117-184.
[11] Trinklein ND, Aldred SJ, Saldanha AJ, et al. Identification and functional analysis of human transcriptional promoters[J]. Genome Res, 2003, 13(2): 308-312.
[12] Davuluri RV, Grosse I, Zhang MQ. Computational identification of promoters and first exons in the human genome[J]. Nat Genet, 2001, 29(4): 412-417.
[13] Down TA, Hubbard TJ. Computational detection and location of transcription start sites in mammalian genomic DNA[J]. Genome Res, 2002, 12(3): 458-561.
[14] Ohler U, Niemann H. Identification and analysis of eukaryotic promoters: recent computational approaches[J]. Trends Genet, 2001, 17(2): 56-60.
[15] Shin YJ, Kim MS, Kim MS, et al. High-mobility group box 2 (HMGB2) modulates radioresponse and is downregulated by p53 in colorectal cancer cell[J]. Cancer Biol Ther, 2013, 14(3): 213-221.
[16] Coleman RA, Qiao Z, Singh SK, et al. p53 dynamically directs TFⅡD assembly on target gene promoters[J]. Mol Cell Biol, 2017, 37(13): pii:e00085-17.
[17] Taniguchi N, Kawakami Y, Maruyama I, et al. HMGB proteins and arthritis[J]. Hum Cell, 2018, 31(1): 1-9.
[18] Taniguchi N, Caramés B, Kawakami Y, et al. Chromatin protein HMGB2 regulates articular cartilage surface maintenance via β-catenin pathway[J]. Proc Natl Acad Sci U S A, 2009, 106(39): 16817-16822.
[19] Hodson DJ, Shaffer AL, Xiao W, et al. Regulation of normal B-cell differentiation and malignant B-cell survival by OCT2[J]. Proc Natl Acad Sci U S A, 2016, 113(14): E2039-E2046.
[20] Quesnelle KM, Grandis JR. Dual kinase inhibition of EGFR and HER2 overcomes resistance to cetuximab in a novelinvivomodel of acquired cetuximab resistance[J]. Clin Cancer Res, 2011, 17(18): 5935-5944.
[21] Yang S, Liu Y, Li MY, et al. FOXP3 promotes tumor growth and metastasis by activating Wnt/β-catenin signaling pathway and EMT in non-small cell lung cancer[J]. Mol Cancer, 2017, 16(1): 124.
[22] Zhao L, Ji G, Le X, et al. An integrated analysis identifies STAT4 as a key regulator of ovarian cancer metastasis[J]. Oncogene, 2017, 36(24): 3384-3396.
[23] Wu ZB, Cai L, Lin SJ, et al. High-mobility group box 2 is associated with prognosis of glioblastoma by promoting cell viability, invasion, and chemotherapeutic resistance[J]. Neuro Oncol, 2013, 15(9): 1264-1275.
[24] Stros M, Ozaki T, Bacikova A, et al. HMGB1 and HMGB2 cell-specifically down-regulate the p53- and p73-dependent sequence-specific transactivation from the human Bax gene promoter[J]. J Biol Chem, 2002, 277(9): 7157-7164.
[25] Campbell PA, Rudnicki MA. Oct4 interaction with Hmgb2 regulates Akt signaling and pluripotency[J]. Stem Cells, 2013, 31(6): 1107-1120.
[26] Shykind BM, Kim J, Sharp PA. Activation of the TFIID-TFIIA complex with HMG-2[J]. Genes Dev, 1995, 9(11): 1354-1365.
[27] Zwilling S, König H, Wirth T. High mobility group protein 2 functionally interacts with the POU domains of octamer transcription factors[J]. EMBO J, 1995, 14(6): 1198-1208.

