mTIGIT-mLumin跨膜融合蛋白慢病毒载体和真核表达载体的构建及体外的稳定表达
王晶哲, 王小铃, 王娟, 杨鑫鑫, 闫美娜, 李欣悦, 王荟, 刘霞, 邵启祥
(江苏大学医学院, 江苏 镇江 212013)
T细胞免疫球蛋白和免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibition motif,ITIM)结构域蛋白(T cell Ig and ITIM domin,TIGIT)是近年来新发现的具有免疫抑制作用的共刺激分子,是NK和T细胞共有的抑制性受体[1];其是由244个氨基酸残基组成的Ⅰ型跨膜蛋白,含有一个IgV样结构域的胞外段、一个跨膜区及一个含ITIM的胞内段[2]。TIGIT能够与CD226竞争结合脊髓灰质炎病毒受体(poliovirus receptor,PVR,即CD155)从而抑制T细胞的活化,TIGIT与PVR结合的亲和力远高于CD226。PVR主要表达于肿瘤细胞和抗原提呈细胞表面[3-4]。TIGIT与树突状细胞表面的PVR结合后促进IL-10表达,抑制IL-12(p40)表达[5]。研究表明,TIGIT与自身免疫性脑脊髓炎(EAE)等多种自身免疫性疾病有关[6]。研究发现PD-1/PDL-1/2抗体治疗会出现耐药,而耐药的主要原因是肿瘤微环境表达大量的TIGIT等负向调节分子[7-8],因此深入阐明TIGIT等分子的生物学功能,研发其阻断型抗体进行临床肿瘤治疗就显得尤为迫切。
mLumin是华中科技大学武汉国家光电实验室(筹)骆清铭和张智红教授通过基因重组构建的一种新型的红色荧光蛋白,发射波长为621 nm[9]。mLumin的组织穿透能力强,并且光谱串扰比较小[10],所以是一种良好的荧光蛋白。抗原表位对抗体的制备具有重要意义,本研究拟建立一个能够用于蛋白质在细胞膜表面表达的通用载体,为此我们选择TIGIT作为靶分子,构建其胞外序列、跨膜区和mLumin表达载体,为后期筛选阳性表达细胞、流式细胞术分选目标细胞奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级C57BL/6小鼠,6~8周,雄性,本校实验动物中心提供,合格证号:No.201708296。
1.1.2 主要试剂和仪器 人肾上皮HEK-293T细胞为我院许文荣教授惠赠;非洲绿猴肾成纤维Cos7细胞由我院钱海老师惠赠,细胞培养于37 ℃,5% CO2和含10%胎牛血清的DMEM完全培养基中。plenti-puro慢病毒质粒由本实验室杜凤移老师赠送;pcDNA3.1-mLumin红色荧光蛋白质粒由华中科技大学武汉光电国家实验室张智红教授惠赠。PrimeSTAR DNA聚合酶、限制性内切酶(HindⅢ,BamHⅠ,XbaⅠ,XhoⅠ)、T4DNA连接酶、DL2000 DNA标准参照物和Trizol为TaKaRa公司产品;PCR引物、DNA胶回收试剂盒和DNA纯化试剂盒购自上海生工生物技术有限公司;LipfectamineTM2000 (Invitrogen公司);S1000TMThermal Cycler PCR仪(Bio-Rad公司);恒温培养摇床QYC-211(上海福马实验设备有限公司);荧光倒置显微镜(德国Zeiss公司);TCS SP5Ⅱ共聚焦显微镜(德国Leica公司)。
1.2 方法
1.2.1 plenti-puro-mTIGIT-mLumin和pcDNA-mTIGIT-mLumin载体的构建与鉴定
1.2.1.1 mTIGIT胞外段、跨膜区和mLumin基因序列特异性引物设计 检索NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)和Uniprot数据库(http:∥www.uniprot.org/),获得小鼠mTIGIT胞外段及跨膜区的cDNA序列。搜索数据库查找mLumin序列。按照序列设计引物后在NCBI数据库上进行比对,根据载体上可用的限制性内切酶加于引物两端并选择特定的保护性碱基。
因为plenti-puro和pcDNA3.1的载体不同,根据载体酶切位点的不同设计2对mTIGIT特异性引物和mLumin特异性引物。合成的引物序列见表1(表中下划线表示酶切位点)。
1.2.1.2 小鼠脾脏细胞RNA的提取 采用CO2麻醉处死C57BL/6小鼠,无菌眼科镊剪取脾;用无菌 PBS冲洗后剪碎,并轻轻吹打,200目筛网过滤;PBS洗2次,弃上清液;加入红细胞裂解液作用8 min;4 ℃,1 500 r/min离心5 min,PBS洗涤2次,弃上清液;加入1 mL Trizol裂解细胞,按照说明书提取总RNA。
1.2.1.3 mTIGIT和mLumin序列的扩增、纯化和回收 取脾细胞总RNA,反转录为cDNA,利用PCR技术获得目的序列并回收。mLumin序列经PCR扩增后进行胶回收。
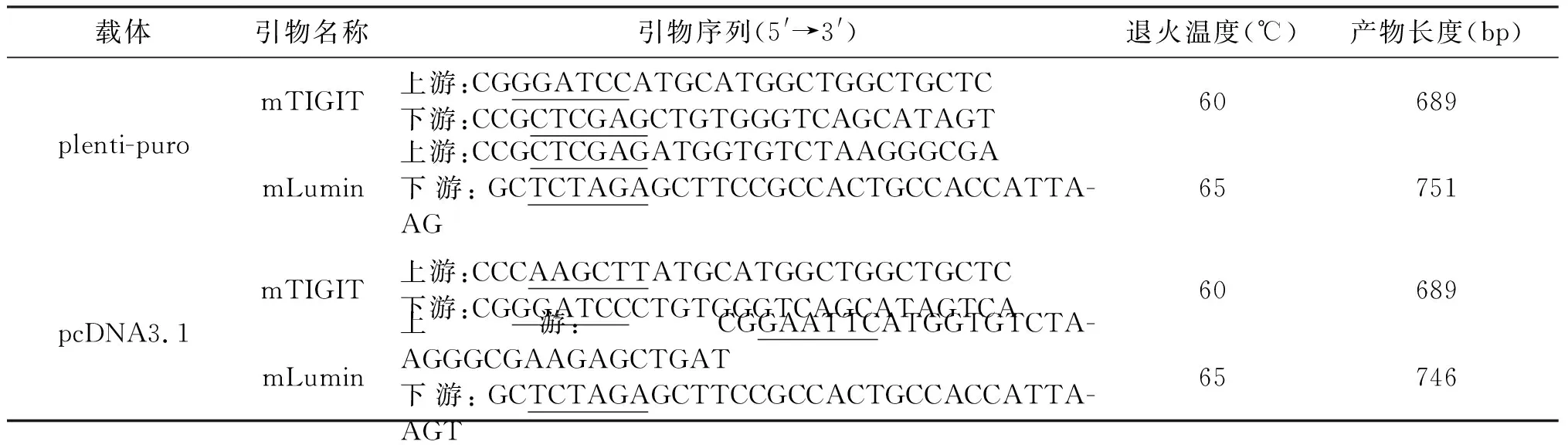
表1 mTIGIT基因和mLumin基因的PCR引物
1.2.1.4 目的基因与载体进行酶切、连接、转化、筛选 将获得的mLumin序列与对应的载体用限制性核酸内切酶进行双酶切;经T4连接酶连接后转入DH5α感受态扩增;摇床37 ℃振荡12~16 h,提取质粒;再以提取的质粒为载体与mTIGIT序列进行双酶切;再次连接之后转入DH5α感受态扩增,提取质粒;将提取的质粒进行PCR鉴定和测序鉴定,利用PubMed数据库进行分析对比。
1.2.2 重组质粒转染细胞及荧光鉴定
1.2.2.1 荧光显微镜检测plenti-puro-mTIGIT-mLumin重组质粒 将重组质粒与pspax、pMD2.0G(3 ∶2 ∶1)用无血清DMEM共转染HEK293T细胞8~12 h,然后换成10%胎牛血清DMEM完全培养基,分别收取24 h和48 h的病毒上清液;再将病毒与含血清培养基按1 ∶1的比例加入新的HEK-293T细胞,感染24~48 h,用荧光显微镜检测融合蛋白的表达。
1.2.2.2 共聚焦显微镜检测pcDNA3.1-mTIGIT-mLumin重组质粒 pcDNA3.1-mTIGIT-mLumin重组质粒瞬时转染Cos7细胞(方法同“1.2.2.1”),48 h之后加入G418至1 mg/mL,筛选获取阳性克隆,并在共聚焦显微镜下观察融合蛋白的表达。
2 结果
2.1 mTIGIT和mLumin基因的克隆
针对plenti-puro载体设计mTIGIT和mLumin的PCR扩增产物长度分别为689 bp和751 bp,酶切位点分别为HindⅢ、BamHⅠ和XbaⅠ。针对pcDNA3.1载体的产物长度分别为689 bp和746 bp,酶切位点分别为BamHⅠ,XhoⅠ和XbaⅠ。经琼脂糖凝胶电泳显示,出现的目的条带位置与预期一致。表明PCR扩增的基因克隆正确,见图1。

M:DNA标准参照物;N:空白对照;T:mTIGIT扩增产物;L:mLumin扩增产物;A:mTIGIT(plenti-puro载体);B:mLumin(plenti-puro载体);C:mTIGIT(pcDNA3.1载体);D:mLumin(pcDNA3.1载体)
2.2 plenti-puro-mTIGIT-mLumin和pcDNA3.1-mTIGIT-mLumin质粒的构建与鉴定
2.2.1 plenti-puro-mTIGIT质粒的构建与鉴定 经琼脂糖电泳鉴定以及测序结果对比分析,plenti-puro-mTIGIT-mLumin质粒构建成功(图2)。
2.2.2 pcDNA3.1-mTIGIT-mLumin质粒的构建与鉴定 经琼脂糖电泳检测和测序结果比对分析,证实pcDNA3.1-mTIGIT-mLumin质粒构建成功。见图3。
2.3 两种载体均能很好地表达于目的细胞胞膜
目的基因mTIGIT-mLumin融合蛋白定位于细胞膜表面,而只携带mLumin基因的质粒其蛋白则表达于整个细胞(为了可以与阳性对照进行对比,图片拍于未用puromycin筛选前)。见图4。
利用荧光显微镜和共聚焦显微镜进行观察,确认mTIGIT-mLumin融合蛋白成功表达于Cos7细胞表面。见图5。
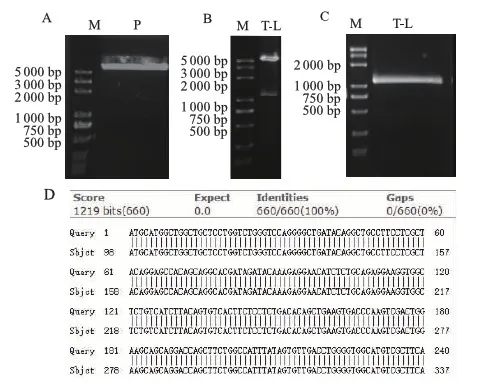
M:DNA标准参照物;P:载体酶切产物;T-L:mTIGIT-mLumin融合基因;A:plenti-puro载体的双酶切产物电泳图;B:mTIGIT-mLumin融合基因阳性质粒酶切鉴定结果;C:mTIGIT-mLumin融合基因阳性质粒PCR鉴定结果;D:测序结果

M:DNA标准参照物;P:载体酶切产物;T-L:mTIGIT-mLumin融合基因;A:pcDNA3.1载体的双酶切电泳图;B:mTIGIT-mLumin融合基因阳性质粒PCR鉴定结果
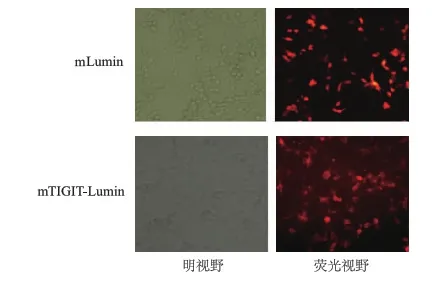
图4 对照质粒及plenti-puro-mTIGIT-mLumin质粒转染细胞结果(200×)
3 讨论
近来CAR-T和PD-1/PDL-1抗体的免疫生物治疗取得了突破性进展,淋巴瘤治疗总体有效率达到50%~60%[1-2]。但在治疗中出现了耐PD-1/PDL-1抗体的现象,通过深入研究发现这些患者的肿瘤微环境表达大量的TIGIT、LAG3和TIM3等[8]。TIGIT主要表达于NK和T细胞,其抑制NK细胞毒作用,引起T细胞的耗竭和增强Treg的功能[11-12]。研究证明抑制TIGIT有利于促进抗肿瘤免疫治疗[11,13]。共同阻断PD-1和TIGIT时,能明显恢复其抗肿瘤的CD8+T细胞的活性[14]。
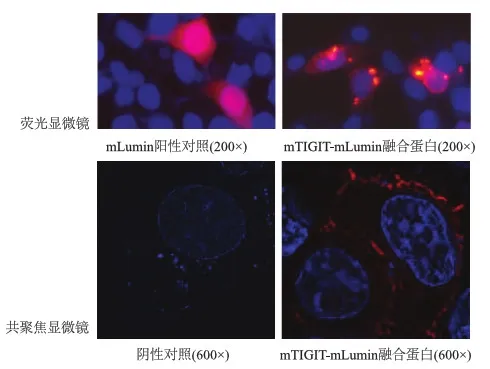
图5 重组质粒融合蛋白的表达
以往抗体的制备除了采用天然抗原外,还采用基因工程蛋白作为抗原的主要来源,而抗体的产生与抗原的功能性表位密切相关。目前基因工程表达的蛋白多来源于原核的工程菌,缺乏糖基化,而糖基化对抗原决定簇的性质影响很大,故导致许多表位的缺失。即使采用毕赤酵母等进行表达,其添加的寡糖只有甘露糖残基,而动物和人等高等真核生物的寡糖组成有N-乙酰氨基半乳糖、半乳糖和唾液酸等。此外,在对糖基化蛋白选择上,毕赤酵母与高等真核生物也有很多不同,有些蛋白在天然宿主中并不会被糖基化,但毕赤酵母却能使这些蛋白糖基化。而有些蛋白在天然宿主中被糖基化,但在毕赤酵母中其丝氨酸和苏氨酸未糖基化,因此其表达的抗原特异性也与原宿主蛋白有很大的差异。再者即使是原宿主来源蛋白,如果经过变性处理,特别是甲醛等处理,容易导致蛋白质间基团的交联,随着空间结构的改变其抗原特异性也部分发生改变。本研究建立了以mLumin荧光蛋白为指示系统的跨细胞膜蛋白表达载体,既可以表达蛋白,又可指示蛋白质是否能表达于细胞膜表面,还有利于采用流式细胞术分选。此外,该表达系统能高效表达TIGIT跨膜区及胞外段蛋白,mLumin荧光蛋白起到了很好的指示效果。
[ 1 ] Zheng JM, Cui JL, He WT, et al. Construction and characterization of recombinant adenovirus carrying a mouse TIGIT-GFP gene[J]. Genet Mol Res, 2015, 14(4):18650-18651.
[ 2 ] 方亮, 陈丽华, 金伯泉. 一种新的免疫抑制性受体TIGIT[J]. 细胞与分子免疫学杂志, 2012, 28(1): 108-110.
[ 3 ] Sakisaka T, Takai Y. Biology and pathology of nectins and nectin-like molecules[J]. Curr Opin Cell Biol, 2004, 16(5): 513-521.
[ 4 ] Fuchs A, Colonna M. The role of NK cell recognition of nectin and nectin-like proteins in tumor immunosurveillance[J]. Semin Cancer Biol, 2006, 16(5): 359-366.
[ 5 ] Yu X, Harden K, Gonzalez LC, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells[J]. Nat Immunol, 2009, 10(1): 48-57.
[ 6 ] Joller N, Hafler JP, Brynedal B, et al. Cutting edge: TIGIT has T cell-intrinsic inhibitory functions[J]. J Immunol, 2011, 186(3): 1338-1342.
[ 7 ] Ma Y, Yang H, Pitt JM, et al. Therapy-induced microenvironmental changes in cancer[J]. J Mol Med (Berl), 2016, 94(5): 497-508.
[ 8 ] Nowicki TS, Hu-Lieskovan S, Ribas A. Mechanisms of resistance to PD-1 and PD-L1 blockade[J]. Cancer J, 2018, 24(1): 47-53.
[ 9 ] 樊晋宇, 崔宗强, 张先恩. 红色荧光蛋白的光谱多样性及体外分子进化[J]. 生物化学与生物物理进展, 2008, 35(10): 1112-1120.
[10] Chu J, Zhang Z, Zheng Y, et al. A novel far-red bimolecular fluorescence complementation system that allows for efficient visualization of protein interactions under physiological conditions[J]. Biosens Bioelectron, 2009, 25(1): 234-239.
[11] Blake SJ, Dougall WC, Miles JJ, et al. Molecular pathways: Targeting CD96 and TIGIT for cancer immunotherapy[J]. Clin Cancer Res, 2016, 22(21): 5183-5188.
[12] Manieri NA, Chiang EY, Grogan JL. TIGIT: a key inhibitor of the cancer immunity cycle[J]. Trends Immunol, 2017, 38(1): 20-28.
[13] Callahan MK, Postow MA, Wolchok JD. Targeting T cell co-receptors for cancer therapy[J]. Immunity, 2016, 44(5): 1069-1078.
[14] Johnston R J, Comps-Agrar L, Hackney J, et al. The immunoreceptor TIGIT regulates antitumor and antiviral CD8+T cell effector function[J]. Cancer Cell, 2014, 26(6): 923-937.

