前哨淋巴结阳性的早期乳腺癌患者免行腋窝淋巴结清扫的可行性研究
韩萌萌,姜鹏玲,陈薇,张敏,刘梅,张晟,只向成
前哨淋巴结活检(sentinel lymph node biopsy,SLNB)于20世纪90年代被引入早期乳腺癌的治疗中,目前已经成为国际上治疗早期乳腺癌的标准术式[1]。通过SLNB可以了解腋窝淋巴结(axillary lymph node,ALN)的状态,从而使一些前哨淋巴结(SLN)阴性的患者免行腋窝淋巴结清扫(axillary lymph node dissection,ALND),而SLN阳性的患者则建议行ALND[2]。但是,近年来有临床研究发现,某些SLN阳性的乳腺癌患者在行ALND后,并未获得生存优势,ALND与5年总生存期(overall survival,OS)和5年无病生存期(disease-free survival,DFS)并无关系[3]。本研究通过比较SLN不同状态患者的ALN阳性率,探讨SLN阳性的早期乳腺癌患者免行ALND的可行性。
1 资料与方法
1.1 一般资料 收集2014年9月—2016年9月来我院就诊的591例早期乳腺癌患者的临床资料,所有患者均为女性,年龄23~81岁,平均(52.3±10.70)岁,临床分期均为T1~2N0M0。患者全部拟行ALND,在行ALND前均行SLNB,将SLN取出行快速冰冻病理切片检查,根据快速冰冻病理结果将患者分组。其中,SLN(-)组320例,SLN(+)=1组172例,SLN(+)=2组72例,SLN(+)≥3组27例。通过统计学分析,各组间年龄、临床分期、病理类型、雌激素受体(ER)、孕激素受体(PR)以及组织学分级方面比较差异均无统计学意义,见表1。
1.2 入选病例的纳入标准 (1)初诊为原发性乳腺癌。(2)临床分期为Ⅰ期或Ⅱ期。(3)临床查体、彩色超声和钼靶提示ALN未见转移。(4)患者腋窝既往无手术史,术前未接受放化疗等治疗。(5)除外其他肿瘤病史。
1.3 手术方法 根据肿瘤位置选择美蓝(亚甲蓝)注射部位,若肿瘤位于外上象限,美蓝注射于肿物表面皮下;若肿瘤位于其他部位,则注射于乳晕区皮下。将1%美蓝溶液2~4 mL注射完毕后局部按摩5~10 min,等待5 min,此操作直接在手术室消毒前完成,后常规消毒铺巾,取腋下与腋皱襞平行的弧形切口切开皮肤、皮下脂肪,沿腋窝方向分离皮瓣,寻找蓝染的淋巴管及淋巴结即为SLN,将SLN取出行快速冰冻病理切片检查。591例患者均行常规ALND,ALN行常规石蜡切片病理检查。
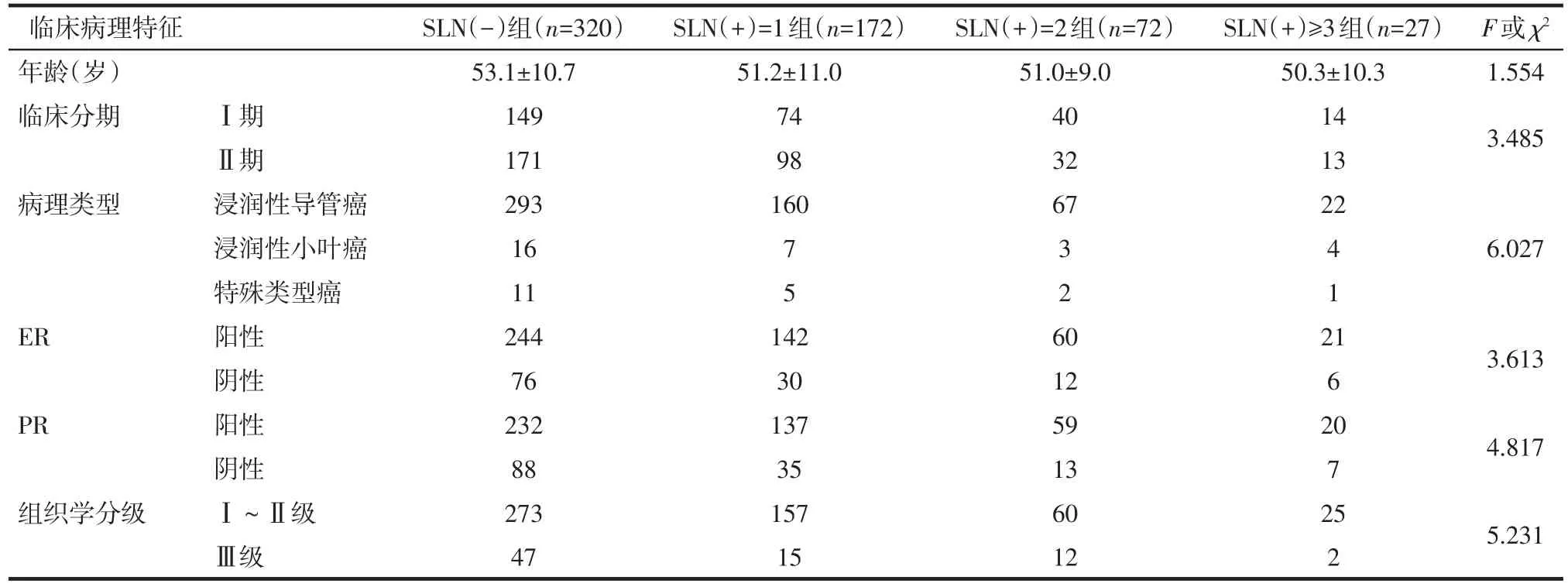
Tab.1 Comparison of clinicopathological characteristics between different groups of patients表1 各组患者间临床病理特征比较
1.4 统计学方法 所有数据均采用SPSS 22.0软件进行分析,定性资料组间比较采用χ2检验,符合正态分布的定量资料用均数±标准差(±s)表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
所有患者均成功检出SLN,SLN检出率为100%。共检出1 800枚SLN,平均3.0枚/例。SLN阴性、1枚、2枚、3枚、4枚、5枚、6枚、7枚者分别为320、172、72、16、5、3、2和1例。行ALND后共清扫出8 162枚淋巴结,平均13.8枚/例。其中,SLN(-)组、SLN(+)=1组、SLN(+)=2组和SLN(+)≥3组患者ALN阳性率分别为5.0%(16/320)、8.1%(14/172)、16.7%(12/72)和37.0%(10/27)。SLN假阴性16例,假阴性率为5.0%,准确率为95.0%。经过统计学分析,患者间ALN阳性率的差异有统计学意义(χ2=38.232,P<0.001)。其中,SLN(+)=1组与SLN(-)组ALN阳性率比较差异无统计学意义(χ2=1.926,P=0.165);SLN(+)=2组的ALN阳性率高于SLN(-)组(χ2=12.062,P=0.001)和SLN(+)=1组(χ2=3.876,P=0.049),差异均有统计学意义;SLN(+)≥3组的ALN阳性率明显高于SLN(-)组(χ2=32.939,P<0.001)、SLN(+)=1组(χ2=15.751,P<0.001)和SLN(+)=2组(χ2=4.714,P=0.030),差异均有统计学意义。与SLN阴性患者相比,1枚、2枚以及≥3枚SLN阳性患者ALN阳性的相对危险度(RR)分别为1.365(95%CI:0.912~2.042)、2.600(95%CI:1.599~4.228)和 7.262(95%CI:3.712~14.208)。
3 讨论
目前乳腺癌已成为女性患者最高发的恶性肿瘤,在其众多转移途径中淋巴转移最为重要。ALND作为传统乳腺癌手术的重要组成部分,对评价乳腺癌预后具有十分重要的意义[4]。但是,ALND后患者会产生一定的并发症,如出血、感染、患侧上肢感觉和活动障碍、疼痛等[5]。并且,有研究显示,接受乳腺癌手术的患者中约50%~70%并无ALN转移,而早期浸润性乳腺癌仅5%左右有ALN转移[6]。由此可知,对于ALN无转移的患者来说,ALND不但没有起到治疗作用,还降低了术后的生活质量。基于这种理论,SLNB逐渐开始常规应用于临床。SLN是乳腺癌肿瘤区域淋巴结引流的第1站,可以代表整个ALN的状态,若SLN未转移,则其他区域淋巴结一般不会受累,尤其是早期乳腺癌患者发生转移的概率更低。若SLN出现转移,则认为其他区域淋巴结可能受累。因此,临床上可通过SLNB预测ALN的状态,以此来指导是否行ALND。
自从SLNB应用于乳腺癌手术以来,该方法已逐渐被接受。在行SLNB时,炎性乳癌和临床触诊N2期ALN是禁忌证。对于SLN阴性的早期乳腺癌患者,SLNB替代ALND是可行的。NSABP B-32试验[7]及范铁等[8]的研究已经明确了SLN阴性乳腺癌患者免行ALND的可行性。在临床工作过程中,由于SLNB技术进入临床诊疗指南时间较短,临床医生掌握情况不同以及患者对其认识度和接受度均欠缺,因此只有一部分SLN阴性的患者免行了ALND。对于仅1枚SLN微转移的患者,在与患者及家属充分沟通后,也有部分患者未进行进一步的ALND。但是,此部分患者的远期效果尚缺乏证据。有研究显示,SLNB在早期乳腺癌人群中的检出率90%~95%,假阴性率仅为5%~10%[9]。本研究中,所有患者均成功检出SLN,SLN的检出率100%,SLN预测ALN有无转移的假阴性率为5.0%。在我国,SLN的假阴性问题是制约其在医院开展的重要原因之一。SLN假阴性的出现可能与SLN有浅组和深组之分、跳跃式转移、示踪方法、肿瘤原发灶呈多中心等因素相关。因此,在行SLNB时,要严格掌握其技术及操作规范,选择适宜的患者和合理的示踪方法,使SLNB的假阴性率降到可接受程度。鉴于SLN的检出率和假阴性率与术者的学习曲线具有相关性,医疗机构在开展SLNB前,术者应至少完成40例SLNB[10]。ACOSOG-Z0011 试 验 结 果表明,对 于SLN1~2枚阳性的乳腺癌患者,符合肿块大小T1~2、患者接受保乳治疗及后续全乳放疗等条件,可用SLNB代替ALND[11]。本研究结果也支持1枚SLN阳性患者可考虑免行ALND。AMAROS试验证明了对于临床早期、淋巴结阴性但SLN阳性的乳腺癌患者,分别行ALND和腋窝放射治疗后随访5年,2组腋窝复发率差异无统计学意义[12]。基于此试验,笔者认为对于早期乳腺癌患者,以SLNB+放射治疗替代ALND是可行的,但尚需大规模的临床试验证实其安全性。Kwon等[1]研究了SLN阳性患者的临床病理特征与腋窝非SLN转移的关系,结果显示2枚及以上SLN阳性的患者较非SLN更易发生转移,这一结果也支持本研究结论。IBCG23-01临床试验表明,对于行改良根治术的患者,若SLN微转移,免行ALND是可行的,而对于SLN宏转移的患者是否可以免行ALND并未阐明[13]。本研究纳入了SLN宏转移患者,所有患者SLNB后均行ALND,根据结果,SLN(-)组、SLN(+)=1组、SLN(+)=2组和SLN(+)≥3组ALN阳性率分别为5.0%(16/320)、8.1%(14/172)、16.7%(12/72)和37.0%(10/27)。SLN(+)=2组的ALN阳性率高于SLN(-)组和SLN(+)=1组;SLN(+)≥3组的ALN阳性率明显高于其他3组。与SLN阴性患者相比,1枚SLN阳性患者ALN阳性的RR为1.365(95%CI:0.912~2.042),但差异无统计学意义;2枚以及≥3枚SLN阳性患者ALN阳性的RR分别为2.600(95%CI:1.599~4.228)和 7.262(95%CI:3.712~14.208)且有统计学意义。
综上所述,笔者认为在乳腺癌的临床治疗过程中,1枚SLN阳性的患者可考虑仅行SLNB,但2枚及以上SLN阳性的患者则需常规行ALND,这有助于于减少乳腺癌患者ALND后的上肢水肿、麻木等并发症。但是,由于本研究入组的样本量较小,确切结论还需更多病例数的、更高水平的循证学依据来验证。
[1]Kwon Y,Ro J,Kang HS,et al.Clinicopathological parameters and biological markers predicting non-sentinel node metastasis in sentinel node-positive breast cancer patients[J].Oncol Rep,2011,25(4):1063-1671.doi:10.3892/or.2011.1157.
[2]杨奔,杨莉,左文述,等.前哨淋巴结转移状况对非前哨淋巴结转移预测价值的探讨[J].中华医学杂志,2013,93(14):1072-1075.Yang B,Yang L,Zuo WS,et al.Value of sentinel lymph node metastasis status in predicting the presence of residual disease in thenon-sentinel lymph node of breast cancer patients[J].Natl Med JChina,2013,93(14):1072-1075.doi:10.3760/ema.j.issn.0376-2491.2013.14.009.
[3]Nakamura S.Axillary lymph node dissection in sentinel node positive breast cancer:is it necessary?[J].Curr Opin Obstet Gynecol,2013,48(2):128-133.
[4]王杰,王昕,王文彦,等.乳腺肿物局部切除术后乳腺癌前哨淋巴结活检的可行性分析[J].中华肿瘤杂志,2016,38(7):548-551.Wang J,Wang X,Wang WY,et al.Feasibility analysis of sentinel lymph node biopsy in patients with breast cancer after local lumpectomy[J].Chin J Cancer,2016,38(7):548-551.doi:10.3760/cma.j.issn.0253-3766.2016.07.013.
[5]Sarri AJ,Dias R,Laurienzo CE,et al.Armlymphoscintigraphy after axillary lymph node dissection or sentinel lymph node biopsy in breast cancer[J].Onco Targets Ther,2017,10:1451-1457.doi:10.2147/OTT.S117830.
[6]姜军.提高对乳腺癌前哨淋巴结活检意义的认识[J].中华肿瘤防治杂志,2008,15(10):721-724.Jiang J.Enhancing the understanding of sentinel lymph node biopsy of breast cancer[J].Chin J Cancer Prevent Treatment,2008,15(10):721-724.doi:10.3969/j.issn.1673-5269.2008.10.001.
[7]Krag DN,Anderson SJ,Julian TB,et al.Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer:overall survival findings from the NSABPB-32 randomised phase 3 trial[J].Lancet Oncol,2010,11(10):927-933.doi:10.1016/S1470-2045(10)70207-2.
[8]范铁,欧阳涛,李金锋,等.前哨淋巴结阴性原发性乳腺癌患者免除腋淋巴结清扫安全性分析[J].中华医学杂志,2013,93(40):3220-3222.Fan T,Ouyang T,Li JF,et al.Safety of omitting axillary lymph node dissection in primary breast cancer patients with negative sentinel lymph nodes[J].Natl Med JChina,2013,93(40):3220-3222.doi:10.3760/cma.j.issn.0376-2491.2013.40.013.
[9]Boughey JC,Hunt KK.Expanding the indications for sentinel lymph node surgery in breast cancer[J].Future Oncol,2007,3(1):9-14.
[10]曹欣华,张亚男,胡浩霖,等.乳腺癌前哨淋巴结的临床研究进展[J].中华乳腺病杂志(电子版),2017,11(2):109-113.Cao XH,Zhang YN,Hu HL,et al.Clinical research progress of sentinel lymph node in breast cancer[J].Chin J Breast Dis(Electronic Edition),2017,11(2):109-113.doi:10.3877/cma.j.issn.1674-0807.2017.02.011.
[11]Morrow M,Van Zee KJ,Patil S,et al.Axillary dissection and nodal irradiation can be avoided for most node-positive Z0011-eligible breast cancers:a prospective validation study of 793 patients[J].Ann Surg,2017,266(3):457-462.doi:10.1097/SLA.0000000000002354.
[12]Donker M,Van Tienhoven G,Straver ME,et al.Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer(EORTC 10981-22023 AMAROS):a randomised,multicentre,open-label,phase 3 non-inferiority trial[J].Lancet Oncol,2014,15(12):1303-1310.doi:10.1016/S1470-2045(14)70460-7.
[13]Hieken TJ,Boughey JC.Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases:commentary on the IBCSG 23-01 Trial[J].Gland Surg,2013,2(3):128-132.doi:10.3978/j.issn.2227-684X.2013.07.04.

