芪智消渴颗粒对MPTP诱导斑马鱼神经损伤的保护作用
王荣春,程丽芳,韩利文,何秋霞,陈锡强,侯海荣,张新军,李 莹,刘可春
[1. 齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东省生物检测技术工程实验室,山东省科学院药物筛选技术重点实验室;2. 山东省中医药研究院,山东 济南 250014]
神经系统疾病如癫痫、帕金森综合症、阿尔茨海默病等疾病都存在神经细胞损伤的共同病理特症[1];糖尿病、心血管等多种疾病也伴有神经损伤的存在[2]。神经损伤包括神经元凋亡、神经元周围细胞或组织发生病变等引起的神经元功能异常或缺失。目前认为神经细胞损伤的发生涉及多种生理生化机制,包括一氧化氮(nitric oxide,NO)蓄积、炎性损伤、氧化损伤、神经细胞凋亡、细胞内钙离子超载、自噬等[3-4]。这些过程往往相互影响,互相促进,从而造成神经细胞损伤及凋亡,最终引起各种病理症状。神经系统疾病相关药物的研发是我国急需重点突破的领域。采用新型药物筛选模型,快速发现药物对神经功能的保护作用,将为新药研发提供先期实验依据。
已有许多文献报道,中药及有效成分在神经系统疾病的防治中体现了巨大的优势。研究表明,中药来源的苏木素、姜黄素等中药成分有抗神经炎症的作用,在神经保护方面具有重要作用[5-6]。中药是多成分体系,通过多个环节阻止或者延缓神经损伤作用,从而保护神经组织免遭更严重的破坏,进而提高脑神经损伤患者的生活质量,并达到治疗疾病的目的。芪智消渴颗粒(Qi Zhi Xiaoke granules,QZXK)处方源于国家级名老中医冯建华教授临床验方,由黄芪、何首乌、益智仁、淫羊藿、雄蚕蛾、熟地、丹参、远志、黄连等9味中药组成,临床用于中医辨证属脾肾亏损、精血亏虚、瘀血阻络、脑髓失养者,可有效治疗和改善多种疾病,具有良好的神经营养和神经功能促进作用,在糖尿病患者中有广泛应用。本实验采用斑马鱼作为神经损伤保护的快速筛选模型,快速检测QZXK在神经损伤中的保护作用,并用PC12细胞系进一步研究其作用机制,以期为QZXK深入研究与应用提供实验基础。
1 材料与方法
1.1材料
1.1.1实验动物 野生型斑马鱼AB系山东省科学院斑马鱼药物筛选中心提供。成年斑马鱼在斑马鱼养殖系统中饲养。水温控制在(27~28.5) ℃,光照自动控制(光照时间8 ∶00~21 ∶00),每天喂食2次。
1.1.2细胞 神经细胞株PC12细胞(大鼠肾上腺嗜铬细胞瘤克隆株)购自中国科学院上海细胞所。PC12细胞常规培养于含有10%马血清、5%胎牛血清、1×青链霉素的RPMI 1640培养基中,置37℃、5% CO2培养箱中培养,隔日更换培养液。
1.1.3药物与试剂 QZXK由山东省中医药研究院课题组提供。氨苯甲异喹(nomifensine,Nom)、1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)购自Sigma公司;MTT细胞增殖试剂盒、线粒体膜电位检测试剂盒、caspase-3活性检测试剂盒购自Invitrogen公司;胎牛血清(fetal bovine serum,FBS)、马血清(horse serum,HS)、RPMI 1640培养基(pH 7.4,高糖)购自Gibco公司。
1.1.4仪器 斑马鱼养殖系统(北京爱生公司);Zebrabox斑马鱼行为分析仪(Viewpoint公司);COIC体视显微镜ZSA302(重庆光学仪器厂);全自动酶标仪(美国Biotek产品);无菌操作台SWCJ2购自苏州Airtech公司;5840R离心机购自Eppendof公司。
1.2方法
1.2.1胚胎准备 斑马鱼的养殖参照Westerfield等[7]的方法。产卵前1 d傍晚选择♀♂成对的斑马鱼成鱼放入产卵缸中,d 2产卵后收集受精卵,纯净水冲洗3次,放入28℃光照培养箱备用。
1.2.2耐受性考察 将受精后4 h的斑马鱼胚胎放在培养皿中,在显微镜下挑选发育正常胚胎于6孔板中,每孔30个。QZXK剂量组别为5、10、25、50 mg·L-1(养殖水配制)和空白对照组(养殖水),每孔给予不同剂量QZXK溶液5 mL,每个剂量组分别设置3个重复孔,给药后置于28℃恒温培养箱中继续控光培养。每24 h更换药液,连续处理3 d。观察斑马鱼幼鱼发育,并记录给药后72 h斑马鱼孵化情况,计算其孵化率。
1.2.3行为学实验 将受精后72 h斑马鱼放在培养皿中,在显微镜下挑选发育正常幼鱼于6孔板中,每孔10尾幼鱼。实验分为QZXK组5、10、25、50 mg·L-1、空白对照组(养殖水)和Nom阳性对照组10.63 mg·L-1,每孔均为5 mL,每个剂量组别设置3个重复孔,置于28℃恒温培养箱中继续控光培养。给药后2 h后加入MPTP,终浓度为200 μmol·L-1,每24 h更换药液,连续处理3 d后,将不同组幼鱼分别放在48孔板中,放入斑马鱼行为学分析系统的暗箱中,使用Zeblab软件分别采集10 min内各组幼鱼的运动轨迹,利用软件导出游行距离和次数,计算每组鱼游行总距离。
1.2.4MTT实验 取对数生长期的PC12细胞,0.25%胰蛋白酶消化,用含100 mg·L-1胎牛血清的DMEM细胞培养基重悬细胞,调整细胞浓度5×107·L-1,每孔100 μL接种于96孔板,置于CO2细胞培养箱中培养24 h后,吸尽培养基,每孔依次加入100 μL对照培养基,并用2 mmol·L-1的MPTP处理2 h后,加入QZXK进行处理(终浓度分别为5、10、25 mg·L-1),每个剂量设置6个复孔。继续培养48 h后,弃培养液,PBS洗涤1次,加入MTT溶液(5 mg·L-1)20 μL,37℃继续孵育4 h后终止培养,弃上清,每孔加入100 μL DMSO,摇床振荡10 min,使结晶充分溶解,用全自动酶标仪在570 nm 波长处测定其吸光度( A570 nm) 值。细胞存活率/%=测定组A570 nm/正常组A570 nm×100%。
1.2.5线粒体膜电位的检测 PC12细胞以5×103个/孔接种于96孔板中,培养24 h后,先用2 mmol·L-1MPTP处理2 h。然后加入QZXK(5、10、25 mg·L-1),作用48 h后,用无血清培养基洗涤培养板1次,然后各孔加入JC-1工作液(终浓度为10 mg·L-1),继续培养15 min,PBS洗涤后,用酶标仪检测,并用荧光显微镜拍照。红色荧光:560 nm激发波长/595 nm发射波长;绿色荧光:485 nm激发波长/535 nm发射波长,以红色/绿色比值进行比较,并根据对照组进行归一化[8]。
1.2.6Caspase-3蛋白活性的检测 PC12细胞以5×104个/孔接种于12孔板中,培养24 h后加药处理,先用2 mmol·L-1的MPTP处理2 h,QZXK(5、10、25 mg·L-1)作用48 h后,收集细胞,加入PBS洗涤细胞2次,然后转移到1.5 mL离心管内,离心并吸除上清。加入细胞裂解液反应5 min,12 000 r·min-1离心5 min。将15 μL裂解液与50 μL反应液加入96孔细胞培养板,室温反应30 min,用酶标仪进行检测490 nm激发波长/520 nm发射波长,并统计活性比值。
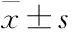
2 结果
2.1QZXK对斑马鱼胚胎孵化发育的影响在本实验剂量范围,对照组斑马鱼生长良好,无病理改变及畸形,躯体及眼睛均覆盖荧光斑点,均匀分布,边界清晰,无缺失;72 hpf所有QZXK组斑马鱼都孵化良好,差异无统计学意义(Tab 1)。
2.2QZXK对MPTP诱导斑马鱼神经损伤作用以72 hpf的斑马鱼幼鱼为实验动物,用浓度200 μmol·L-1的MPTP进行神经损伤造模处理,可以造成斑马鱼幼鱼活动减少,行为受到抑制,用阳性药Nom和不同剂量的QZXK(0、5、10、25、50 mg·L-1)溶液进行处理,结果表明,处理72 h后,阳性药Nom可以明显延长斑马鱼自发运动距离,25、50 mg·L-1的QZXK溶液组的斑马鱼自发运动距离明显比模型组延长(Fig 1、Tab 2)。
Fig 1 Effect of QZXK on behavior trajectory of zebrafish

GroupConcentration/mg·L-1Hatching rate at 72 hpf/%Control-100.00±0.00QZXK596.00±5.7110100.00±0.002598.00±2.805096.67±5.70
Tab 2 The swimming distance of zebrafish treated with QZXK and/or
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
2.3QZXK对MPTP诱导PC12细胞损伤的作用如Fig 2所示,与正常对照组相比,MPTP可以造成神经细胞瘤细胞的凋亡,降低细胞活力;与模型组相比,随着QZXK剂量的增高(5、25 mg·L-1)可以提高MPTP处理组的细胞活力,说明QZXK对PC12细胞具有保护作用。
2.4QZXK对PC细胞膜电位和caspase-3的影响正常细胞的线粒体膜电位可以引起JC-1聚合,呈现红光;当线粒体受损后,膜电位下降,JC-1聚集能力减弱,出现单体形式,呈现绿光,以红色/绿色荧光比率显示细胞线粒体膜电位的损害情况。如Fig 3、4所示,与对照组相比,25 mg·L-1的QZXK引起红色/绿色荧光比率的降低,差异有显著性(P<0.05)。caspase-3活性检测发现,模型组比正常对照组caspase-3活性明显提高;而QZXK处理组与模型组相比,5、25 mg·L-1的QZXK可以抑制caspase-3活性(Fig 5),说明QZXK可以抑制MPTP引起的细胞凋亡。
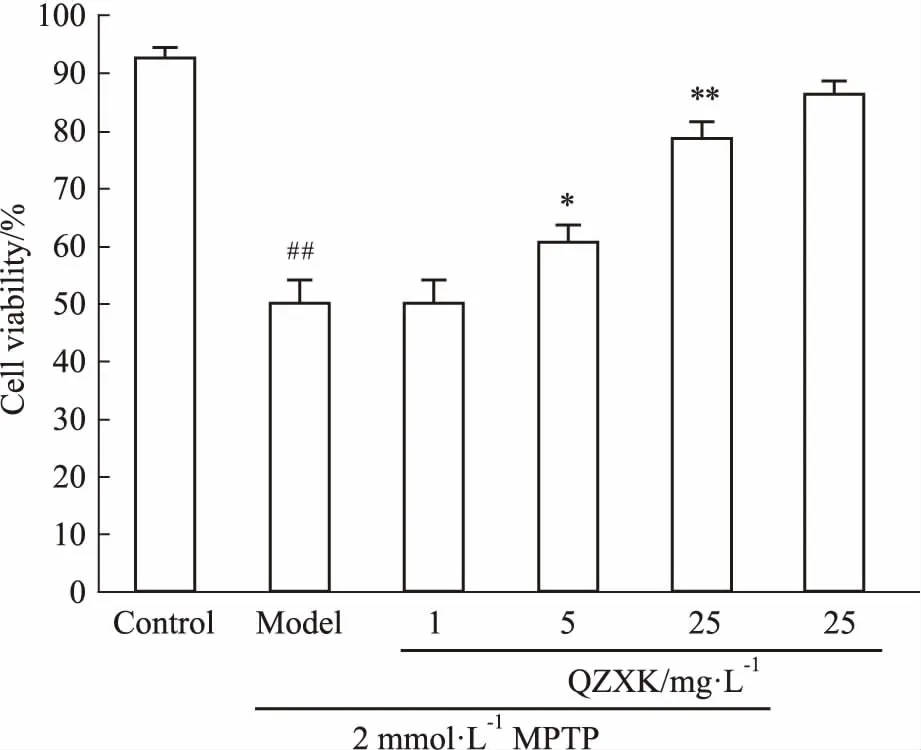
Fig 2 The cell viability of PC12 treated
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
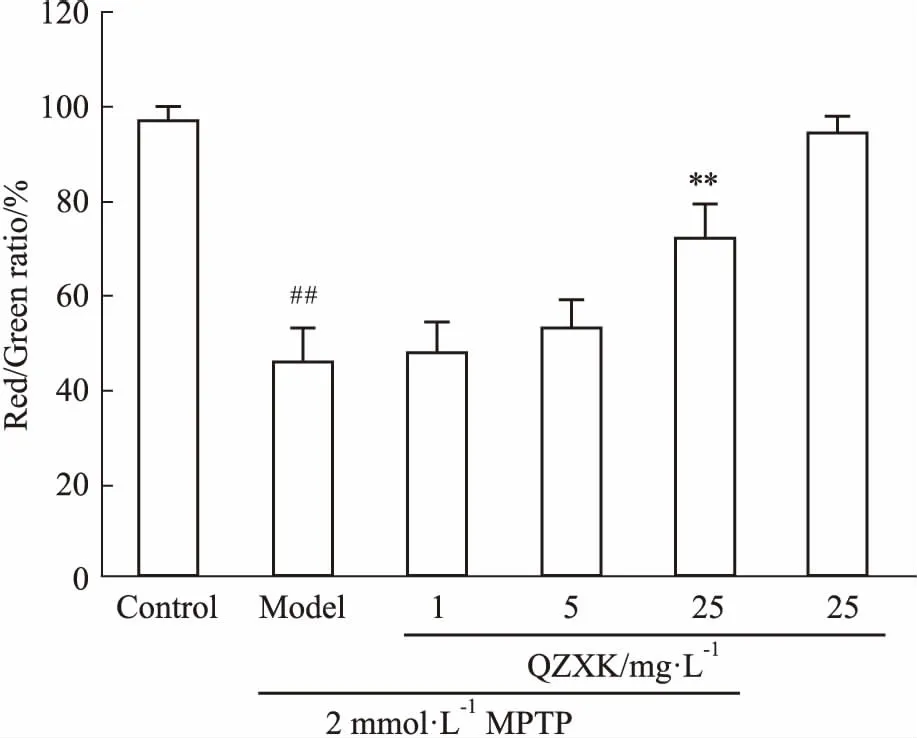
Fig 3 Effect of QZXK on mitochondrial membrane potential of PC12 cells
##P<0.01vscontrol;**P<0.01vsmodel
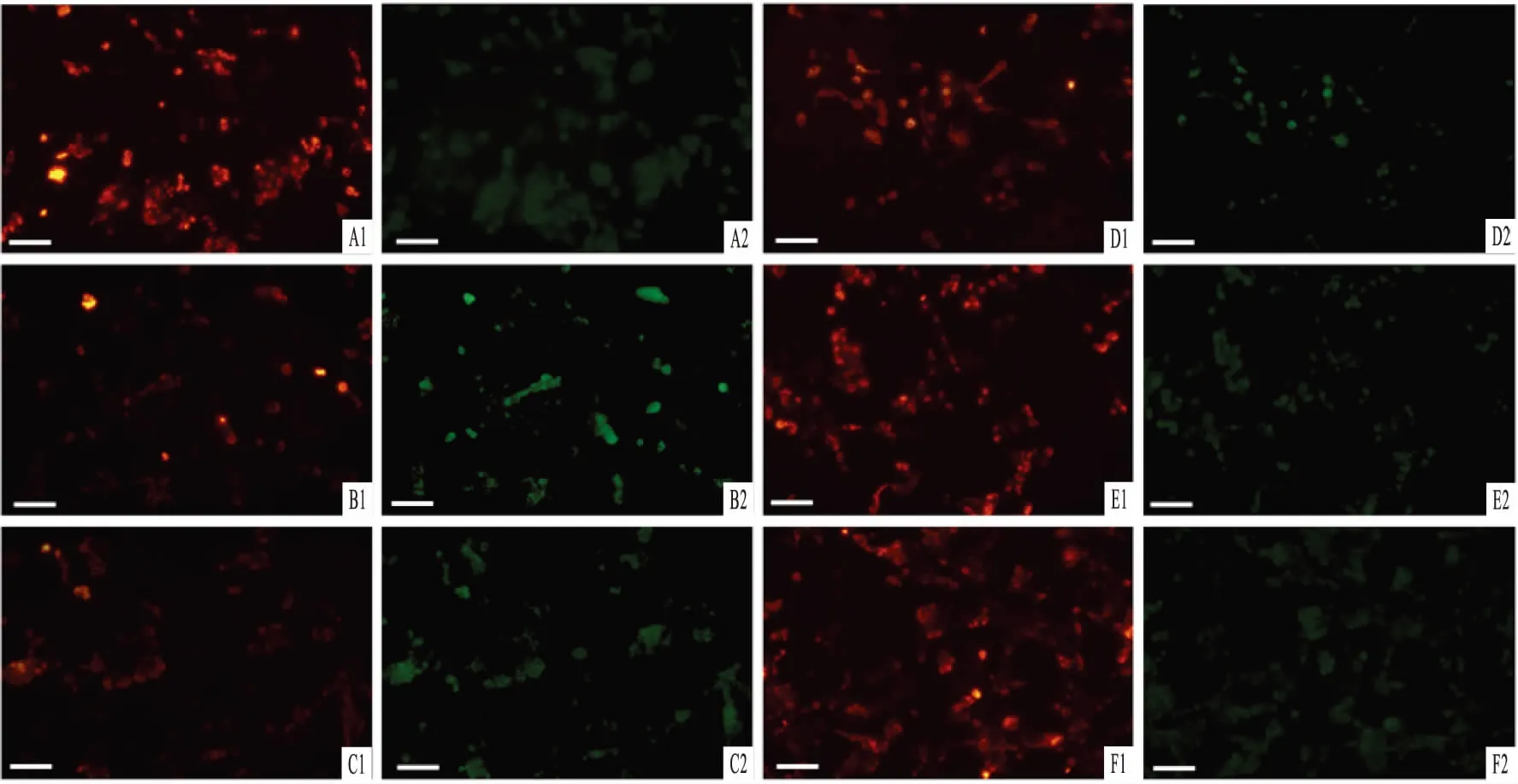
Fig 4 QZXK attenuated MPTP-induced mitochondrial membrane potential loss(scale bar=200 μm)
A1-A2:Control; B1-B2:PC12 cells treated with 2 mmol·L-1MPTP; C1-C2:PC12 cells treated with 2 mmol·L-1MPTP and 2 mg·L-1QZXK; D1-D2:PC12 cells treated with 2 mmol·L-1MPTP and 5mg·L-1QZXK; E1-E2:PC12 cells treated with 2 mmol·L-1MPTP and 25 mg·L-1QZXK; F1-F2:PC12 cells treated with 25 mg·L-1QZXK.
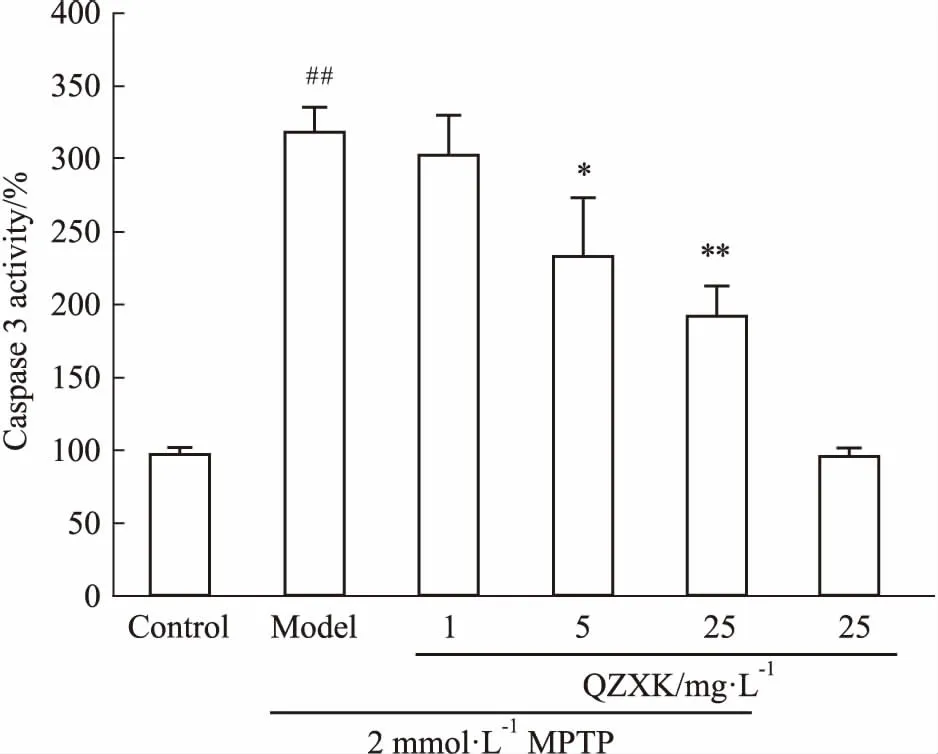
Fig 5 Effect of QZXK on caspase-3 activity
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
3 讨论
斑马鱼的神经系统与哺乳动物类似,具有单胺类神经系统,其体内具有5-羟色胺、去甲肾上腺素等递质系统,也具有多巴胺神经元。斑马鱼与人类都以皮质醇作为应激反应激素[9-10]。同时,斑马鱼饲养经济、发育快速、产卵量大、胚胎透明、易于观察,鉴于斑马鱼这些生理特点,使其成为具有重要的模式生物。目前,斑马鱼已广泛应用于神经发育、神经损伤和行为学等神经科学研究,斑马鱼在药物的筛选和功效评价的研究过程中受到越来越广泛的应用。MPTP是一种具有强亲和毒素的非单纯哌啶类镇定剂药物,高度脂溶,容易通过血脑屏障。MPTP进入脑内,被胶质细胞和5-羟色胺能神经元摄取,在细胞内线粒体单胺氧化酶B(monoamine oxidase B,MAO-B)作用下,转化为具有毒性的1-甲基-4-苯基吡啶(MPP+),然后释放到细胞外,造成神经细胞的凋亡和损坏,从而模拟神经损伤,为神经损伤保护相关药物的筛选和评价提供了一个快速、简便、经济的实验模型[11-12]。本实验用MPTP建立斑马鱼神经损伤模型,发现MPTP对斑马鱼幼鱼神经造成损伤,从而影响斑马鱼的行为学变化,对斑马鱼的运动轨迹产生影响,并降低斑马鱼的运动距离。我们通过给予不同剂量的QZXK,发现随着剂量的提高,QZXK对MPTP造成的神经损伤具有一定的保护作用,可以提高斑马鱼的运动距离,逆转斑马鱼的行为异常。斑马鱼神经损伤模型非常适合药物初期的筛选和评价实验,为其它中药或中药成分的筛选和评价提供了一个快速、准确的实验动物模型线粒体损伤广泛存在于神经细胞损伤过程中,线粒体膜上存在渗透性转化孔,各种有害刺激如缺氧、NO聚集、细胞内Ca2+增加等,都可造成转化孔开放,从而引起膜电位下降甚至消失,呼吸链和氧化磷酸化受到破坏,ATP合成量减少;而生成的氧自由基进一步损伤细胞膜形成脂质过氧化,胞内蛋白质变性和DNA交联,最终造成细胞凋亡[13-14],对线粒体膜电位的保护作用可以引起神经保护作用。本实验发现,QZXK可以抑制MPTP对线粒体膜的损伤,并抑制凋亡相关蛋白caspase-3的活性。QZXK对线粒体具有一定的保护作用,也为QZXK拮抗MPTP对斑马鱼神经损伤提供了分子研究基础。综上,本研究通过药物MPTP建立斑马鱼和PC12细胞神经损伤模型,并利用该模型证明了QZXK在MPTP造成的神经损伤过程中具有保护作用,其作用机制与抑制神经细胞的凋亡,促进细胞活力有关,为QZXK改善认知功能提供了一定的理论和实验基础,也为中药的筛选和评价提供了一个快速、准确的试验方法。
(致谢:本实验于山东省科学院生物研究所药物筛选研究室完成,在此表示衷心感谢!)
[1] Jia J,Zhou A,Wei C,et al. The prevalence of mild cognitive impairment and its etiological subtypes in elderly Chinese[J].AlzheimersDement,2014,10(4):439-47.
[2] Peila R,Rodrigues B L,Launer L J,et al. Type 2 diabetes,ApoE gene,and the risk for dementia and related pathologies:the Honolulu-Asia Aging Study[J].Diabetes,2002,51(4):1256-62.
[3] Sallinen V,Kolehmainen J,Priyadarshini M et al. Dopaminergic cell damage and vulnerability to MPTP in Pink1 knockdown zebrafish[J].NeurobiolDis,2010,40(1):93-101.
[4] Sheehan J P,Palmer P E,Helm G A,et al. MPP+induced apoptotic cell death in SH-SY5Y neuroblastoma cells:an electron microscope study[J].JNeurosciRes,1997,48(3):226-37.
[5] Hung T M,Thu C V,Aat N T,et al. Homoisoflavonoid derivatives from the roots of Ophiopogon japonicus and theirinvitroanti-inflammation activity[J].BioorgMedChemLett,2010,20:2412-6.
[6] Liao L X,Song X M,Wang L C,et al. Highly selective inhibition of IMPDH2 provides the basis of antineuroinflammation therapy[J].PNAS,2017,114(29):E5986-94.
[7] Westerfield M,Wegner J,Jegalian B G,et al. Specific activation of mammalian Hox promoters in mosaic transgenic zebrafish[J].GenesDev,1992,6(4):591-8.
[8] Chong C M,Ma D,Zhao C,et al. Discovery of a novel neuroprotection,BHDPC,which protects against MPP+/MPTP-induced neuronal death in multiple experimental models [J].FreeRadicBiolMed,2015,89:1057-66.
[9] 陈锡强,程丽芳,徐新刚,等.熊果酸对斑马鱼血管生成及斑马鱼移植癌的抑制作用[J].中国药理学通报,2015,31(7):1004-8.
[9] Chen X Q,Cheng L F,Xu X G,et al. Inhibition of ursolic acid on angiogenesis and xenografts in zebrafish (danio rerio)[J].ChinPharmacolBull,2015,31(7):1004-8.
[10] Janhom P,Dharmasaroja P. Neuroprotective effects of alpha-mangostin on MPP+-induced apoptotic cell death in neuroblastoma SH-SY5Y cells[J].JToxicol,2015,2015:919058.
[11] 高贵珍,汪俊博,姜 芳,等. 硫酸化茯苓多糖对MPTP诱导帕金森小鼠的神经保护作用研究[J].中国药理学通报,2015,31(12):1699-703.
[11] Gao G Z,Wang J B,Jiang F,et al. Neuroprotective effect of sulfated pachymaran on the MPTP-induced Parkinson mice[J].ChinPharmacolBull,2015,31(12):1699-703.
[12] 陈锡强,王爱洁,程丽芳,等. 菊葛天麻颗粒与丁螺环酮合并应用对斑马鱼焦虑行为学的影响[J]. 食品与药品,2015,17(6):386-9.
[12] Chen X Q,Wang A J,Cheng L F,et al. Effects of Juge Tianma granules combined with buspirone on anxiety-like behavior of zebrafish[J].FoodDrug,2015,17(6):386-9.
[13] Rose J,Woods J,Woods J,et al. Mitochondrial dysfunction in glial cells:implications for neuronal homeostasis and survival[J].Toxicology,2017,391:109-15.
[14] Tapias V,Hu X,Lu K C,et al. Synthetic alpha-synuclein fibrils cause mitochondrial impairment and selective dopamine neurodegeneration in part via iNOS-mediated nitric oxide production[J].CellMolLifeSci,2017,74(15):2851-74.

