前列腺癌转移动物模型特性的比较学分析
饶玉良,孙祖越
(1. 上海市计划生育科学研究所药理毒理学研究室,中国生育调节药物毒理检测中心,上海 200032;2. 复旦大学药学院,上海 200031;3. 国家人口和计划生育委员会计划生育药具重点实验室,上海 200032)
前列腺癌(prostate cancer, PCa)是老年男性常见的恶性肿瘤,其发病率居欧美国家恶性肿瘤首位,致死率居第2位[1]。我国并非传统意义上的前列腺癌高发区,但随着人民生活方式和饮食结构改变、寿命延长以及检测诊断技术的进步,我国前列腺癌发病率呈逐步上升态势。尽管早期前列腺癌的10年生存率较高,但一旦发生转移,其预后普遍不佳。前列腺癌转移方式有多种,其中,骨转移、淋巴转移等常见。淋巴转移与血液转移密切相关,预示远端器官转移可能且多预后不佳[2-3]。相对于细胞模型,动物模型能更好地再现肿瘤发生、发展进程及肿瘤微环境复杂因素的影响。构建合适的前列腺癌转移模型及科学合理的评价体系,是研究前列腺癌发生、发展、转移机制及药物研究的前提和基础。本文介绍了目前常见的前列腺癌转移模型,从转移模型的操作、评估、应用等方面比较各种模型的特点,以对目前的前列腺癌转移模型有更直观的认知,为前列腺癌转移模型的构建和选择奠定基础。
1 理想的前列腺癌转移模型
理想的前列腺癌转移模型,应能有效地模拟人体前列腺癌发生、发展、转移进程以及病理生理变化过程,应具备以下特征: ①能再现人体内肿瘤发生发展进程中基因型和表型的改变,与人前列腺癌的发生、发展、转移的过程特征相似度高,对激素的反应性与人前列腺癌相似;②模型的相似性、可重复性、可靠性、适用性和可控性、易行性和经济性;③模型检测方法和评价手段易实现,便于及时、动态和持续观察研究。
2 已构建前列腺癌转移模型比较
目前,已构建的前列腺癌转移模型主要包括自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤细胞系移植(cell-line-derived tumor xenograft,CDTX)模型、人源肿瘤组织异种移植(patient-derived tumor xenograft,PDTX)模型以及基因修饰肿瘤模型5类,这5类模型比较见Tab 1。
由于自发性和诱发性肿瘤动物模型运用较少,后文将主要讨论前列腺癌移植型和基因修饰型动物模型及检测评价方法。
3 前列腺癌移植性转移模型
前列腺癌移植性转移模型是将同种或异种的前列腺癌细胞或组织移植到模式动物体内,从而构建前列腺癌移植性转移模型。按移植物是细胞或组织不同,模型可分为肿瘤细胞系移植模型和人源肿瘤组织异种移植模型,详见Tab 1。按移植部位,模型可分为皮下种植、原位移植、肾包膜下移植、血管内接种移植等。免疫功能不全小鼠(裸鼠或严重联合免疫缺陷小鼠)具有免疫缺陷特性,是构建人前列腺癌转移模型的理想载体。将人前列腺癌细胞或者组织通过注射、外科移植等手段接种至免疫缺陷小鼠体内是较常用的造模方法。
3.1按照移植部位不同分类
3.1.1皮下种植 皮下种植是将人肿瘤细胞接种到免疫缺陷动物皮下,是最常用的肿瘤生长模型构建方法。皮下种植成瘤率高、操作简易、对实验室硬件要求不高。用该方法接种,常见的人前列腺癌细胞系都能成瘤,但肿瘤不能转移或转移率较低。
3.1.2原位移植 将人前列腺癌细胞或前列腺癌组织块移植到免疫缺陷动物的前列腺组织内,使之在动物前列腺原位产生肿瘤及形成转移灶。按照建模操作方法不同,原位移植又分为原位注射、外科原位种植、肾包膜下种植和血管内接种等方法,其中,血管内接种又可分为尾静脉注射、左心室注射和腔静脉注射等3种造模方法。
3.2皮下移植和原位移植的比较皮下异种移植的优势为操作简便、成瘤率高,易于控制和重复,缺陷在于传统皮下异种移植模型难以实现肿瘤转移;原位异种移植可明显促进肿瘤转移,且前列腺癌生长的微环境更接近真实情况,可用于研究肿瘤与基质的相互作用[4-5]。具体皮下种植和原位移植方法的比较见Tab 2。

Tab 1 Common metastatic models of prostate cancer

Tab 2 Comparison of transplantable metastatic models of prostate cancer
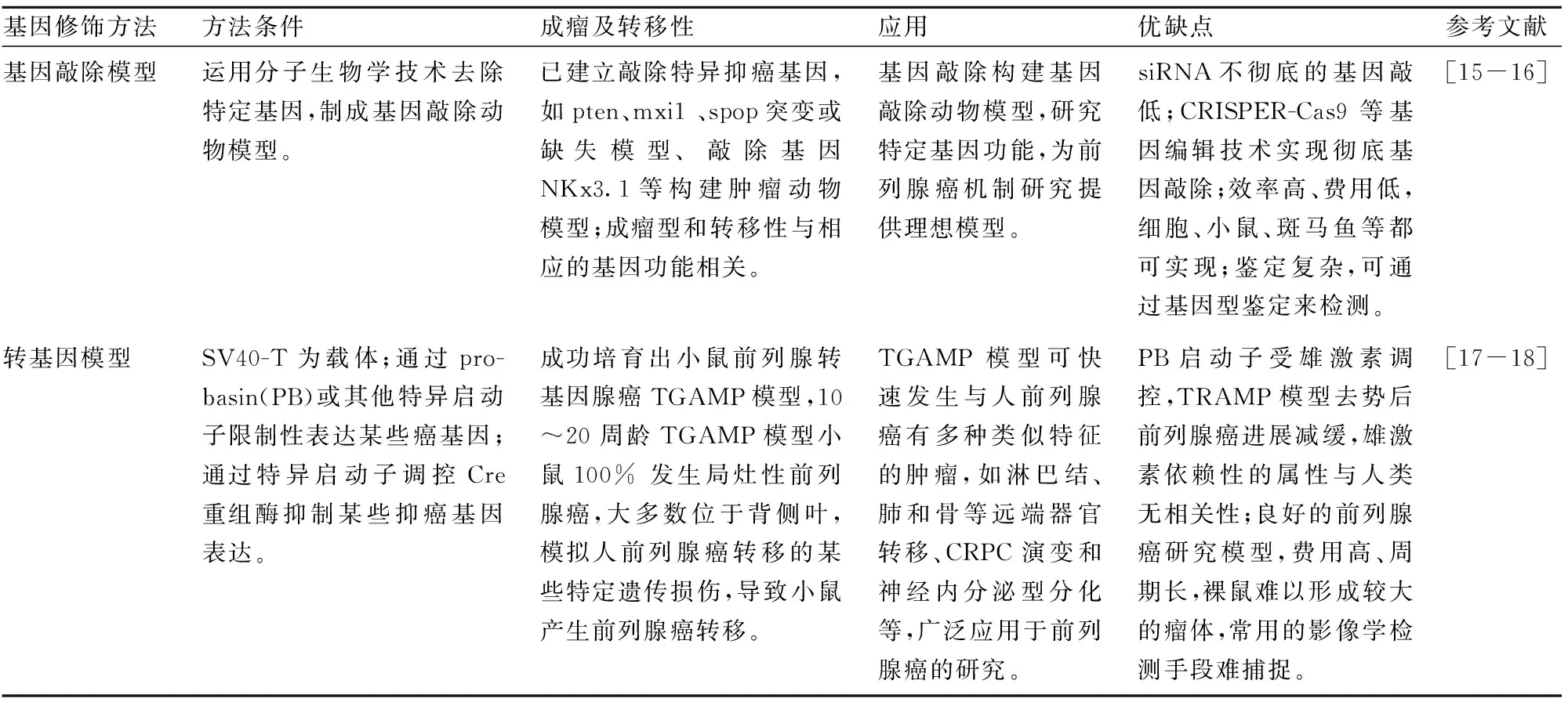
Tab 3 Comparison of gene knockout and transgenic models
4 前列腺癌基因修饰转移模型
前列腺癌转移基因修饰研究模型主要有基因敲除模型和转基因模型两类。
4.1基因敲除模型基因敲除模型是运用分子生物学技术去除特定的基因而制成基因敲除动物模型。目前已经建立了敲除特异性抑癌基因,如 pten、mxi1、spop突变或缺失模型、敲除高度保守的同源框基因 NKx3.1等构建肿瘤动物模型[15-16]。基因敲除可以通过基因型鉴定(genotyping)来检测,即通过设计特定的引物,利用小鼠鼠尾基因组DNA做模版,通过PCR产物大小区分基因修饰(含敲除、敲入、突变等)纯合子、杂合子及野生型。
4.2转基因模型以 SV40-T 为载体构建的转基因小鼠可形成具有较强侵袭能力的前列腺癌,且有神经内分泌等功能,在研究前列腺癌神经内分泌功能方面具有一定的意义。转基因模型为前列腺癌研究提供了良好的模型,但转基因模型费用高、周期长,裸鼠难形成大体积瘤体,难以被常用的影像学检测手段捕捉,更理想的转基因模型还有待进一步研究。
4.3基因敲除模型和转基因模型的比较前列腺癌基因修饰动物模型可以通过基因敲除或者转基因的方式来研究不同的基因对于前列腺癌的发生、发展及转移的机制,为前列腺癌研究提供了良好的工具和模型,但是,两种模型的原理、方法和特点又各有不同,见Tab 3。
5 前列腺癌转移模型的检测评价方法
荧光蛋白标记技术、光学成像技术、超声探测技术CT、ECT骨扫描、磁共振和三维超声微成像等检测方法的运用,实现在体、实时、动态观测及检查前列腺癌模型的瘤体。另外,淋巴结内压力和微环境的酸碱度变化也可成为前列腺癌转移研究的检测指标[19-20]。
荧光蛋白作为活体荧光探针,为研究活细胞提供可视化可能[21],实现在活体荧光成像系统下直接观察肿瘤的生长、进展与转移全过程。Kolostova 等[22]通过外科手术原位种植荧光蛋白标记的前列腺癌,活体成像系统观测肿瘤的耐药性、转移及血管形成过程。通过对前列腺癌细胞进行绿色荧光标记GFP[23]或者荧光素酶luciferase[24]标记,也有利于后期的实时检测,尤其有利于前列腺癌转移的研究过程。裸鼠前列腺原位模型体积小,在不损伤实质脏器的前提下,超声检测可准确获得深部瘤体体积。基于犬类模型的前列腺核磁共振前哨淋巴结的淋巴细胞成像技术有利于临床应用,例如在手术前前列腺癌患者的前哨淋巴结成像[25]。
Miura等[19]发现,在肿瘤细胞尚未完全扩散的早期阶段,腋窝淋巴结压力增加适当,提示淋巴结内压力升高可能成为前列腺癌淋巴结转移的早期诊断参数。Astigiano等[20]发现,肿瘤微环境呈酸性,碱性化的食物可延缓前列腺癌转基因小鼠(transgenic adenocarcinoma of the mouse prostate,TRAMP)中肿瘤进展和转移过程,对前列腺的预防、检测和治疗有积极意义。
6 结语
前列腺癌进展影响因素众多,构建再现人体前列腺癌发生、进展、转移过程的前列腺癌模型对于前列腺癌的发生、转移机制研究以及前列腺癌的预防、诊断、药物研究和治疗具有重大意义。但现有的前列腺癌动物模型还不够理想,因此,前列腺癌模型研究依旧任重道远。综述前文,可以从前列腺癌细胞系的优化筛选、模型构建方法、优化检测评价方法和手段等角度着手,尝试构建能够模拟体内前列腺癌起始、发生、进展、转移的模型,实现在体、实时、动态、定量监测的前列腺癌转移动物模型,为前列腺癌的机制研究、药物研究和防治方法提供理想的研究模型。
[1] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2017[J].CACancerJClin, 2017,67(1): 7-30.
[2] Servais E L, Colovos C, Bograd A J, et al. Animal models and molecular imaging tools to investigate lymph node metastases[J].JMolMed(Berl), 2011,89(8):753-69.
[3] Sun H, Zhang T, Gui B, et al. Establishment of prostate cancer in cynomolgus macaque animal model by orthotropic inoculation of PC-3 cancer cells in situ[J].EurJOncol, 2012,17(4):189-203.
[4] Sun F, Baez-Diaz C, Sanchez-Margallo F M. Canine prostate models in preclinical studies of minimally invasive interventions: part I, canine prostate anatomy and prostate cancer models[J].TranslAndrolUrol,2017,6(3):538-46.
[5] Parajuli K R, Zhang Q, Liu S, et al. Aminomethylphosphonic acid inhibits growth and metastasis of human prostate cancer in an orthotopic xenograft mouse model[J].Oncotarget,2016,7(9):10616-26.
[6] Thalmann G N, Sikes R A, Chang S M, et al. Suramin-induced decrease in prostate-specific antigen expression with no effect on tumor growth in the LNCaP model of human prostate cancer[J].JNatlCancerInst, 1996,88(12):794-801.
[7] 田原僮, 曾昭毅, 陈伟伟, 等. 聚肌胞对小鼠前列腺癌内微血管的影响[J]. 中国药理学通报, 2009,25(11):1449-52.
[7] Tian Y T, Zeng Z Y, Chen W W,et al. The effect of polymyocyst on microvessels in prostate cancer in mice[J].ChinPharmacolBull,2009,25(11):1449-52.
[8] Kovar J L, Johnson M A, Volcheck W M, et al. Hyaluronidase expression induces prostate tumor metastasis in an orthotopic mouse model[J].AmJPathol,2006,169(4):1415-26.
[9] Chu J H, Sun Z Y, Meng X L, et al. Differential metastasis-associated gene analysis of prostate carcinoma cells derived from primary tumor and spontaneous lymphatic metastasis in nude mice with orthotopic implantation of PC-3M cells[J].CancerLett,2006,233(1):79-88.
[10] 储剑虹, 吴建辉, 朱 焰, 等. 利用PC-3M-1E8细胞亚系建立人前列腺癌淋巴道转移模型[J]. 中国药理学与毒理学杂志, 2005,19(2):140-5.
[10] Chu J H,WU J H,Zhu Y, et al. The lymphatic channel metastasis model of prostate cancer was established using pc-3m -1E8 cell[J].ChinJPharmacolToxicol,2005,19(2):140-5.
[11] Van Weerden W M, Romijn J C. Use of nude mouse xenograft models in prostate cancer research[J].Prostate,2000,43(4):263-71.
[12] Wang Y, Revelo M P, Sudilovsky D, et al. Development and characterization of efficient xenograft models for benign and malignant human prostate tissue[J].Prostate,2005,64(2):149-59.
[13] Angelucci A, Gravina G L, Rucci N, et al. Evaluation of metastatic potential in prostate carcinoma: aninvivomodel[J].IntJOncol,2004,25(6):1713-20.
[14] Tennant T R, Kim H, Sokoloff M, et al. The Dunning model[J].Prostate, 2000,43(4):295-302.
[15] Korsten H, Ziel-Van Der Made A, Ma X, et al. Accumulating progenitor cells in the luminal epithelial cell layer are candidate tumor initiating cells in a Pten knockout mouse prostate cancer model[J].PLoSOne, 2009,4(5):e5662.
[16] Squire J A, Park P C, Yoshimoto M, et al. Prostate cancer as a model system for genetic diversity in tumors[J].AdvCancerRes,2011,112:183-216.
[17] Chiaverotti T, Couto S S, Donjacour A, et al. Dissociation of epithelial and neuroendocrine carcinoma lineages in the transgenic adenocarcinoma of mouse prostate model of prostate cancer[J].AmJPathol, 2008,172(1):236-46.
[18] Pienta K J, Abate-Shen C, Agus D B, et al. The current state of preclinical prostate cancer animal models[J].Prostate,2008,68(6):629-39.
[19] Miura Y, Mikada M, Ouchi T, et al. Early diagnosis of lymph node metastasis: Importance of intranodal pressures[J].CancerSci,2016,107(3):224-32.
[20] Astigiano S, Puglisi A, Mastracci L, et al. Systemic alkalinisation delays prostate cancer cell progression in TRAMP mice[J].JEnzymeInhibMedChem, 2017,32(1):363-8.
[21] Yamamoto N, Tsuchiya H, Hoffman R M. Tumor imaging with multicolor fluorescent protein expression[J].IntJClinOncol, 2011,16(2):84-91.
[22] Kolostova K, Pinterova D, Hoffman R M, et al. Circulating human prostate cancer cells from an orthotopic mouse model rapidly captured by immunomagnetic beads and imaged by GFP expression[J].AnticancerRes, 2011,31(5):1535-9.
[23] Zhang Y, Wang X, Hoffman R M, et al. Real time metastatic route tracking of orthotopic PC-3-GFP human prostate cancer using intravital imaging[J].JCellBiochem, 2016,117(4):1027-32.
[24] Hafeez B B, Zhong W, Fischer J W, et al. Plumbagin, a medicinal plant (Plumbago zeylanica)-derived 1,4-naphthoquinone, inhibits growth and metastasis of human prostate cancer PC-3M-luciferase cells in an orthotopic xenograft mouse model[J].MolOncol, 2013,7(3):428-39.
[25] Turkbey B, Hoyt R F Jr, Agarwal H K, et al. Magnetic resonance sentinel lymph node imaging of the prostate with gadofosveset trisodium-albumin: preliminary results in a canine model[J].AcadRadiol, 2015,22(5):646-52.

