运动对肥胖大鼠胰岛素抵抗的影响*
刘世强,张 勇,完建永,孙庆艳,华田苗
(安徽师范大学生命科学学院,芜湖241000)
肥胖尤其是向心性肥胖是形成胰岛素抵抗的主要原因,胰岛素抵抗是2型糖尿病等多种代谢疾病的发病基础,90%以上的肥胖患者出现不同程度的胰岛素抵抗。据WHO报道,预计到2025年全世界约有3亿人患2型糖尿病[1]。半乳凝素-3(galectin-3,Gal-3)是连接炎症与胰岛素抵抗之间的关键物质,研究表明Gal-3与胰岛素受体结合而抑制其下游信号通路。运动能改善胰岛素抵抗状态,但其机制尚不清楚。本研究以高脂膳食饲养大鼠,构建肥胖诱导的胰岛素抵抗模型。对胰岛素抵抗大鼠进行急、慢性运动干预,观察运动干预对大鼠葡萄糖-胰岛素指数及血液中Gal-3含量的影响,为进一步研究运动改善胰岛素抵抗的分子机制提供新思路。
1 材料与方法
1.1 实验动物
7周龄的清洁级健康SD雄性大鼠100只(购自浙江省实验动物中心),大鼠适应性饲养一周,称量体重(250.3±24.2)g。饲养条件为:自由饮食、饮水,温度26~28℃,相对湿度(55±4)%,明暗周期12 h:12 h,每周定时称量体重并记录大鼠的生长状况。
1.2 胰岛素抵抗大鼠模型的建立
大鼠随机分为普通膳食安静组(control,CON组,n=10),喂食普通饲料;高脂膳食组(high fat diet,HFD组,n=90),喂食高脂饲料。高脂饲料系在普通饲料的基础上添加16.9%猪油、14%糖、10.2%酪蛋白、2.2%麦芽糊精、2.1%盐、微量元素和维生素等。饲料由南京市江宁区龙泉饲料经营部提供。HFD组大鼠在喂食8周后,选取其体重上游1/3的大鼠(n=30)作为膳食诱导肥胖大鼠进行后续研究;下游1/3的大鼠为肥胖抵抗大鼠,弃之不用;中间1/3的大鼠亦弃之不用。CON组和HFD组大鼠进行第一次口服糖耐量实验和胰岛素释放实验,根据葡萄糖-胰岛素指数判定胰岛素抵抗模型的建立,如表1所示。
Tab.1 Body weight and glucose-insulin index when building the model of insulin resistance rats(,n=10)

Tab.1 Body weight and glucose-insulin index when building the model of insulin resistance rats(,n=10)
CON:Control;HFD:High-fat diet**P<0.01 vs control group
Group Weight(g) AUCg×AUCi(×108)CON 513.6±22.1 4.08±1.09 HFD 603.6±32.1** 8.59±1.25**
1.3 胰岛素抵抗大鼠的运动干预
将建模成功的HFD组30只大鼠随机分为3组(n=10):(1)高脂膳食安静组(HFD-sedentary,HFD-SED):高脂饲料喂养,安静不运动;(2)高脂膳食慢性运动组(HFD-chronic exercise,HFD-CE):高脂饲料喂养,并进行每天1 h、每周5次的负重5%体重的游泳运动;(3)高脂膳食急性运动组(HFD-acute exercise,HFD-AE)。HFD组继续高脂膳食喂养8周,CON组继续喂食普通饲料8周,安静不运动。8周后,HFD-AE组先进行3 h的急性游泳运动,休息45min,再运动3 h。
1.4 口服糖耐量和胰岛素释放实验
运动干预结束后,各组进行第二次口服糖耐量和胰岛素释放实验。大鼠空腹12 h,眼眶后静脉丛取血,以罗氏血糖仪和试纸测定即时空腹血糖,同时留取空腹血液0.5 ml。用50%的葡萄糖(2 g/kg体重)灌胃,于糖负荷后 15、30、90、120 min测定血糖值,并保存每一时间点的血液0.5 ml。将留取的血液室温静置10~20 min,3 000 r/min离心 5 min,分离血清,-20℃保存。绘制葡萄糖曲线,各点的血糖值与时间的乘积为葡萄糖曲线下面积(area under the curve of glucose,AUCg)。以武汉华美CUSABIO公司提供的大鼠胰岛素(Ins)ELISA试剂盒,测定各时间点的血清胰岛素值并绘制胰岛素曲线,各点的胰岛素值与时间的乘积为胰岛素曲线下面积(area under the curve of insulin,AUCi)。计算葡萄糖-胰岛素指数(glucose-insulin index):AUCg×AUCi。
1.5 血样采集
在急性运动结束16 h(含空腹12 h)以及慢性运动结束48 h(含空腹 12 h)后,以 10%水合氯醛(400mg/kg体重)麻醉大鼠,腹腔静脉取血,用于测定Gal-3含量。
1.6 Gal-3的测定
采用 Sigma公司提供的大鼠 Gal-3 ELISA(enzyme-linked immunosorbent assay)试剂盒,测定大鼠血液中Gal-3含量。
1.7 统计方法
所有结果均以均数±标准差()表示。采用 SPSS 13.0统计软件进行数据处理、统计分析,多组间差异比较采用单因素方差分析(one-way ANOVA)中的LSD进行检验。
2 结果
2.1 运动干预后各组大鼠体重和葡萄糖-胰岛素指数的变化
如表2所示:HFD-SED组大鼠体重大于CON组,差异显著(P<0.01);HFD-CE组明显小于 HFD-SED组(P<0.01),与对照组无明显差异;HFD-AE组大于CON组,差异显著(P<0.01),而与HFD-SED组无统计学差异。HFD-SED组大鼠葡萄糖-胰岛素指数大于CON组,差异显著(P<0.01),HFDCE组明显小于HFD-SED组(P<0.01),与 CON组无明显差异;HFD-AE组小于 HFD-SED组,差异显著(P<0.01),但仍明显大于 CON组(P<0.05)。

Tab.2 Effects of chronic and acute exercise on body weight and glucose-insulin index of rats
2.2 运动干预对Gal-3含量的影响
如图1所示:HFD-SED组大鼠血清Gal-3含量为(2.74±0.52)ng/ml,明显高于 CON组(1.10±0.18)ng/ml(P<0.01),HFD-CE组和HFD-AE组大鼠血清Gal-3含量分别为(1.42±0.73)ng/ml和(1.12±0.29)ng/ml,明显低于 HFD-SED组(P<0.01),与 CON组无明显统计学差异。
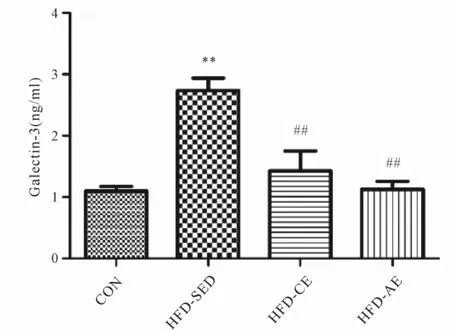
Fig.1 Effectsof chronic and acute exercise on expression ofGal-3(,n=10)
3 讨论
高脂膳食饲养可建立肥胖诱导的胰岛素抵抗动物模型。在胰岛素抵抗动物模型中,血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、游离脂肪酸(free fatty acid,FFA)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)等显著升高[2]。通常大鼠在高脂膳食饲养2~3周后,其肌肉组织就会产生胰岛素抵抗[3]。本研究参照Lauterio等[4]的方法,以高脂饲料喂养大鼠8周,选取体重上游1/3的大鼠作为肥胖大鼠,其体重显著大于CON组,说明建立了肥胖模型。葡萄糖-胰岛素指数为葡萄糖曲线下面积和胰岛素曲线下面积的乘积,数值越大表明胰岛素抵抗程度越强。实验结果表明,HFD组大鼠的葡萄糖-胰岛素指数显著大于CON组,表明成功建立了肥胖诱导的胰岛素抵抗模型。
运动能够提高机体的糖、脂代谢水平,提高机体的胰岛素敏感性,预防胰岛素抵抗的发生[5]。慢性运动和急性运动对胰岛素抵抗都有干预效应。研究表明,慢性和急性运动均能作用于胰岛素的信号通路,降低胰岛素受体底物1(insulin receptor substrate 1,IRS-1)、c-Jun氨基末端激酶 (c-Jun NH2-terminal kinase,JNK)的磷酸化表达,降低大鼠血液中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量[6,7]。本实验中,8周的慢性游泳运动干预显著降低胰岛素抵抗大鼠的体重和葡萄糖-胰岛素指数;6 h的急性运动虽然对大鼠体重无明显影响,但显著降低葡萄糖-胰岛素指数。
半乳凝素-3又称为巨噬细胞表面抗原-2(macrophage sur-face antigen-2,mac-2),是一种由巨噬细胞分泌的分子量约为30 kD的凝集素,其家族共有14种成员,主要参与细胞的生长、分化、粘附、炎症、免疫应答、凋亡、心血管疾病形成等过程,以及调节免疫T细胞功能。在胰岛素抵抗状态下,机体血液中Gal-3含量显著上升。Yilmaz等[8]研究了前糖尿病患者、糖尿病病人和正常个体血液中的Gal-3含量,发现糖尿病患者组中Gal-3含量最高,其次是前糖尿病组,而正常组最少。肥胖和胰岛素抵抗是多囊性卵巢综合征(PCOS)的主要形成原因,患PCOS女性血液中Gal-3含量显著高于正常组,且Gal-3含量与胰岛素抵抗指数呈正相关[9]。给小鼠注射氯膦酸盐(可特异性抑制巨噬细胞分泌Gal-3),发现其可抑制Gal-3的表达,可以显著改善肥胖小鼠的胰岛素敏感性[10]。
Gal-3是连接炎症和糖尿病等疾病的一个关键性蛋白。在肥胖状态下,机体炎性因子TNF-α增多会导致巨噬细胞分泌Gal-3。一方面,Gal-3通过正反馈调节使巨噬细胞继续分泌Gal-3;另一方面,Gal-3直接与胰岛素受体结合,抑制胰岛素受体活性,从而抑制胰岛素信号通路下游的糖原合成酶激酶 3(glycogen synthase kinase-3,GSK-3)和葡萄糖转运体 4(glucose transporter 4,Glut-4)的表达[11]。运动可能对机体 Gal-3含量有干预效应。Fernandes-silva等提出,运动能够显著增加心力衰竭患者的最大摄氧量(VO2max),同时Gal-3含量会降至平均值以下[12]。目前尚未见到在胰岛素抵抗状态下,运动对Gal-3的干预效应研究。本研究中,两种运动结束后的取材时间不同,避免了运动后的急性效应,结果慢性和急性运动组大鼠血液中Gal-3含量与CON组差异不显著,且其Gal-3含量明显低于HFD-SED组,说明急性和慢性游泳运动对胰岛素抵抗大鼠的Gal-3含量均有干预作用。现有研究表明,急性运动的干预作用维持时间较短,一般少于24 h,而慢性运动的干预作用时间可延长到72~120 h[13],且急性运动对胰岛素抵抗大鼠的体重无明显减低作用。
综合比较急、慢性运动的干预作用,慢性运动对肥胖诱导的胰岛素抵抗作用干预效果更好。所以建议临床上采用长期的、规律的慢性有氧运动,对肥胖、胰岛素抵抗等代谢疾病进行干预。
[1] Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[2] 李艳辉,衣雪洁.有氧运动对2型糖尿病大鼠骨骼肌ERK1/2活性的影响[J].中国应用生理学杂志,2017,33(1):33-37.
[3] Castorena CM,Arias EB,Sharma N,etal.Postexercise improvement in insulin-stimulated glucose uptake occurs concomitant with greater AS160 phosphorylation in muscle from normal and insulin-resistant rats[J].Diabetes,2014,63(7):2297-2308.
[4] Lauterio TJ,DaviesMJ,DeAngeloM,etal.Neuropeptide Y expression and endogenous leptin concentrations in a dietary model of obesity[J].Obes Res,1999,7(5):498-505.
[5] 周慧敏,李博雅,朱 欢,等.健步走运动对中老年2型糖尿病患者的作用[J].中国应用生理学杂志,2015,31(3):243-244,248.
[6] Oliveira AG,Carvalho BM,Tobar N,et al.Physical exercise reduces circulating lipopolysaccharide and TLR4 activation and improves insulin signaling in tissues of DIO rats[J].Diabetes,2011,60(3):784-796.
[7] 孙庆艳,李苗苗,李古州,等.运动和低脂膳食对胰岛素抵抗大鼠肿瘤坏死因子α表达的影响[J].中国应用生理学杂志,2014,30(2):180-183.
[8] Yilmaz H,Cakmak M,Inan O,et al.Increased levels of galectin-3 were associated with prediabetes and diabetes:new risk factor[J]?JEndocrinol Invest,2015,38(5):527-533.
[9] Yilmaz H,Celik HT,Ozdemir O,et al.Serum galectin-3 levels in women with PCOS[J].J Endocrinol Invest,2014,37(2):181-187.
[10]Li P,Liu S,Lu M,et al.Hematopoietic-derived galectin-3 causes cellular and systemic insulin resistance[J].Cell,2016,167(4):973-984.
[11] Siwicki M,Engblom C,Pittet MJ.Gal3 links inflammation and insulin resistance[J].Cell Metab,2016,24(5):655-656.
[12]Fernandes-Silva MM,GuimaraesGV,Rigaud VO,etal.Inflammatory biomarkers and effectof exercise on functional capacity in patients with heart failure:Insights from a randomized clinical trial[J].Eur J Prev Cardiol,2017,24(8):808-817.
[13]LIoyd JW,Evans KA,Zerfass KM,et al.Effect of an acute bout of aerobic exercise on chemerin levels in obese adults[J].DiabetesMetab Syndr,2016,10(1):37-42.

