肿瘤酸性微环境促进肾癌细胞株769-P体外侵袭及其lncRNA表达谱分析
殷喜丰,孙 浩,陈兵海
(江苏大学附属医院泌尿外科,江苏镇江 212000)
肾细胞癌是泌尿系统常见的恶性疾病,2012年全球新发肾癌338 000例,死亡143 000例,分别占恶性肿瘤发病率及死亡率的2.4%和1.7%,居恶性肿瘤发病率及死亡率第14位和第16位,且呈逐年上升趋势[1]。肾细胞癌死亡率相对较高,这一特性可能与其临床特点密切相关。早期肾细胞癌患者通常缺乏典型临床症状,导致病程发展隐匿,约有30%的患者因病理性骨折等转移症状初诊,40%~50%的患者在确诊肾细胞癌时已发生转移[2]。在导致临床肿瘤患者死亡的众多影响因素中,肿瘤转移是主因之一。恶性肿瘤的侵袭转移不单与其自身的遗传特性有关,更受其所处微环境影响。后者牵涉到恶性肿瘤细胞与其胞外酸性微环境等因素间的彼此作用[3]。研究显示,肿瘤侵袭转移的生理生化过程可概括为:①恶性肿瘤细胞粘附细胞外基质(extracellular matrix,ECM);②分泌酸及酸相关蛋白水解酶降解重塑ECM,向周围组织侵袭;③通过加强自身运动性,向周围组织迁移[4]。由此可见,癌细胞的侵袭作用有助于其向正常组织迁移,这一步骤是恶性肿瘤细胞转移过程中的重要环节,而肿瘤胞外酸性微环境恰恰与其有着密切的联系[3]。
截至目前,肾癌发生侵袭转移的机制尚无定论,且酸性微环境在肾癌侵袭转移过程中的作用也鲜有报道。因此,本研究将通过使用pH6.6的酸性培养基体外模拟肿瘤酸性微环境并培养肾癌细胞769-P,观察肿瘤胞外酸性微环境对肾癌细胞769-P侵袭性的调节作用,并分析其长链非编码RNA(Long non-coding RNA,lncRNA)表达谱变化。
1 材料与方法
1.1材料肾癌769-P细胞株购自生工上海细胞库;荧光定量PCR相关引物均购自生工合成部;胎牛血清购自美国BI公司(Cat No.BISH0930);细胞冻存培养基(RPMI)及磷酸盐缓冲液(phosphate buffer saline,PBS)均购自美国HyClone公司(Cat No.SH30809.01、Cat No.SH30256.01);青链霉素混合液、L-谷氨酰胺、胰酶均购自江苏凯基生物技术有限公司(Cat No.KGY0023、Cat No.KGY0043、Cat No.KGY0012);哌嗪-1,4-二乙磺酸(PIPES)和4-羟乙基哌嗪乙磺酸(HEPES)均购自南京奥多福尼生物技术有限公司;cDNA逆转录试剂盒购自TaKaRa公司(Cat No.RR037A);AceQ qPCR SYBER Green Master Mix、RNA快速提取试剂盒均购自南京诺唯赞生物技术有限公司(Cat No.Q111-02、Cat No.RA105-01);transwell小室(内径6.5 mm,孔径8.0 μm,已铺Matrigel基质胶)购自美国Coring公司(Cat No.354480)。
1.2方法
1.2.1培养液制备方法 每7.2 mL含10% 胎牛血清(Fetal Bovine Serum,FBS)的RPMI全营养培养基添加0.5 mol/L的PIPES和0.5 mol/L的HEPES各400 μL,配合使用NaOH、HCl调节pH值至7.4或6.6,充分混匀后过滤备用[5]。
1.2.2细胞培养方法及实验分组 将细胞用含10% FBS的RPMI全营养培养液(未调整pH值),于37 ℃、CO2浓度为5%的培养箱中培养。将对数生长期细胞传代至6孔细胞培养板,编号1~6号,加入含10% FBS的RPMI全营养培养液2 mL。隔夜培养至细胞密度均为60%左右,将各孔培养液换成含10% FBS的RPMI全营养培养液(pH值为7.4)1 mL,以此换液时间点为0点,向2~6号孔按时间顺序换液加入含10% FBS的RPMI全营养培养液(pH值为6.6)1 mL,形成pH6.6-RPMI培养液作用时间梯度为0、0.5、1、2、4、8 h的6组细胞。
1.2.3RNA提取、cDNA合成及实时荧光定量聚合酶链反应(qRT-PCR)实验方法 按RNA快速抽提试剂盒说明书步骤提取各组细胞RNA,使用TaKaRa反转录盒将RNA反转录合成cDNA。将上述所得cDNA用于FQ-PCR检测。根据AceQ qPCR SYBER Green Master Mix试剂盒说明书加入各组分形成20μL体系,标准两步法行FQ-PCR。每组GAPDH、Snail及E-cadherin各设3个复孔。用-ΔΔCt值表示Snail及E-cadherin基因相对表达倍数[6],实验重复3次。
1.2.4transwell肿瘤细胞体外侵袭实验 将对照组/实验组肾癌细胞于1 mL pH 7.4、pH6.6-RPMI全营养培养液中作用4 h,换液为无血清、无双抗、无谷氨酰胺的“三无”RPMI培养基1 mL饥饿2 h。制备对照组及实验组侵袭小室(上室已铺胶),下室各加入含10%胎牛血清的RPMI培养液600 μL。取上述对照组孔或实验组孔中指数增殖期细胞,重悬于“三无”RPMI培养液,多次计数调整细胞浓度,在对应组别的上室中加入含2×104个细胞的无血清细胞悬液200 μL。温箱培养24 h,弃transwell侵袭小室套件内液体,用棉球擦除上室内残留细胞及基质胶,经冰预冷甲醇固定、0.05%结晶紫着色、PBS清洗染液,光学显微镜下拍照,随机观测5个视野(×10)并进行计数。将小室套件移至全新的12孔培养板,加入10%乙酸1 mL,室温静置30 min,待结晶紫全部溶解,移液器吹匀,将对照组及实验组溶解有结晶紫的乙酸溶液移至96细胞培养板孔,每组别各设立5个复孔,使用酶标仪测算各孔560 nm波长处吸光度值并记录[7]。实验重复3次。
1.2.5lncRNA表达谱芯片 使用pH7.4-RPMI或pH6.6-RPMI培养液培养肾癌细胞4 h,抽提实验组或对照组细胞RNA,反转录得到cDNA行lncRNA表达谱检测。根据qPCR试剂说明书加入各成分及cDNA(待检测的lncRNA及内参的前后引物预混液除外),分别向96孔中加入90种lncRNA及6种内参的前后引物预混液形成20 μL体系,标准两步法行FQ-PCR,检测lncRNA表达[8]。实验重复3次。相关数据经处理后使用Morpheus网页软件(https://software.broadinstitute.org/morpheus/)绘制热图。

2 结 果
2.1肿瘤胞外酸性微环境上调肾癌细胞Snail基因表达水平,其下游E-cadherin基因表达降低,两者呈负相关。在FQ-PCR实验中,各组的内参GAPDH、Snail及E-cadherin基因均设立3个复孔,实验重复3次。结果统计显示,pH6.6-RPMI培养液培养0、0.5、1、2、4、8 h肾癌细胞769-P Snail基因的相对表达倍数分别为(1±0)、(0.900±0.001)、(0.931±0.303)、(1.354±0.331)、(1.569±0.010)、(1.084±0.363),其中pH6.6-RPMI培养液培养4 h组,其肾癌细胞769-P Snail基因表达较pH6.6-RPMI培养液培养培养0 h组即pH7.4-RPMI培养液培养4 h组明显增高,下游E-cadherin基因表达相对倍数为(1±0)、(0.532±0.131),呈下降趋势,两者负相关,差异有统计学意义(P<0.05,图1)。
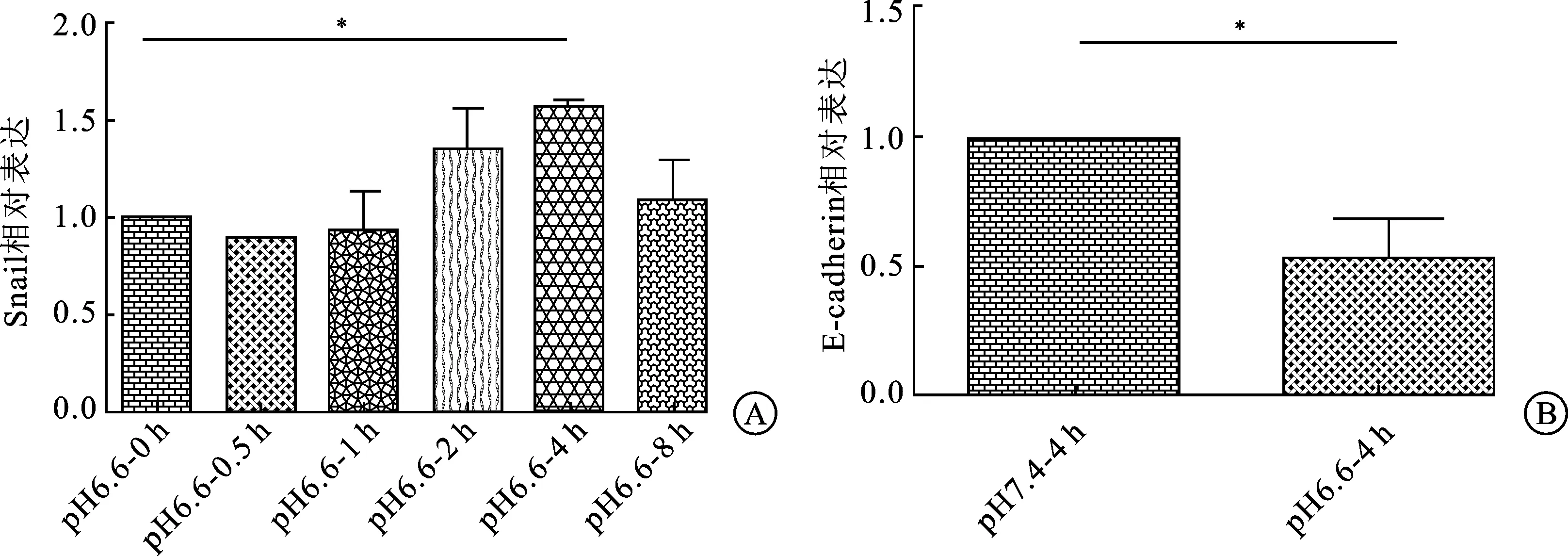
图1酸性微环境肾癌细胞Snail及E-cadherin的表达
A:pH6.6-RPMI培养基培养时间梯度Snail基因表达情况;B:pH6.6-RPMI培养基培养4 h E-cadherin基因表达情况;与pH6.6培养液培养0 h组即pH7.4培养液培养4 h组比较,*P<0.05。
2.2肿瘤胞外酸性微环境提高肾癌细胞的侵袭能力在transwell细胞体外侵袭实验中,pH6.6-RPMI/pH7.4-RPMI培养液培养4 h组经0.05%结晶紫染色,镜下拍照随机5个视野计数,10%乙酸脱色后,取100 μL/孔至96孔板,每组均设置5个复孔,实验重复3次。结果统计显示,pH6.6-RPMI/pH7.4-RPMI培养液培养4 h组侵袭细胞数分别为(398.800±20.067)、(212.400±25.016),OD 560 nm处吸光度值分别为(0.230±0.039)、(0.121±0.019),差异有统计学意义(P<0.05,图2)。
2.3肿瘤胞外酸性微环境引起肾癌细胞lncRNA表达谱改变在lncRNA表达谱芯片筛选实验中,pH6.6-RPMI、pH7.4-RPMI培养液培养4 h组均各重复3次。数据结果以pH6.6-4 h组较pH7.4-4h组的lncRNA相对表达倍数表示,选择3倍以上或1/3倍以下为表达显著上调或下调的lncRNA。其中BC040587、KCNQ1DN、PCAT-43的相对表达倍数分别为3.723、4.669、4.074,呈上调趋势;CTBP1-AS、MEG3的相对表达倍数分别为0.081、0.331,呈下调趋势,差异有统计学意义(P<0.05,图3),数据经Morpheus网页软件处理,以热图呈现。
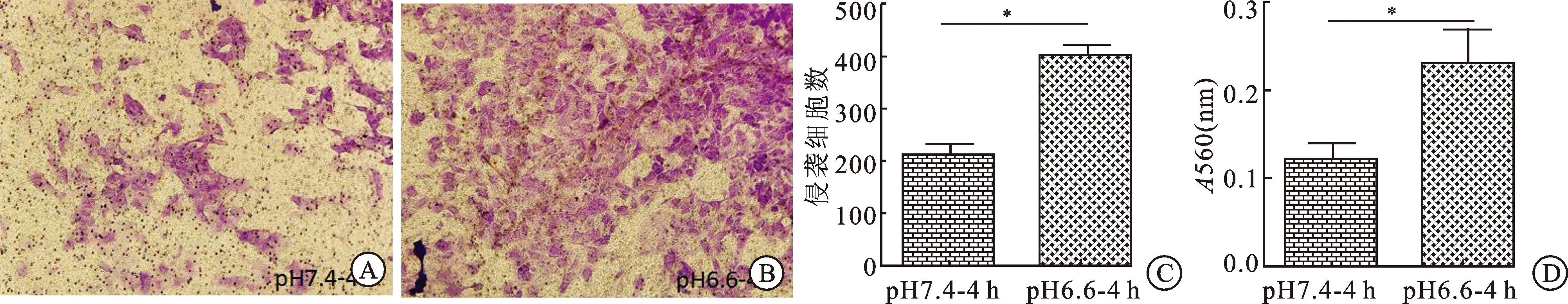
图2酸性微环境肾癌细胞的侵袭表现(结晶紫染色,×10)
A:pH7.4-RPMI培养基培养4 h组细胞侵袭实验镜下观;B:pH6.6-RPMI培养基培养4 h组细胞侵袭实验镜下观;C:pH7.4/6.6-RPMI培养基培养4 h组侵袭细胞个数;D:pH7.4/6.6-RPMI培养基培养4 h组560 nm处吸光度值;与pH7.4培养液培养4 h组比较,*P<0.05。
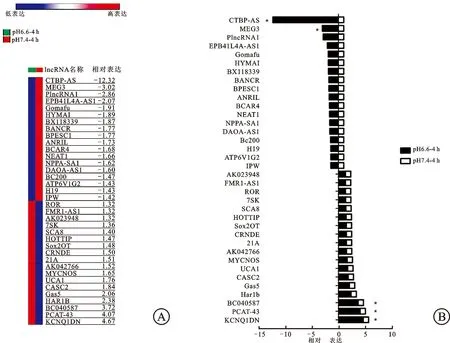
图3 酸性微环境影响肾癌lncRNA表达
A:pH7.4/6.6-RPMI培养基培养4 h组lncRNA表达谱热图;B:pH7.4/6.6-RPMI培养基培养4 h组lncRNA相对表达倍数;与pH7.4培养液培养4 h组比较,*P<0.05。
3 讨 论
恶性肿瘤早已发展成为威胁人类健康及生命的重要疾病,其发生远处转移更是让患者彻底失去治愈机会,使得疾病进入终末期,并最终导致患者死亡。探索肿瘤转移有关机制,对于肿瘤的诊治意义非凡。截至目前,相关研究表明肿瘤发生转移涉及到诸多的生理生化步骤,过程极其复杂而精密,其不仅与肿瘤自身的遗传特性息息相关,更受其所处微环境的影响。其中,恶性肿瘤胞外特殊的酸性微环境与其侵袭转移能力之间的联系一直是研究的热门。在早期的探索研究过程中,学者们证明了正常状态下的组织细胞其胞外环境的酸碱度跟肿瘤胞外环境的酸碱度存在较为明显的差异,前者胞外环境的pH值通常偏碱性,在7.2~7.4范围内,而后者的胞外环境往往偏酸性,pH值在6.5~6.9范围内[9]。一方面,肿瘤细胞因其高葡萄糖摄取量的特点,纵使在氧气富足的条件下仍可经无氧糖酵解产生乳酸,即瓦尔堡效应;另一方面,乏氧条件下的癌细胞可通过一系列反应催化二氧化碳和水生成碳酸[10- 11]。以上两种酸性物质在肿瘤细胞胞内过度生成,可引起胞内pH降低,危害肿瘤细胞本身,但在长期的进化过程中,肿瘤细胞形成了囊泡型H+ATP酶(Vacuolar H+-ATPase,VHA)、钠氢交换体1(Na+/H+exchanger 1,NHE1)和单羧酸转运体(monocarboxylate transporter,MCT) 等pH调节蛋白,可将胞内生成过多的碳酸及乳酸运输至胞外,这一转运过程不单使得肿瘤细胞的胞外酸性微环境得以产生,也保持了肿瘤细胞胞内pH的稳定[12]。后续探索显示,肿瘤发生转移的诸多生理生化步骤深受其胞外酸性微环境的影响。体内外相关实验均证实,酸性培养条件下生长的癌细胞,其侵袭性显著提高[13]。另一方面,恶性肿瘤细胞的转移跟其本身的遗传特点亦息息相关,如癌细胞转移相关基因的表达改变。其中,Snail基因在众多肿瘤组织中的表达均有不同程度的上调,其被认为是促进肿瘤细胞侵袭转移的相关基因之一。Snail作为锌指蛋白超家族的第1个成员,最初在果蝇中被发现,定位于人染色体第20号染色体20q12.3上。其影响肿瘤侵袭转移的可能作用机制可概括为:①Snail基因通过对黏附分子E钙黏蛋白的下调作用,提高肿瘤细胞侵袭性;②Snail基因可调节金属蛋白酶(matrix metalloprotein,MMP)表达,从而影响肿瘤细胞侵袭;③Snail可通过诱导上皮间充质转化(epithelial-mesenchymal transition,EMT),提高肿瘤细胞侵袭性。而在肾癌中,Snail正是通过调控黏附分子E钙黏蛋白的生成,影响肾癌的侵袭能力[14-15]。本研究通过FQ-PCR检测经pH6.6培养液培养不同时间后,Snail基因及其下游E-cadherin基因表达改变,并结合transwell肿瘤细胞体外侵袭实验,验证Snail及E-cadherin基因表达改变的细胞组在侵袭能力上的相应变化。结果表明,pH6.6培养液培养4 h组肾癌细胞769-P Snail基因的表达水平较pH6.6培养液培养0 h组即pH7.4培养液培养4 h组上升趋势最明显,其下游E-cadherin基因表达降低,两者呈负相关,且存在显著的差异(P<0.05);transwell肿瘤细胞体外侵袭实验证实,经pH6.6细胞培养液培养4 h的肾癌细胞769-P,其侵袭性显著增强(P<0.05)。结合上述实验结果及相关文献报道,我们可以假设:肿瘤细胞酸性微环境可上调肾癌细胞769-P Snail基因表达水平,引起黏附分子E-cadherin家族相关蛋白表达下降,从而增强其侵袭能力。
近些年研究发现,多种lncRNA的表达与癌细胞的形成、进展、侵袭密切相关,且在此过程中扮演着重要的角色[16]。本研究lncRNA表达谱芯片筛选结果显示,相对于pH7.4培养液培养4 h组,经pH6.6培养液培养4 h后,肾癌细胞769-P中有BC040587、KCNQ1DN、PCAT-43三种lncRNA表达水平上调,CTBP1-AS、MEG3两种lncRNA表达下调,差异有统计学意义(P<0.05)。BC040587定位于染色体3q13.31,该位点含有频繁的焦点拷贝数改变(copy number alterations,CNAs)以及杂合性缺失。在原发性骨肉瘤样本中,BC040587的表达缺失与肿瘤患者较差的生存率密切相关[17]。CHI等[18]发现,BC040587在乳腺癌样本中的表达较对照组样本低,该趋势与乳腺癌患者较差的肿瘤分化程度、较低的总体生存率及不良预后存在显著相关性。XIN等[19]发现,远离H19 / IGF2区存在的KCNQ1DN可能与肾母细胞瘤的发生发展有关。在前列腺癌细胞中,PCAT通过cell-myc(cMyc)促进肿瘤细胞增殖,其调控作用有赖于cMyc蛋白的稳定性表达。PCAT-cMyc关系是通过Myc3′非翻译区(Untranslated Region,UTR)的转录后活性介导的。通过miR-36673p靶向下调PCAT能够逆转其对cMyc的稳定作用,从而影响前列腺癌细胞的增殖。PCAT-43作为PCAT家族中的一员,具有相似的作用[20]。在前列腺癌细胞中,CTBP1-AS促进前列腺癌的AR转录活性和细胞周期。此外,CTBP1-AS还促进激素依赖性和去势抵抗性肿瘤生长[21]。在甲状腺癌中,过表达MEG3可通过负调控Rac1蛋白的活化,抑制TPC-1和HTH83甲状腺癌细胞的细胞迁移和侵袭,而PC-3细胞中活化的Rac1蛋白与前列腺癌的迁移侵袭息息相[7,22]。LIN等[23]发现,乳腺癌组织中MEG3的表达水平较癌旁组织低,通过在乳腺癌细胞中过表达MEG3,发现MDM2转录水平降低并激活抑癌基因p53转录,最终抑制了癌细胞增殖、迁移和侵袭。
综上所述,酸性微环境可引起肾癌细胞769-P Snail基因及其下游E-cadherin的表达改变,从而提高肾癌细胞的侵袭性。该过程中伴随着lncRNA BC040587、KCNQ1DN、PCAT-43、CTBP1-AS、MEG3的异常表达,上述表达改变的5种lncRNA均有可能作为Snail的上游基因,调控其表达增高,最终引起肾癌细胞769-P侵袭性的增强。例如,本研究中肾癌细胞769-P经pH6.6酸性培养液培养4 h后,MEG3表达较pH7.4培养液培养4 h组降低,低表达MEG3的肾癌细胞769-P中可能伴有抑癌基因p53转录降低,Rac1蛋白表达增高[22- 23]。p53功能丧失或突变可通过去抑制Snail蛋白质表达和活性来促进癌细胞EMT,最终提高癌细胞的侵袭性[24]。在前列腺癌细胞22Rv1中,Snail对细胞侵袭性的调控受PI3K/AKT-Rac1途径传导。过表达Snail的前列腺癌细胞中,Rac1活性增加,癌细胞侵袭能力提高。使用Rac1抑制剂NSC23766可抑制Snail介导的细胞侵袭。同样,在过表达Snail的前列腺癌细胞22Rv1中,PI3K/AKT通路活性增加。使用PI3K/AKT抑制剂LY294002可降低癌细胞侵袭能力,Rac1活性也显著降低[25]。由此假设,本实验中经酸性环境作用后的肾癌细胞769-P可能通过MEG3-p53-Snail途径或MEG3-PI3K/AKT Rac1-Snail途径调控癌细胞侵袭。同理,上述筛选所得的lncRNA均有可能通过影响下游靶基因或者相关蛋白表达,从而调控肾癌细胞769-P的侵袭性。其中具体的作用机制有待进一步研究证实。
总之,本研究结果显示,酸性微环境可提高肾癌细胞769-P的侵袭性,其机制可能与lncRNA BC040587、KCNQ1DN、PCAT-43、CTBP1-AS、MEG3的表达改变有关。
参考文献:
[1] FERLAY J,SHIN HR,BRAY F,et al.Estimates of worldwide burden of cancer in 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2] 郭鹏.Cancer cell:肾癌发生的核心机制[J].现代泌尿外科杂志,2015,20 (1):59.
[3] DECLERCK K,ELBLE RC.The role of hypoxia and acidosis in promoting metastasis and resistance to chemotherapy[J].Front Biosci (Landmark Ed),2010,15:213-225.
[4] RIEMANN A,SCHNEIDER B,GÜNDEL D,et al.Acidosis promotes metastasis formation by enhancing tumor cell motility[J].Adv Exp Med Biol,2016,876:215-220.
[5] CHEN B,LIU J,HO TT,et al.ERK-mediated NF-kB activation through ASIC1 in response to acidosis[J].Oncogenesis,2016,5(12):e279.
[6] HO TT,ZHOU N,HUANG J,et al.Targeting non-coding RNAs with the CRISPR/Cas9 system in human cell lines[J].Nucleic Acids Res,2015,43(3):e17.
[7] 高漓,谭宁,张天禹,等.酸性微环境促进前列腺癌细胞PC-3迁移并活化Rac1蛋白[J].安徽医科大学学报,2016,51(3):333-337.
[8] YU F,RASOTTO R,ZHANG H,et al.Evaluation of expression of the Wnt signaling components in canine mammary tumors by RT(2) Profiler PCR Array and immunochemistry[J].J Vet Sci,2017,18(3):359-367.
[9] ESTRELLA V,CHEN T,LLOYD M,et al.Acidity generated by the tumor microenvironment drives local invasion[J].Cancer Res,2013,73(5):1524-1535.
[10] LU J,TAN M,CAI Q.The Warburg effect in tumor progression:mitochondrial oxidative metabolism as an anti-metastasis mechanism[J].Cancer Lett,2015,356(2 Pt A):156-164.
[11] MCDONALD PC,WINUM JY,SUPURAN CT,et al.Recent developments in targeting carbonic anhydrase IX for cancer therapeutics[J].Oncotarget,2012,3(1):84-97.
[12] KATO Y,OZAWA S,MIYAMOTO C,et al.Acidic extracellular microenvironment and cancer[J].Cancer Cell Int,2013,13(1):89.
[13] MOELLERING RE,BLACK KC,KRISHNAMURTY C,et al.Acid treatment of melanoma cells selects for invasive phenotypes[J].Clin Exp Metastasis,2008,25(4):411-425.
[14] MIKAMI S,KATSUBE K,OYA M,et al.Expression of Snail and Slug in renal cell carcinoma:E-cadherin repressor Snail is associated with cancer invasion and prognosis[J].Lab Invest,2011,91(10):1443-1458.
[15] KUDO-SAITO C,SHIRAKO H,TAKEUCHI T,et al.Cancer metastasis is accelerated through immunosuppression during Snail-induced EMT of cancer cells[J].Cancer Cell,2009,15(3):195-206.
[16] MARTENS-UZUNOVA ES,BÖTTCHER R,CROCE CM,et al.Long noncoding RNA in prostate,bladder,and kidney cancer[J].Eur Urol,2014,65(6):1140-1151.
[17] PASIC I,SHLIEN A,DURBIN AD,et al.Recurrent focal copy-number changes and loss of heterozygosity implicate two noncoding RNAs and one tumor suppressor gene at chromosome 3q13.31 in osteosarcoma[J].Cancer Res,2010,70(1):160-171.
[18] CHI Y,HUANG S,YUAN L,et al.Role of BC040587 as a predictor of poor outcome in breast cancer[J].Cancer Cell Int,2014,14(1):123.
[19] XIN Z,SOEJIMA H,HIGASHIMOTO K,et al.A novel imprinted gene,KCNQ1DN,within the WT2 critical region of human chromosome 11p15.5 and its reduced expression in Wilms’ tumors[J].J Biochem,2000,128(5):847-853.
[20] PRENSNER JR,CHEN W,HAN S,et al.The long non-coding RNA PCAT-1 promotes prostate cancer cell proliferation through cMyc[J].Neoplasia,2014,16(11):900-908.
[21] XIN Z,SOEJIMA H,HIGASHIMOTO K,et al.A novel imprinted gene,KCNQ1DN,within the WT2 critical region of human chromosome 11p15.5 and its reduced expression in Wilms’ tumors[J].J Biochem,2000,128(5):847-853.
[22] WANG C,YAN G,ZHANG Y,et al.Long non-coding RNA MEG3 suppresses migration and invasion of thyroid carcinoma by targeting of Rac1[J].Neoplasma,2015,62(4):541-549.
[23] LIN S,YU L,YANG B.Downregulated long non-coding RNA MEG3 in breast cancer regulates proliferation,migration and invasion by depending on p53’s transcriptional activity[J].Biochem Biophys Res Commun,2016,478(1):323-329.
[24] KIM NH,KIM HS,LI XY,et al.A p53/miRNA-34 axis regulates Snail1-dependent cancer cell epithelial-mesenchymal transition[J].J Cell Biol,2011,195(3):417-433.
[25] HENDERSON V,SMITH B,BURTON LJ,et al.Snail promotes cell migration through PI3K/AKT-dependent Rac1 activation as well as PI3K/AKT-independent pathways during prostate cancer progression[J].Cell Adh Migr,2015,9(4):255-264.