血浆纤维蛋白原和鳞状细胞癌抗原在宫颈癌中的临床价值
乔晓亮
(郑州市妇幼保健院检验科,河南 郑州 450000)
宫颈癌是原发于生殖系统的恶性肿瘤[1],其临床上的发病率仅次于乳腺癌。而近年来我国宫颈癌的发病率逐年上升,对女性身体健康造成严重威胁。由于宫颈癌患者在癌症早期一般无明显症状,而当发展为浸润癌时一般已是中晚期,所以预后较差。因此对宫颈癌进行早期诊断和治疗宫颈癌及癌前病变对降低宫颈癌发生率和死亡率极其重要[2]。纤维蛋白原(FIB)是凝血过程中的主要蛋白,恶性肿瘤凝血功能增强,抗凝及纤溶活性降低,机体处于高凝状态,有血栓形成倾向[3];而鳞状细胞癌相关抗原(SCCA)目前在临床上应用较广,对诊断宫颈癌的特异性较高,因此本研究主要是检测宫颈癌患者肿瘤标志物指标SCCA及凝血指标FIB手术前后及临床分期的变化,共同探讨两者在宫颈癌诊断中的临床价值。
1 资料和方法
1.1一般资料选取郑州市妇幼保健院2015年3月至2016年3月收治的经病理确诊的宫颈癌患者62例作为研究对象,年龄范围为28~72岁,年龄为(46.5±11.3)岁;病理类型:鳞癌20例(32.26%),腺癌24例(38.71%),腺鳞癌18例(29.03%);根据国际妇产科联盟(FIGO)[4]修订的标准将62例宫颈癌患者分为:Ⅰ期8例、Ⅱ期16例、Ⅲ期25例、Ⅳ期13例。另选同期经病理确诊的宫颈良性病变患者50例作为良性病变组,年龄范围29~70岁,年龄(47.2±12.1)岁;同期健康体检者50例作为健康对照组,年龄范围28~70岁,年龄(46.9±12.3)岁。各组在年龄等一般资料的差异无统计学意义(P>0.05),心脏、肝肾等重要脏器无病变,近期无感染,实验前未服用任何药物、未进行溶栓、抗凝等治疗,同时该研究经郑州市妇幼保健院医学伦理委员会批准,患者知情同意。
1.2检测方法宫颈癌组患者于手术前清晨空腹采集静脉血,并且术后一周再次清晨空腹采集静脉血各两管,而宫颈良性病变组及健康对照组则于清晨空腹采集静脉血两管,一管放置于枸橼酸钠抗凝剂的抗凝管,离心分离血浆后采用德国BE COMPACT-X 全自动凝血分析仪检测血浆FIB;另一管置于普通干燥管离心分离血清采用雅培全自动化学发光分析仪检测SCCA,其阳性判读标准:FIB>4 g·L-1,SCCA>2.5 ng·mL-1。操作全过程过程严格按照操作说明进行,同时质控在控。
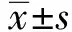
2 结果
2.1三组研究对象FIB和SCCA浓度研究结果显示,宫颈癌患者血浆FIB和SCCA显著上升,高于宫颈良性病变组和健康对照组,差异有统计学意义(P<0.05)。而宫颈良性病变组其血浆FIB和SCCA浓度较健康对照组无显著变化,差异无统计学意义(P>0.05),具体见表1。
2.2宫颈癌患者血浆FIB和SCCA浓度在临床病理类型及临床分期的变化对本研究依病理类型统计发现,血浆FIB浓度在宫颈癌各病理类型(鳞癌、腺癌、腺鳞癌)患者中,差异无统计学意义(P>0.05),而SCCA浓度为鳞癌高于腺癌高于腺鳞癌(P<0.05);依据宫颈癌分期统计分析发现,Ⅲ期和Ⅳ期患者血浆FIB和SCCA浓度显著升高,高于Ⅰ期及Ⅱ期患者,差异有统计学意义(P<0.05)。此外,Ⅳ期患者高于Ⅲ期,Ⅲ期高于Ⅱ期(P<0.05),Ⅱ期患者与Ⅰ期患者间差异无统计学意义(P>0.05),详见表2。

表1 各组血浆纤维蛋白原和鳞状细胞癌抗原浓度比较
注:FIB为纤维蛋白原,SCCA为鳞状细胞癌相关抗原,多重比较采用HSD-q法;与健康对照组比较,aP<0.05,与宫颈癌组比较,bP<0.05。
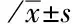
表2 宫颈癌62例血浆FIB和SCCA浓度在临床病理类型及临床分期的变化
注:FIB为纤维蛋白原,SCCA为鳞状细胞癌相关抗原,多重比较采用HSD-q法;与Ⅰ期比较,aP<0.05,与Ⅱ期比较,bP<0.05,与Ⅲ期比较,cP<0.05;与鳞癌比较,dP<0.05,与腺癌比较,eP<0.05
2.3术后宫颈癌患者血浆FIB和SCCA浓度变化
对宫颈癌组患者手术一周后再次进行空腹血浆FIB和SCCA水平检测 [(2.44±0.48) g·L-1、(1.49±0.82) ng·mL-1)],其浓度相比于术前水平[ (4.41±1.29) g·L-1、(6.63±2.54) ng·mL-1)]有显著下降,差异有统计学意义(P<0.05)。
3 讨论
宫颈癌是女性常见的恶性肿瘤,其发病与细菌、病毒、致癌物质、免疫功能抑制等多种因素相关[5],且发病早期缺乏特异性的体征和临床症状,大部分的患者在就诊时已经出现相应的临床症状且大都发展为浸润癌,预后较差,因此早期诊断率和五年生存率都较低。
目前,关于宫颈癌发病的分子机制尚不清楚。近年来有研究发现FIB不仅与凝血功能密切相关,还参与恶性肿瘤的形成和转移的生物学过程[6]。研究已经证实大部分的恶性肿瘤患者体内都存在凝血功能的活化和异常,而这种活化与异常往往预示着肿瘤的进展与转移[7],这也引起了研究人员的关注[8]。FIB是肝脏合成的惟一一种血浆球蛋白,主要参与血液凝固。研究表明,恶性肿瘤细胞浸润导致组织因子(TF)释放后启动凝血系统产生大量凝血酶[9],使FIB和抗凝血酶在肝脏合成降低,导致大量FIB转化成纤维蛋白,进而使血液形成高凝状态。凝血系统诱导血栓促进纤维蛋白的生产与由此而促进肿瘤细胞的侵袭和转移的作用在体内交替进行,形成恶性循环[10-11]。因此,宫颈癌患者存在着FIB异常。本研究发现,宫颈癌患者血浆FIB显著上升,与宫颈良性病变组和健康对照组相比差异有统计学意义(P<0.05);而宫颈良性病变组其血浆FIB浓度较健康对照组差异无统计学意义。而对鳞癌、腺癌、腺鳞癌等不同病理类型患者分析发现其血浆FIB浓度均差异无统计学意义(P>0.05),表明宫颈癌患者血浆FIB浓度上升与临床病理类型无关。进一步研究发现,Ⅲ期和Ⅳ期患者血浆FIB浓度显著升高,高于Ⅰ期及Ⅱ期患者,Ⅳ期患者高于Ⅲ期,Ⅲ期高于Ⅱ期,提示血浆FIB浓度与宫颈癌分期密切相关,随着肿瘤进展其浓度逐渐上升,其含量随着病情发展呈动态变化,这与国内报道相一致[12-13]。并且,对术后一周宫颈癌患者再次检测血浆FIB水平发现其明显下降,表明血浆FIB水平检测可以作为宫颈癌患者术后疗效的预测因素。
SCCA是由鳞状上皮细胞产生的一类多肽,在生理条件下,外周血含量甚微[14],在宫颈癌患者中,由于肿瘤细胞异常调控导致高表达,引起SCCA在外周血中水平持续增加[12,15]。研究结果发现,宫颈鳞癌患者SCCA水平与宫颈良性病变组和健康对照组差异显著,其水平明显异常升高,不同临床分期的宫颈鳞癌患者中,SCCA水平存在差异,晚期(Ⅲ期和Ⅳ期)患者浓度显著升高,高于早期(Ⅰ期及Ⅱ期)患者,提示随着临床分期的进展,SCCA水平明显增高。对宫颈癌患者手术治疗1周后再次检测SCCA水平发现其患者体内浓度显著下降,提示SCCA水平可以作为手术疗效的评价指标。
综上所述,对宫颈癌患者手术前后检测血浆FIB和SCCA水平发现其浓度变化显著,且血浆FIB和SCCA水平与升高程度与临床分期呈正相关,因此,血浆FIB和SCCA水平可作为临床宫颈癌患者诊断、预测临床分期及手术预后的指标,对临床宫颈癌患者的诊疗具有重要的临床价值。
[1] 熊娟.CDK8、KAI1蛋白在宫颈癌及宫颈上皮内瘤变中表达对患者预后的影响[J].安徽医药,2015,19(4):682-685.
[2] 刘淼,邓玉清,刘平.血清SCC-Ag、VEGF、IGF-II及TK1联合检测在早期宫颈癌诊断中的价值[J].海南医学,2012,23(13):91-93.
[3] 韩一栩.血浆纤维蛋白原和D-二聚体用于宫颈癌手术前后检测的临床意义[J].中国实验诊断学,2014,18(6):1006-1007.
[4] 郑爱文,陈雅卿,方静,等.早期子宫颈癌术后肺转移的临床病理特征及危险因素分析[J].中华妇产科杂志,2015(3):204-209.
[5] KURIAKOSE S,RAJAN A,DEHANNATHPARAMBIL KOTTARATHIL V,et al.Simultaneous squamous cell carcinoma of cervix and fallopian tube;a case report[J].Indian J Surg Oncol,2011,2(3):176-177.
[6] 李颖,李大伟,于洋力,等.纤维蛋白原与肿瘤相关性及其机制[J].国际肿瘤学杂志,2016,43(4):282-284.
[7] POTMESIL M,HSIANG YH,LIU LF,et al.Resistance of human leukemic and normal lymphocytes to drug-induced DNA cleavage and low levels of DNA topoisomerase II.[J].Cancer Res,1988,48(12):3537-3543.
[8] ÜNLÜ B,VERSTEEG HH.Effects of tumor-expressed coagulation factors on cancer progression and venous thrombosis:is there a key factor?[J].Thromb Res,2014,133 Suppl 2:S76-S84.
[9] 陈雪芹,张云.宫颈癌患者凝血功能的检测及意义[J].检验医学与临床,2010,7(21):2317-2318.
[10] 周英,林昀,陈敬德,等.恶性肿瘤患者凝血指标的临床分析[J].中国肿瘤临床与康复,2014,21(2):144-146.
[11] 郁舒靓,韩俊庆,韩明勇,等.恶性肿瘤患者凝血指标的临床分析[J/CD].中华临床医师杂志(电子版),2012,6(8):2048-2051.DOI:10.3877/cma.j.issn.1674-0785.2012.08.017.
[12] 喻晓洁,张一清,竺鹏飞.宫颈癌手术前后血浆纤维蛋白原和D-二聚体水平变化[J].中国妇幼保健,2013,28(3):418-420.
[13] 李广虎,程勇,刘云琴,等.宫颈癌合并大出血的临床特征及放疗疗效观察[J].安徽医药,2014,18(10):1892-1894.
[14] 王静,田小飞,袁渊,等.鳞状上皮细胞癌抗原在局部晚期宫颈鳞癌中的临床意义[J].现代肿瘤医学,2013,21(3):636-638.
[15] 陶玲,赵卫东,程敏,等.两种途径新辅助化疗方案在IIB期宫颈癌患者中的近期临床疗效对比[J].安徽医药,2013,17(4):639-641.

