幽门螺杆菌通过NF-κB信号通路调控胃上皮细胞自噬及凋亡的机制研究
沈书旭
(营口市中心医院医务部,辽宁 营口 115001)
幽门螺杆菌(Helicobacter pylori,Hp)感染是导致慢性胃炎及胃溃疡的主要因素,胃黏膜相关的淋巴组织癌变及胃癌的发生也与其息息相关,幽门螺杆菌已成为Ⅰ类致癌因子[1-2]。我国Hp感染率约为53%,且呈上升趋势[3],Hp感染已严重威胁着人类的健康,目前尚未发现有效的、彻底清除Hp的方法,而且关于Hp的致病机制目前还不明确,因此深入探究Hp感染机制,揭示致病机制,对于找到有效治疗Hp感染的方法具有重要意义。
自噬是机体自我保护的免疫防御机制,参与调控机体的生长、分化、发育过程及多种疾病的发生过程,对抵抗病原体感染具有重要作用[4-5]。凋亡是受基因调控的细胞程序性死亡进程,研究发现,Hp感染阳性患者中胃黏膜细胞的凋亡率显著高于感染阴性的患者[6]。细菌感染导致的自噬与凋亡可作为宿主细胞炎症发生的触发开关,但是关于Hp感染所致胃上皮细胞自噬与凋亡的机制还不清楚,本研究通过Hp体外感染人胃上皮细胞AGS,研究了Hp感染对AGS细胞自噬与凋亡的关系,并结合NF-κB特异性抑制剂SN50探讨了可能的作用机制,以期为临床预防和治疗Hp感染提供参考依据。
1 材料与方法
1.1材料与仪器Hp菌株购自美国ATCC;人胃上皮细胞株AGS购自中国科学院上海细胞所;F12培养基、胰蛋白酶购自美国Hyclone;胎牛血清购自美国Gibico;万古霉素(K0059)、多黏菌素(P1004)、吖啶橙(BNN2017)购自美国Sigma;Beclin1、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3 ,LC3)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)、p65、p-p65、β-actin单克隆抗体及辣根过氧化物酶标记的二抗均购自美国Santa Cruz;Annexin V-FITC/PI 双染凋亡检测试剂盒购于Biouniquer Technology;FACSCalibur流式细胞仪购自美国BD;Sorcere Sorcere全自动菌落计数仪购自英国Sorcere;GDS7500紫外凝胶成像分析系统购自美国UVP。
1.2方法
1.2.1Hp菌株培养 自液氮罐中取出冻存的Hp菌种,迅速置于37 ℃水浴锅中轻轻震荡使其充分融化。3 000 r·min-1离心5 min后,吸取50 μL后弃去上清液,吹打混匀后划线将Hp接种至脑心浸液血琼脂平板,置于37 ℃,微需氧(10%二氧化碳、5%氧气、85%氮气)培养条件下培养48 h。挑取菌落至20 mL无菌Hp液体培养基中,置于三气培养箱的摇床上,微需氧条件,37 ℃,100 r·min-1培养24~30 h。
1.2.2胃上皮细胞AGS培养 自液氮罐中取出冻存的AGS细胞,迅速放入37 ℃水浴锅中轻轻震荡使其充分融化,转移至离心管中与F12培养基混匀后离心收集细胞沉淀,使用新鲜的细胞培养基重悬沉淀,取重悬液加入含10%胎牛血清的F12细胞培养液中,置于37 ℃,5%二氧化碳培养箱中培养。待细胞贴壁生长至皿底80%时,弃去旧培养液,磷酸缓冲盐溶液(PBS)清洗后,0.25%的胰蛋白酶消化并收集细胞,细胞培养液重悬后按1∶4进行传代培养。
1.2.3Hp感染AGS细胞方法 取对数生长期的AGS细胞,0.25%胰酶消化后离心收集细胞,细胞培养液重悬后显微镜下调整细胞浓度为2×105个/毫升,每孔2 mL接种于6孔板中,置于37 ℃,5%二氧化碳培养箱中培养。液体培养Hp 24 h,紫外分光光度计检测细菌浓度(1A600=1×108CFU·mL-1)。待AGS细胞生长至皿底80%时,更换新鲜培养基,并按照细菌数:细胞数=100∶1加入Hp菌悬液,置于37 ℃,5% 二氧化碳条件下共培养0 h、3 h、6 h、9 h。
1.2.4流式细胞仪检测AGS细胞自噬 分别向Hp时间梯度处理的AGS细胞、对照组AGS细胞、18 μmol·L-1SN50处理6 h的AGS细胞、18 μmol·L-1SN50+Hp共处理6 h的AGS细胞中加入终浓度为1 mg·mL-1的吖啶橙溶液,37 ℃避光孵育15 min后,0.25%胰蛋白酶消化后收集细胞,PBS清洗1~2次,向细胞中加入100 μL预冷的PBS溶液重悬沉淀,流式细胞仪检测阳性荧光细胞率。
1.2.5流式细胞仪检测AGS细胞凋亡 分别取Hp时间梯度处理的AGS细胞、对照组AGS细胞、18 μmol·L-1SN50处理6 h的AGS细胞、18 μmol·L-1SN50+Hp共处理6 h的AGS细胞,0.25%胰酶消化后显微镜下调整细胞浓度为2×106个/毫升,取1 mL细胞悬液离心并收集沉淀,PBS清洗2次后,加入500 μL结合缓冲液重悬细胞,加入10 μL磷脂结合蛋白Annexin V-FITC和5 μL碘化丙啶(Propidium Iodide,PI)混匀,室温避光孵育15 min,流式细胞仪检测细胞凋亡。
1.2.6蛋白质印迹法检测蛋白表达 取Hp时间梯度处理的AGS细胞,0.25%胰酶消化后收集细胞沉淀,加入细胞裂解液后冰上放置30 min,4 ℃,12 000 r·min-1离心20 min取上清液,BCA法检测上清中的蛋白浓度。取50 μg蛋白按照体积比4∶1加入5×上样缓冲液,100 ℃煮沸5 min制备蛋白样品。蛋白上样后竖直电泳,80 V电泳30 min后,换用120 V继续电泳,直至溴酚蓝跑出玻璃板。取出蛋白胶,冰浴条件下100 V转膜,5%脱脂奶粉室温孵育6 h,分别加入相应的一抗(1∶500)4 ℃震荡培养过夜,TBST洗涤液清洗后加入辣根过氧化物酶标记的二抗(1∶1 000)37 ℃孵育1 h,TBST洗涤液清洗后加入ECL发光剂进行显影,利用自动凝胶成像系统采集图像。
2 结果
2.1Hp感染对AGS细胞自噬的影响利用吖啶橙标记Hp刺激0 h、3 h、6 h、9 h的胃上皮AGS细胞,流式细胞仪检测阳性荧光细胞率分别为0 h(7.25±1.56)%、3 h(12.86±1.78)%、6 h(28.65±2.14)%、9 h(31.19±2.12)%,统计结果如图1所示。4个时间段整体比较差异有统计学意义(F=112.723,P=0.000),Hp刺激后AGS细胞自噬率随着Hp作用时间的延长逐渐升高,Hp刺激3 h、6 h、9 h与0 h相比均差异有统计学意义(t1=3.587,P1=0.007;t2=13.683,P2=0.000;t3=15.307,P3=0.000)。

注:与0 h相比,aP<0.05
2.2Hp感染对AGS细胞凋亡的影响收集Hp刺激0、3、6、9 h的AGS细胞,流式细胞仪检测各时间点AGS细胞凋亡率分别为0 h(9.25±1.56)%、3 h(14.86±1.78)%、6 h(29.65±2.14)%、9 h(33.19±2.12)%,结果如图2所示。4个时间段整体比较差异有统计学意义(F=108.205,P=0.000),Hp刺激后AGS细胞凋亡率随着Hp作用时间的延长逐渐增加,Hp刺激3 h、6 h、9 h与0 h相比均差异有统计学意义(t1=3.587,P1=0.007;t2=13.044,P2=0.000;t3=15.307,P3=0.000)。


注:与0 h相比,at=4.53~8.22,P=0.001~0.004
2.3Hp感染对自噬及凋亡相关蛋白表达的影响
收集Hp处理0 h、3 h、6 h、9 h的AGS细胞,提取各组细胞总蛋白,蛋白质印迹法检测各组细胞自噬及凋亡蛋白表达情况,结果如图3所示。自噬相关蛋白Beclin1、LC3Ⅱ及凋亡相关蛋白Bax的表达随着Hp刺激时间的延长逐渐增高,其中Hp处理0 h、3 h、6 h、9 h时Beclin1的蛋白表达分别为(0.103±0.034)%、(0.276±0.046)%、(0.512±0.041)%、(0.579±0.036)%,LC3Ⅱ/LC3Ⅰ蛋白表达分别为(0.179±0.084)%、(0.667±0.076)%、(2.987±0.120)%、(3.253±0.109)%,Bax蛋白表达分别为(0.127±0.014)%、(0.254±0.026)%、(0.413±0.021)%、(0.506±0.026)%,Bcl-2蛋白表达分别为0 h(0.453±0.023)%、3h(0.321±0.024)%、6 h(0.176±0.016)%、9 h(0.112±0.016)%。Hp处理3 h、6 h、9 h时Beclin1的蛋白表达、LC3Ⅱ/LC3Ⅰ蛋白表达、Bax蛋白表达和Bcl-2蛋白表达分别整体比较均差异有统计学意义(F1=92.140,P1=0.000;F2=759.672,P2=0.000;F3=170.437,P3=0.000;F4=172.688,P4=0.000)。三者表达均显著高于0 h时 Beclin1、LC3Ⅱ/LC3Ⅰ、Bax的蛋白表达(tBeclin1 3 h=5.361,PBeclin1 3 h=0.001;tBeclin1 6 h=12.673,PBeclin1 6 h=0.000;tBeclin1 9 h=14.750,PBeclin1 9 h=0.000;tLC3Ⅱ3 h=6.044,PtLC3Ⅱ3 h=0.000;tLC3Ⅱ6 h=34.779,PtLC3Ⅱ6 h=0.000;tLC3Ⅱ9 h=38.073,PtLC3Ⅱ9 h=0.000;tBax3 h,=6.975,PBax3 h=0.000;tBax6 h=15.708,PBax6 h=0.000;tBax9 h=20.816,PBax9 h=0.000),而凋亡相关蛋白Bcl-2蛋白表达随着Hp作用时间的延长逐渐降低,在3 h、6 h、9 h蛋白表达显著低于与0 h蛋白表达(tBcl-2 3 h=8.041,PBcl-2 3 h=0.000;tBcl-2 6 h=16.873,PBcl-2 6 h=0.000;tBcl-2 9 h=20.772,PBcl-2 9 h=0.000)。


注:与0 h相比,aP<0.05
2.4Hp感染对NF-κB通路蛋白表达的影响Hp作用于AGS细胞0 h、3 h、6 h、9 h后,收集各组细胞提取各组总蛋白,蛋白质印迹法检测各个时间点p65、p-p65蛋白表达变化,并进行统计,0 h、3 h、6 h、9 h四个时间段内p65和p-p65的蛋白表达分别为(0.678±0.030)%、(0.673±0.034)%、(0.664±0.037)%、(0.681±0.041)%,(0.100±0.011)%、(0.211±0.015)%、(0.387±0.026)%、(0.415±0.031)%,结果如图4所示。p65蛋白表达在0 h、3 h、6 h、9 h间差异无统计学意义(F=0.130,P=0.940),p-p65蛋白表达在0 h、3 h、6 h、9 h蛋白表达具有明显变化,整体比较差异有统计学意义(F=134.791,P=0.000),其中Hp作用3 h时即开始显著增高(t=6.109,P=0.000),其表达随着Hp作用时间的延长明显增强。

注:与0 h相比,aP<0.05
2.5Hp感染联合NF-κB抑制剂对AGS细胞自噬及凋亡的影响为了检测Hp感染是否通过NF-κB信号通路促进AGS细胞自噬与凋亡,利用NF-κB通路抑制剂SN50与Hp共处理AGS细胞6 h,并检测各组细胞的自噬及凋亡情况,结果如图5所示。对照组、Hp、SN50处理后以及Hp与SN50联合处理后AGS细胞自噬与凋亡率分别为(11.76±1.70)%,(13.25±1.56)%,(28.65±2.14)%,(29.65±2.14)%,(6.56±1.40)%,(9.86±1.78)%,(19.65±2.14)%,(20.65±2.14)%,4组AGS细胞自噬与凋亡率分别整体比较差异有统计学意义(F1=79.582,P1=0.000,F2=67.421,P2=0.000)。与对照组AGS细胞自噬与凋亡相比,Hp处理AGS细胞自噬与凋亡显著增强(t1=11.054,P1=0.000;t2=10.456,P2=0.000);SN50处理后,AGS细胞自噬与凋亡显著减弱(t1=3.403,P1=0.009;t2=2.799,P2=0.023);Hp与SN50联合处理后,AGS细胞自噬与凋亡显著高于对照组,但低于Hp单独处理组,差异有统计学意义(t1=5.164,P1=0.001;t2=5.890,P2=0.000;t3=4.718,P3=0.002;t4=5.738,P4=0.000)。
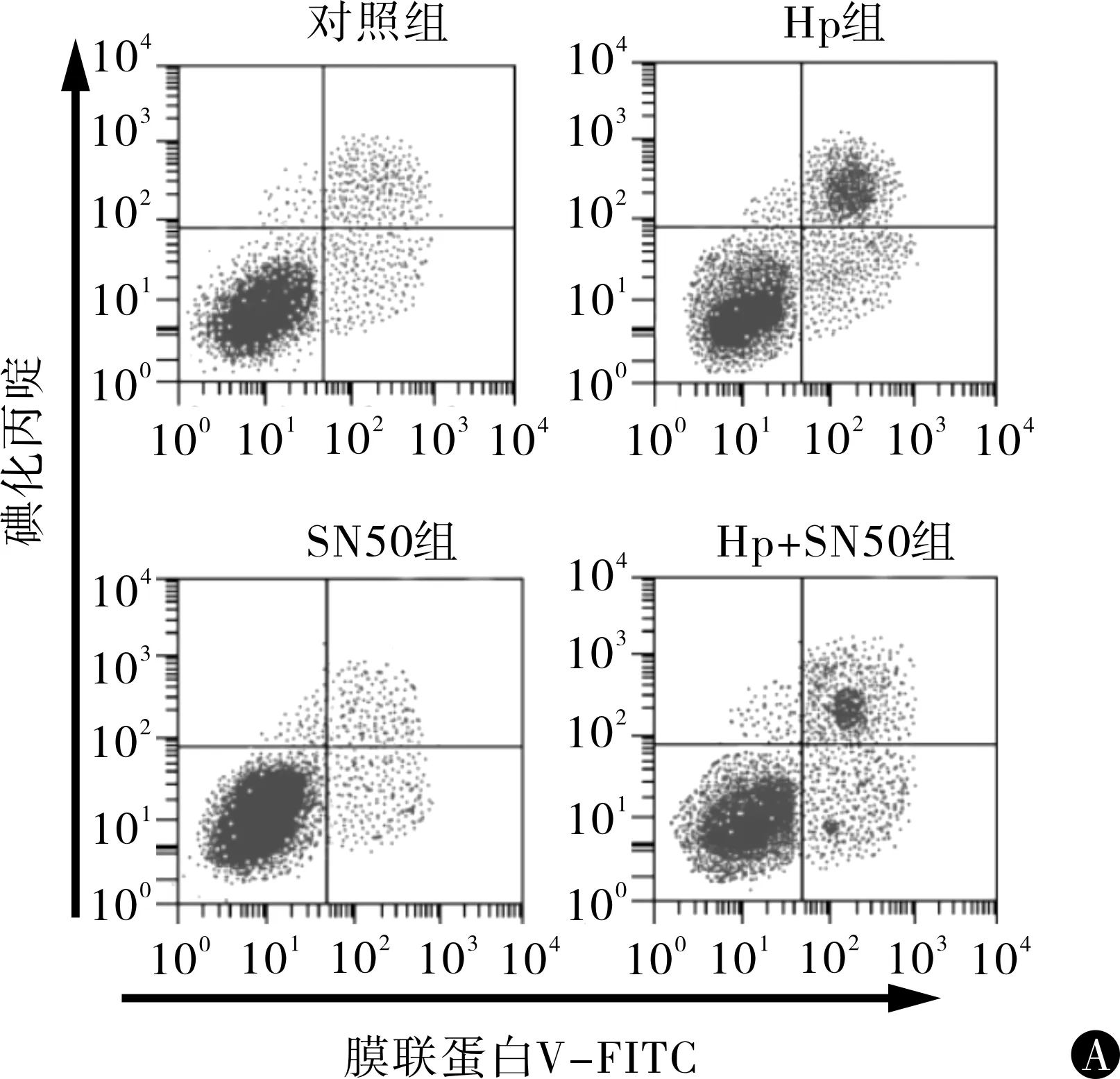


注:与对照组相比,at=5.46~8.34,P =0.001~0.003;与Hp组相比,bt=4.23~8.56,P=0.001~0.004
3 讨论
自噬是在真核细胞中普遍存在的一种现象,依赖于溶酶体的自我消化及再循环机制,进化过程中高度保守[7]。自噬的发生起始于自噬体的形成,自噬体由细胞双层膜包裹待降解物形成,自噬体形成后与溶酶体融合后被消化降解[8]。自噬能平衡细胞合成和代谢,起到稳定细胞内环境的作用,自噬还参与调控细胞的固有免疫及获得性免疫应答过程[9-10]。
Hp感染胃上皮细胞后,细胞为了清除病原菌会诱发自噬的产生,以降解病原体及其所分泌的毒性物质,保护胃上皮细胞[11]。吖啶橙能进入溶酶体和自噬体中并能发生质子化,经吖啶橙标记的细胞无自噬溶酶体产生时呈现绿色,反之则呈现红色,流式细胞仪用于定量检测吖啶橙标记的阳性荧光细胞率,即为细胞的自噬率[12]。本研究通过吖啶橙标记Hp感染0 h、3 h、6 h、9 h的胃上皮AGS细胞,流式细胞仪检测自噬细胞率,结果显示,Hp刺激3 h后,AGS细胞即出现自噬现象,细胞自噬率随着Hp作用时间的延长逐渐升高,6 h时细胞自噬率达到高峰,随后开始下降,说明细胞感染Hp早期即可快速启动自噬的发生,以促进对病原菌的清除。Beclin 1蛋白参与形成自噬前体,引导与自噬相关的蛋白定位于自噬体膜上,从而促进自噬的进行,是调节自噬发生的重要因子,其表达在一定程度上反应了自噬的活性[13-14]。微管相关蛋白(microtubule associate protein 1 light chain 3,MAP1-LC3)主要定位于前自噬泡及自噬泡膜的表面,参与形成自噬体,是自噬体特异性标记蛋白[15],LC3分为Ⅰ型和Ⅱ型,自噬发生前,LC3蛋白主要以Ⅰ型状态存在,自噬发生时Ⅰ型蛋白与自噬泡膜表面的PE结合形成Ⅱ型蛋白,结合到自噬体膜上[16]。本研究结果显示噬相关蛋白Beclin1、LC3Ⅱ的表达逐渐随着Hp刺激时间的延长逐渐增高,LC3Ⅰ蛋白表达随着Hp作用时间的延长逐渐降低,Hp处理6 h对蛋白表达作用效果最显著。说明Hp感染AGS细胞后促进了自噬的发生。
细胞凋亡是细胞受基因调控的主动性死亡过程,机体通过凋亡清除掉机体内衰老及畸形细胞[17]。Hp感染胃上皮细胞后,会诱使凋亡的产生以清除病变细胞。利用Annexin V-FITC/PI双染色标记Hp感染0 h、3 h、6 h、9 h细胞,流式细胞仪检测凋亡细胞,结果显示,Hp感染3h细胞凋亡率出现显著增加,6 h时凋亡率变化最显著。Bcl-2家族是调节细胞凋亡的关键原件,其家族成员Bcl-2和Bax与细胞凋亡密切相关。Bcl-2蛋白可能通过阻断细胞程序性死亡的一个早期环节阻遏细胞凋亡。Bax蛋白在细胞中通过与Bcl-2蛋白形成二聚体,使Bcl-2蛋白失活,从而调控细胞凋亡[18]。本研究结果显示,Hp感染3 h后Bax的表达显著增加,6 h时变化最显著,Bcl-2蛋白表达则随着Hp作用时间的延长逐渐降低。说明Hp感染AGS细胞后促进了凋亡的发生。
NF-κB信号通路广泛参与机体的感染、免疫及凋亡进程,被认为在慢性炎症转变为癌症的进程中具有重要作用[19]。在未受到刺激时,NF-κB二聚体p50/p65与其抑制蛋白IκBα形成多聚体,处于失活状态,细胞受到病原菌感染等刺激时,IKK活化,使IκBα发生磷酸化,无活性的多聚体降解,暴露出NF-κB二聚体的核定位序列,二聚体进入核内,与靶蛋白结合,促进下游基因的表达[20]。检测Hp感染对NF-κB信号通路蛋白的影响,发现Hp感染能显著促进p-p65蛋白的表达,且随着刺激时间的延长蛋白表达也随之增强。说明Hp感染能影响NF-κB信号通路蛋白的表达,为了进一步验证Hp感染是否通过NF-κB信号通路调控AGS细胞的自噬与凋亡,本研究利用NF-κB抑制剂SN50与Hp共同作用于AGS细胞,检测AGS细胞的凋亡与自噬的发生;结果发现,与对照组相比,Hp处理AGS细胞自噬与凋亡显著增强;SN50处理后,AGS细胞自噬与凋亡显著减弱;Hp与SN50联合处理后,AGS细胞自噬与凋亡显著高于对照组,但低于Hp单独处理组,说明Hp感染导致的AGS细胞自噬与凋亡的增强与NF-κB通路的活化有关。
综上所述,Hp感染促进胃上皮细胞AGS的自噬与凋亡的发生,其作用机制与NF-κB通路的活化有关,上述结果可能为临床开发新的预防与治疗Hp感染的药物提供理论依据。
[1] 吴善斌,于晓岩.幽门螺杆菌感染对老年患者胃部黏膜病理学的影响[J].中国老年学杂志,2016,36(13):3227-3228.
[2] PLUMMER M,FRANCESCHI S,VIGNAT J,et al.Global burden of gastric cancer attributable to Helicobacter pylori[J].International Journal of Cancer,2015,136(2):487-490.
[3] 项利娟,朱新建,黄德富,等.幽门螺杆菌感染调查与耐药性分析[J].中华医院感染学杂志,2015,25(8):1710-1711,1727.
[4] KLIONSKY DJ,ABDELMOHSEN K,ABE A,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2016,12(1):1-222.
[5] SHIBUTANI ST,SAITOH T,NOWAG H,et al.Autophagy and autophagy-related proteins in the immune system[J].Nature Immunology,2015,16(10):1014-1024.
[6] BOBBA A,AMADORO G,LA PIANA G,et al.Glycolytic enzyme upregulation and numbness of mitochondrial activity characterize the early phase of apoptosis in cerebellar granule cells[J].Apoptosis,2015,20(1):10-28.
[7] 王贲士,陈德喜,郭洪亮.自噬与肿瘤的研究现状[J].中华肿瘤防治杂志,2014,21(8):637-640.
[9] ABDELAZIZ DH ,KHALIL H,CORMET-BOYAKA E,et al.The cooperation between the autophagy machinery and the inflammasome to implement an appropriate innate immune response:do they regulate each other?[J].Immunol Rev,2015,265(1):194-204.
[10] OWCZARCZYK AB,SCHALLER MA,REED M,et al.Sirtuin 1 regulates dendritic cell activation and autophagy during respiratory syncytial virus-induced immune responses[J].The Journal of Immunology,2015,195(4):1637-1646.
[11] CASTAO-RODRGUEZ N,KAAKOUSH NO,GOH KL,et al.Autophagy inHelicobacterpyloriinfection and related gastric cancer[J].Helicobacter,2015,20(5):353-369.
[12] 冯晓兰,王攀,王筱冰.通过抑制自噬作用增强声动力学疗法诱导的肿瘤细胞凋亡研究[J].中国生物医学工程学报,2015,34(1):62-69.
[13] 李良庆,潘敦,林振孟.自噬相关基因Beclin1和微管相关蛋白轻链3在胃癌组织中的表达及临床意义[J].中华实验外科杂志,2014,31(3):508-510.
[14] 张雨睛,张丽慧,魏尔清,等.Beclin 1在凋亡和自噬中的调节作用[J].中国生物化学与分子生物学报,2015,31(4):331-338.
[15] HUANG R,XU Y,WAN W,et al.Deacetylation of nuclear LC3 drives autophagy initiation under starvation[J].Mol Cell,2015,57(3):456-466.
[16] SHARIFI MN,MOWERS EE,DRAKE LE,et al.Autophagy promotes focal adhesion disassembly and cell motility of metastatic tumor cells through the direct interaction of paxillin with LC3[J].Cell Rep,2016,15(8):1660-1672.
[17] 高薇,侯微,李伟,等.细胞凋亡机制研究进展[J].中国畜牧兽医,2014,41(10):150-156.
[18] ZHAO B,HE T.Chidamide,a histone deacetylase inhibitor,functions as a tumor inhibitor by modulating the ratio of Bax/Bcl-2 and P21 in pancreatic cancer[J].Oncol Rep,2015,33(1):304-310.
[19] ZhONG Z,UMEMURA A,SANCHEZ-LOPEZ E,et al.NF-κB restricts inflammasome activation via elimination of damaged mitochondria[J].Cell,2016,164(5):896-910.
[20] FANG L,CHOUDHARY S,TIAN B,et al.Ataxia telangiectasia mutated kinase mediates NF-κB serine 276 phosphorylation and interferon expression via the IRF7-RIG-I amplification loop in paramyxovirus infection[J].J Vir,2015,89(5):2628-2642.

