β-内酰胺/β-内酰胺酶抑制剂对双歧杆菌和乳酸杆菌敏感性分析*
李 辉, 张 振
(1.华中科技大学同济医学院附属武汉儿童医院新生儿科 430016;2.上海德济医院检验科,上海 200331)
β-内酰胺类抗生素(β-lactam)是儿科常用治疗细菌感染的一类抗生素,包括对不产β-内酰胺酶(β-lactamase)细菌有效的单一β-lactam抗生素和对产β-lactamase细菌有效的β-内酰胺/β-内酰胺酶抑制剂(β-lactam/β-lactamase inhibitors)。儿童肠道正常菌双歧杆菌和乳酸杆菌为一类不产β-lactamase细菌,理论上β-lactam/β-lactamase inhibitors对双歧杆菌和乳酸杆菌的作用与单一β-lactam抗生素相同,然而有研究报道β-lactam/β-lactamase inhibitors比单一β-lactam抗生素导致患儿抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)发病率高很多,而且是导致患儿AAD高发病率的独立危险因素[1-2]。本研究将儿童肠道双歧杆菌和乳酸杆菌对β-lactam/β-lactamase inhibitors药敏情况进行了分析,现报道如下。
1 材料与方法
1.1材料
1.1.1培养基 改良的双歧杆菌培养基BS(在MRS培养基中添加L-半脱氨酸、放线菌酮、硫酸新霉素、硫酸巴龙霉素、氯化锂、X-Gal等)[3],乳酸杆菌培养基为莫匹罗星锂盐改良的MRS,改良的BS和MRS液体培养基用于双歧杆菌和乳酸杆菌的分离及纯化,MRS固体培养基用于药敏试验。
1.1.2质控菌株 双歧杆菌和乳酸杆菌培养及鉴定质控菌株为鼠李糖乳杆菌ATCC 7469、婴儿双歧杆菌ATCC15697,药敏质控菌株为脆弱拟杆菌ATCC25285、多形拟杆菌ATCC29741,全部质控菌株均购自上海北诺生物科技有限公司。
1.1.3试剂 生化鉴定管(淀粉、蔗糖、果糖、棉籽糖、阿拉伯糖、蜜二糖、纤维二糖、甘露醇、山梨醇、麦芽糖、甘露糖、木糖、乳糖、半乳糖、硫化氢、硝酸盐还原等)购自杭州滨和微生物试剂有限公司,API-50CH 和API-50CHL厌氧菌鉴定卡购自法国BioMerieux公司,PCR试剂(蛋白酶K、PCR buffer、dNTP、TaKaRa Ex Taq酶、双歧杆菌和乳酸杆菌扩增引物等)购自美国Invitrogen 公司,E-test 药敏试剂条(氨苄西林、阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林、哌拉西林/他唑巴坦、替卡西林、替卡西林/克拉维酸、头孢哌酮、头孢哌酮/舒巴坦)购自法国BioMerieux公司。
1.1.4设备 电热恒温培养箱(上海精宏实验有限公司); MARKⅡ型厌氧微需氧培养系统(荷兰ANOXOMAT公司);电热恒温干燥箱(上海一恒科技有限公司);高压灭菌锅(北京医疗仪器有限公司);GeneAmp PCR System 9700型PCR仪(美国ABI公司);无菌操作台、冰箱、离心机等实验室所需的常用设备。
1.2方法
1.2.1样品采集与处理 用灭菌棉签取36例母乳喂养健康婴幼儿(年龄1个月至1岁)粪便约1 g,快速放入灭菌装有液态石蜡油和9 mL缓冲蛋白胨水溶液的试管中,充分振荡摇匀,做成1∶10的均匀稀释液,用缓冲蛋白胨水溶液作稀释液,可以有效保护双歧杆菌和乳酸杆菌的存活,避免受外界环境因素的影响。另取1 mL灭菌移液管吸取上述稀释液注入灭菌的含有9 mL缓冲蛋白胨水溶液试管中,充分振荡摇匀,做成1∶100的均匀稀释液。按上述操作顺序,依次做成1×10-7~1×10-3梯度的均匀稀释液。
1.2.2分离培养 将1×10-5、1×10-6和1×10-73种梯度的粪便稀释液各取1 mL分别注入无菌平皿中,每个梯度的稀释液装2块平皿,并做空白对照。在加入样品稀释液的平皿中,分别注入冷却至50 ℃左右的选择性改良BS和MRS培养基适量,然后放入(37±1)℃的MARKⅡ型厌氧培养箱中厌氧培养48~72 h。
1.2.3初步鉴定 分离培养的细菌先采用常规鉴定方法:革兰染色镜检、H2O2试验、糖发酵试验、生化试验等,结合《伯杰氏细菌鉴定手册》(第9版)初步鉴定细菌,然后使用法国BioMerieux公司生产的 API-50CH 检测双歧杆菌、API-50CHL 检测乳酸杆菌。
1.2.416SrDNA序列测定 参考文献[4]方法,采用液氮反复冻融的方法提取初步分离到的双歧杆菌和乳酸杆菌DNA,将 DNA 原液稀释到100 ng/μL,双歧杆菌PCR引物为:上游5′-GAT FCT GGC TCA GGA TGA ACG C-3′,下游5′-CTG ATA GGA CGC GAC CCC AT-3′;乳酸杆菌PCR引物为:上游5′-CTG ATG AAA GCC CTC G-3′,下游:5′-GAG CCT CAG CGT CAG TG-3′。PCR反应体系包括10×buffer 5.0 μL,4×dNTP 1.0 μL,上下游引物(25 mol/L)各0.5 μL,MgCl2(25 mmol/L)5 μL,Taq酶(5 U/μL)0.4 μL,DNA模板5 μL,蒸馏水32.6 μL,共50.0 μL。使用GeneAmp PCR System9600型PCR仪进行扩增,反应条件:95 ℃预变性5 min后,95 ℃15 s,60 ℃ 1 min,72 ℃ 45 s,共35个循环,最后以72 ℃ 10 min延伸至结束。然后将扩增成功的产物寄往上海美吉生物医药有限公司测序,将测序结果上传到NCBI使用BLAST(http://www.ncbi.nlm.nih.gov/blast)完成比对鉴定。
1.2.5药敏试验 按照CLSI制定的方法及标准,使用法国BioMerieux公司E-test试纸条检测氨苄西林、阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林、哌拉西林/他唑巴坦、替卡西林、替卡西林/克拉维酸、头孢哌酮、头孢哌酮/舒巴坦的MIC值,试纸条的浓度为0.016~256.000 μg/mL。按照琼脂扩散法将菌液均匀涂布与整个MRS平皿表面,放置15~20 min,等水吸干后,用镊子将E-test试纸条放置于平皿中央,放37 ℃厌氧培养24 h后观察结果,孵育后围绕着试条可形成一个卵圆形的抑菌圈,抑菌圈与试条的横向相交处的读数刻度,即是此抗生素的MIC。
1.3统计学处理 采用SPSS19.00统计软件进行分析。计数资料以百分率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1双歧杆菌和乳酸杆菌分离培养结果 从36例母乳喂养健康婴幼儿粪便中共分离出45株双歧杆菌和39株乳酸杆菌。
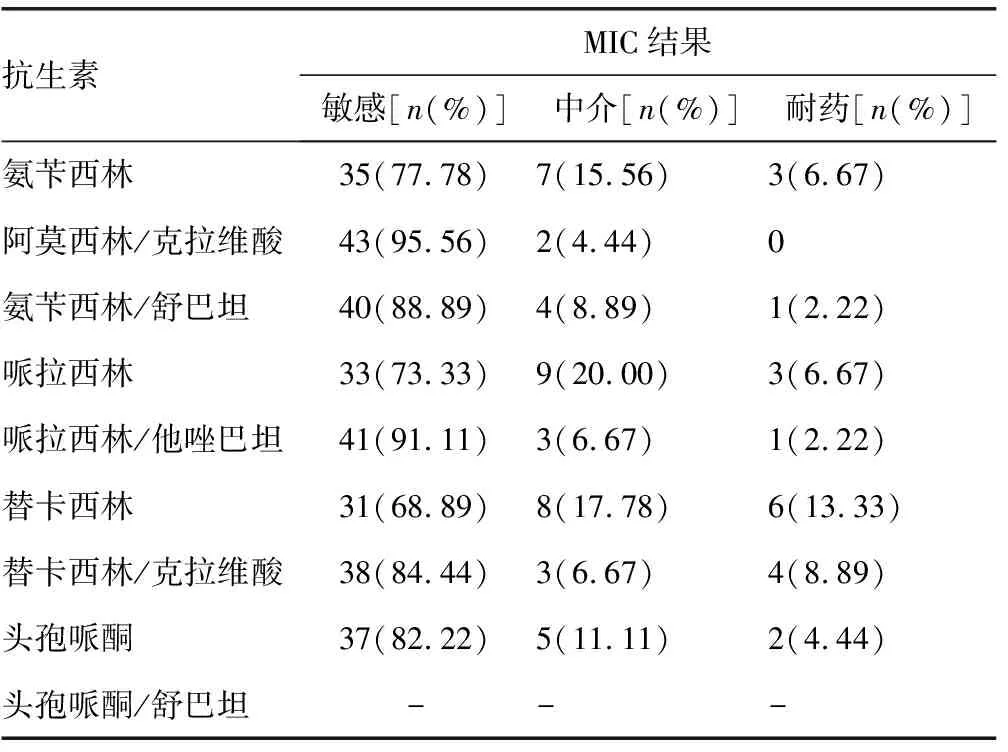
表1 45株双歧杆菌药敏结果分析
-:此项无数据
2.2双歧杆菌药敏结果 45株双歧杆菌对氨苄西林、阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林、哌拉西林/他唑巴坦、替卡西林、替卡西林/克拉维酸、头孢哌酮的敏感百分率分别为77.78%、95.56%、88.89%、73.33%、91.11%、68.89%、84.44%、82.22%,除头孢哌酮/舒巴坦没有CLSI药敏MIC解释标准而无法判断外,其他β-lactam/β-lactamase inhibitor均较单一β-lactam抗生素敏感百分率升高,氨苄西林与阿莫西林/克拉维酸、哌拉西林与哌拉西林/他唑巴坦的敏感数P值分别为0.01、0.03,差异有统计学意义(P<0.05),见表1。
2.3乳酸杆菌药敏结果 39株乳酸杆菌对上述抗生素的敏感百分率分别为74.36%、94.87%、92.31%、71.79%、92.31%、69.23%、89.74%、79.49%,除头孢哌酮/舒巴坦没有CLSI药敏MIC解释标准而无法判断外,其他β-lactam/β-lactamase inhibitor均比单一β-lactam抗生素敏感百分率升高,氨苄西林与阿莫西林/克拉维酸、氨苄西林与氨苄西林/舒巴坦、哌拉西林与哌拉西林/他唑巴坦、替卡西林与替卡西林/克拉维酸的敏感数P值分别为0.01、0.03、0.02、0.03,差异均有统计学意义(P<0.05),见表2。

表2 39株乳酸杆菌药敏结果分析
-:此项无数据
3 讨 论
产β-lactamase细菌能够水解β-lactam类抗生素,从而导致治疗失败,β-lactam/β-lactamase inhibitors是目前儿科治疗产β-lactamase细菌感染的主要抗生素之一,主要有阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、替卡西林/克拉维酸、头孢哌酮/舒巴坦,对于儿童患者而言上述5种复合抗生素与喹诺酮类、氨基糖苷类抗生素相比不良反应较小,而且治疗产β-lactamase细菌感染有较好的效果[5]。然而使用β-lactam/β-lactamase inhibitors也会导致患儿有较高的AAD发生率,有研究显示细菌性重症肺炎患儿使用阿莫西林/克拉维酸、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦AAD发病率均高于其对应的单一β-lactam类抗生素阿莫西林、哌拉西林、头孢哌酮[2]。为了探究使用β-lactam/β-lactamase inhibitors导致患儿高AAD发病率的原因,研究β-lactam/β-lactamase inhibitors对儿童肠道正常菌群(双歧杆菌和乳酸杆菌为主)的影响很有必要。有文献报道阿莫西林/克拉维酸是导致细菌性重症肺炎患儿高AAD发病率的独立危险因素[2]。在本研究中,双歧杆菌和乳酸杆菌对氨苄西林的敏感率分别为77.78%、74.36%,阿莫西林/克拉维酸分别为95.56%、94.87%,由于CLSI对厌氧菌阿莫西林的MIC药敏解释标准还未建立,但阿莫西林折点被认为与氨苄西林相同,有限的体外数据表明这两种药物对厌氧菌的MIC 值接近,因此笔者用氨苄西林替代阿莫西林与阿莫西林/克拉维酸比较敏感数的差异,结果显示双歧杆菌和乳酸杆菌氨苄西林与阿莫西林/克拉维酸的敏感数P值都为0.01,说明阿莫西林/克拉维酸对双歧杆菌和乳酸杆菌的生长抑制作用比阿莫西林(氨苄西林)更强。
YILMAZ等[6]研究显示氨苄西林/舒巴坦是导致血性AAD的重要药物诱因,在本研究中,双歧杆菌和乳酸杆菌氨苄西林/舒巴坦的敏感数百分率分别为88.89%、92.31%,双歧杆菌和乳酸杆菌氨苄西林与氨苄西林/舒巴坦的敏感数P值分别为0.16、0.03,说明氨苄西林/舒巴坦对双歧杆菌和乳酸杆菌的生长抑制作用比氨苄西林强。
在本研究中,双歧杆菌和乳酸杆菌哌拉西林的敏感数百分率分别为73.33%、71.79%,哌拉西林/他唑巴坦分别为91.11%、92.31%,双歧杆菌和乳酸杆菌哌拉西林与哌拉西林/他唑巴坦的敏感数P值分别为0.03、0.02,说明哌拉西林/他唑巴坦对双歧杆菌和乳酸杆菌的生长抑制作用比哌拉西林更强。使用替卡西林/克拉维酸导致患者发生AAD也有报道[7],本研究显示双歧杆菌和乳酸杆菌替卡西林的敏感数百分率分别为68.89%、69.23%,替卡西林/克拉维酸分别为84.44%、89.74%,双歧杆菌和乳酸杆菌替卡西林与替卡西林/克拉维酸的敏感数P值分别为0.08、0.03,说明替卡西林/克拉维酸对双歧杆菌和乳酸杆菌的生长抑制作用比替卡西林强。
头孢哌酮对β-lactamase的稳定性较差,舒巴坦为广谱酶抑制剂同时具有较弱的抗菌活性,二者联合对革兰阴性杆菌有协同抗菌活性,联合后的复合物抗菌活性比单独头孢哌酮高很多[8]。本研究显示双歧杆菌和乳酸杆菌头孢哌酮的敏感数百分率分别为82.22%、79.49%,由于目前用于药敏标准指南的CLSI和欧洲抗生素管理委员会(EUCAST)均没有头孢哌酮/舒巴坦的药敏分组与折点标准,无法判断双歧杆菌和乳酸杆菌头孢哌酮/舒巴坦的MIC值,因而无法比较头孢哌酮与头孢哌酮/舒巴坦对双歧杆菌和乳酸杆菌生长的影响大小。
虽然双歧杆菌和乳酸杆菌不产β-lactamase,但本研究显示β-lactam/β-lactamase inhibitor比单一β-lactam抗生素抑制双歧杆菌和乳酸杆菌作用更强,可能的原因有:(1)对β-lactamase阴性感染菌使用β-lactam/β-lactamase inhibitors比β-lactamase阳性感染菌更易导致患儿发生AAD,其原因是对β-lactamase阳性感染菌使用β-lactam/β-lactamase inhibitors,大部分β-lactamase inhibitors会与感染菌的β-lactamase发生不可逆的结合,β-lactamase inhibitors在与β-lactamase作用的过程中本身会遭到破坏[9],因此没有或者只有较少剩余的β-lactamase inhibitors作用于人体正常菌群。而对β-lactamase阴性感染菌(例如双歧杆菌和乳酸杆菌)使用β-lactam/β-lactamase inhibitors,β-lactamase inhibitors会作用于人体肠道产β-lactamase正常菌群(例如脆弱类杆菌等),导致人体肠道黏膜生物屏障可能被破坏[10];(2)不合理的使用β-lactamase inhibitors,可能会增加儿童肠道双歧杆菌、乳酸杆菌细胞膜的通透性,某些药物或毒素就会进入细菌细胞内,导致这类细菌生长受到抑制[11]。
笔者的药敏研究显示β-lactam/β-lactamase inhibitor比单一β-lactam抗生素抑制儿童肠道双歧杆菌和乳酸杆菌效果更强,然而抗生素在人体内会受到其他多种因素的影响,其吸收、运载和代谢的过程非常复杂,今后需要进一步研究β-lactam/β-lactamase inhibitors导致患者发生AAD的详细机制,以便能合理规范使用β-lactam/β-lactamase inhibitor,尽量考虑治疗产β-lactamase细菌感染疗效的同时兼顾降低患儿AAD发病率。
[1]HAUSMANN J,SCHRDER O.Antibiotic-associated diarrhea[J].Der Gastroenterologe,2012,7(3):220-227.
[2]李自华,程国平,汪在华,等.细菌性重症肺炎患儿抗生素相关性腹泻发病率及高危因素分析[J].临床儿科杂志,2015,33(8):698-701.
[3]FERRARIS L,AIRES J,WALIGORA-DUPRIET A J,et al.New selective medium for selection of bifidobacteria from human feces[J].Anaerobe,2010,16(4):469-471.
[4]SOTO A,MARTN V,JIMNEZ E,et al.Lactobacilli and bifidobacteria in human breast milk:influence of antibiotherapy and other host and clinical factors[J].J Pediatr Gastroenterol Nutr,2014,59(1):78-88.
[5]周华,李光辉,陈佰义,等.中国产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略专家共识[J].中华医学杂志,2014,94(24):1847-1856.
[6]YILMAZ M,BILIR Y A,AYG N G,et al.Prospective observational study on antibiotic-associated bloody diarrhea:report of 21 cases with a long-term follow-up from Turkey[J].Eur J Gastroenterol Hepatol,2012,24(6):688-694.
[7]GUERRAI,FADANELLIR,FIGUEIRM,etal.Aeromonasassociateddiarrhoealdiseasein
South Brazil:prevalence,virulence factors and antimicrobial resistance Aeromonas associadas a diarréias no sul do Brasil:prevalência,fatores de virulência,e resistência a antibiotic[J].Braz J Microbiol,2007,38(4):638-643.
[8]石岩,徐英春,刘晔,等.头孢哌酮-舒巴坦联合米诺环素治疗广泛耐药鲍曼不动杆菌感染[J].中华医学杂志,2012,92(40):2847-2850.
[9]TOUSSAINT K A,GALLAGHER J C.β-lactam/β-lactamase inhibitor combinations:from then to now[J].Ann Pharmacother,2015,49(1):86-98.
[10]RASHID M U,ROSENBORG S,PANAGIOTIDIS G,et al.Ecological effect of ceftazidime/avibactam on the normal human intestinal microbiota[J].Int J Antimicrob Agents,2015,46(1):60-65.
[11]MASCO L,VAN HOORDE K,DE BRANDT E,et al.Antimicrobial susceptibility of Bifidobacterium strains from humans,animals and probiotic products[J].J Antimicrob Chemother,2006,58(1):85-94.

