伴有钙化的T1乳腺浸润性导管癌的病理特征及预后分析*
杜 露,迪力夏提·金斯汗,赵 倩,许文婷,李 丹,李双健,吴 涛,朱丽萍,罗 蕈,杨 亮
(新疆医科大学附属肿瘤医院乳腺外科一病区,乌鲁木齐 830011)
目前,世界范围内对不能触及的乳腺癌的初筛主要是通过乳腺X线摄影,能特征性地发现乳腺钙化,因而成为不可替代的检查手段。乳腺X线摄影在影像学表现为:钙化、肿块、局部不对称及结构扭曲[1]。统计表明,伴有钙化的乳腺癌占乳腺癌30%~50%[2]。目前对伴有钙化的乳腺浸润癌的病理特征及预后鲜有报道。本文旨在探索伴有钙化与不伴钙化的乳腺浸润性导管癌在临床病理特征及二者预后的差异,以进一步认识乳腺癌。
1 资料与方法
1.1一般资料 收集本院2012年6月至2013年6月的乳腺癌患者172例,均为女性,年龄26~75岁,中位年龄47岁,根据术后病理均诊断为肿瘤直径小于或等于2 cm的原发性乳腺癌,其中乳腺浸润性导管癌137例(79.70%),浸润性导管癌伴原位癌35例(20.30%)。入组标准:(1)行首次乳腺癌手术治疗;(2)术后病理确诊肿瘤病灶最大直径小于或等于2 cm;(3)术后病理确诊为乳腺浸润性导管癌或浸润性导管癌伴原位癌;(4)乳腺X线可见恶性肿瘤;(5)乳腺X线评估乳腺钙化进行BI-RADS分级为4B~6级;(6)无远处转移;(7)无术前放疗或化疗史;(8)无其他恶性肿瘤;(9)术后均按照乳腺癌NCCN指南行规范化治疗。本研究经医院伦理委员会批准(G-201247),患者及家属均知情同意。
1.2方法 收集患者影像学资料、临床病理资料、随访资料。影像学资料:乳腺X线检查均用Selena数字乳腺机(HOLOGIC公司,美国)常规取内外侧斜位(MLO)和头尾位(CC)摄影。由两位经验丰富的副主任医师单独阅片。根据入院乳腺X线摄影及术后病理报告对乳腺钙化的描述,将患者分为钙化组(n=72)和非钙化组(n=100)。钙化组包括单纯钙化和钙化合并肿块,非钙化组包括单纯肿块和结构扭曲。临床病理资料:病理类型、组织学分级、TNM分期、淋巴结转移、ER、PR、HER-2、Ki-67、发病年龄、哺乳情况。Ki-67提示细胞的增殖活跃程度,2011年St.Gallen会议提出Ki-67以14%为界,Ki-67高表达为肿瘤细胞核阳性细胞核大于14%,Ki-67低表达为肿瘤细胞核阳性细胞核小于或等于14%,以此来区分乳腺癌的分子分型。ER、PR、HER-2表达均以阳性和阴性表达作为判定标准,其中HER-2:0、-、+为阴性,3+为阳性,2+行FISH(荧光原位杂交)明确是否有基因扩增,基因扩增者并入HER-2阳性组,未扩增者并入HER-2阴性组。随访资料:本次随访2012年6月至2016年4月的患者预后情况,通过电话随访、门诊和住院相结合的方式进行收集。定义随访终点为临床确诊局部复发或远处转移。无病生存时间即自确诊之日至疾病出现进展的时间,以月为单位计算。
1.3统计学处理 采用SPSS19.0统计软件进行分析。计数资料以率表示,采用χ2检验和Fisher精确检验,Logistic相关分析进行多因素分析。生存分析采用Kaplan-Meier法描绘生存率曲线图,Log-Rank检验比较各组生存率,采用COX比例风险回归模型分析各因素对临床终点的风险预测价值,相对风险(HR)及95%的可信区间为评价指标。以P<0.05为差异有统计学意义。
2 结 果
2.1单因素分析 钙化组患者在病理类型、淋巴结转移、Her-2过表达、TNM分期、Ki-67与非钙化组比较差异有统计学意义(P<0.05),见表1。乳腺浸润性导管癌的影像表现见图1。
2.2逐步Logistic回归分析 多因素分析病理类型、淋巴结转移、Ki-67表达是钙化存在的危险因素(P<0.05),见表2。
2.3生存分析 有完整随访资料者170例,随访时间1~38个月,中位随访时间35.8个月。随访期间,钙化组9例患者出现复发转移,非钙化组2例患者出现远处转移。共有3例患者出现胸壁复发,8例出现远处转移,肺转移2例,肝转移3例,骨转移3例。利用Kaplan-Meier法绘制两组的生存曲线,两组无病生存时间差异有统计学意义(P=0.004)。钙化组患者3年无病生存率87.30%,非钙化组为95.06%,见图2。单因素分析显示仅淋巴结转移、钙化和病理类型跟T1乳腺浸润性导管癌3年无病生存率相关(P<0.05),见表3。钙化与淋巴结转移是乳腺浸润性导管癌预后的独立危险因素(P<0.05),见表4。
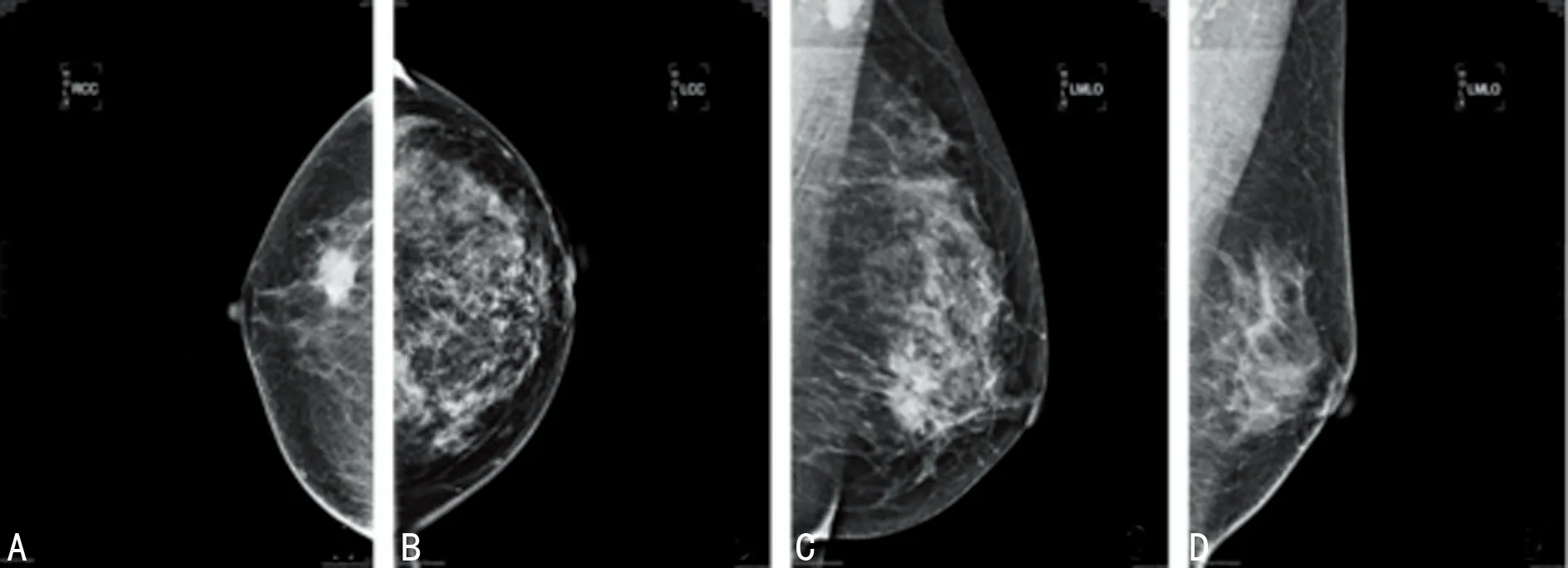
A:单纯肿块;B:单纯钙化;C:肿块合并钙化;D:结构紊乱

图1 乳腺浸润性导管癌的影像表现

续表1 患者是否存在钙化与临床病理特征的关系[n(%)]
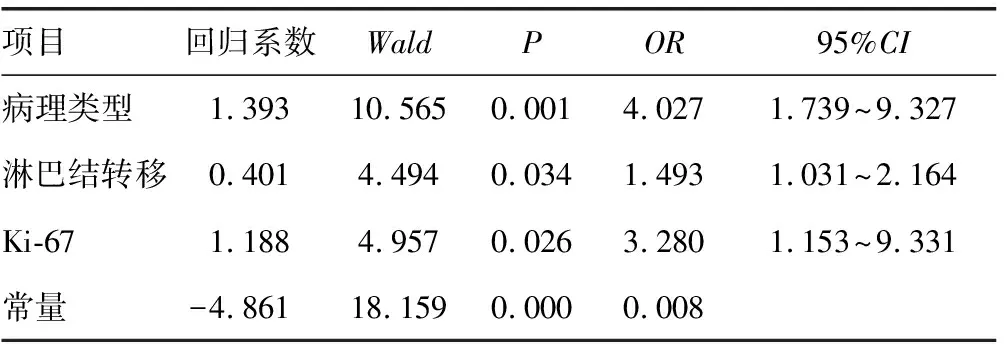
表2 乳腺浸润性导管癌中钙化表达与临床病例特征关系的Logistic多因素回归分析

表3 T1乳腺浸润性导管癌的3年无病生存率单因素分析
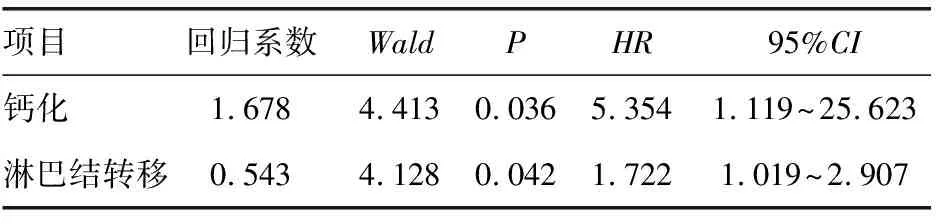
表4 172例乳腺浸润性导管癌3年生存情况的COX比例风险回归分析
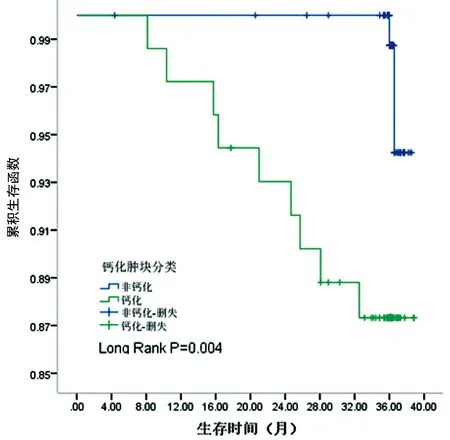
图2 T1乳腺浸润性导管癌的3年无病生存率曲线
3 讨 论
来自2015年美国癌症协会(ACS)的年度统计数据报告显示,乳腺癌已成为女性恶性肿瘤中最常见的死因。但由于早期检测和治疗的提高,乳腺癌病死率降低超过了峰值的1/3。早期检测主要通过乳腺X线对乳腺疾病进行筛查。乳腺癌中30%~70%含有钙化灶,由于钙化在乳腺癌中的高发生率,以及钙化灶的筛查可以提高乳腺疾病的恶性检出率[2]。而对于小直径的乳腺癌肿瘤,大多时候认为患者的预后较好[3]。在此项研究中,对于肿瘤直径在1~20 mm时,选取伴有钙化与不伴钙化的乳腺浸润性导管癌患者,对其进行临床病理因素及生存预后行对照回顾性分析。
对于伴有钙化的乳腺浸润性导管癌的病理特征及预后因素报道较少。国外有报道显示伴有铸状钙化的乳腺癌预后较差,且其与高级别的组织学分级、淋巴结转移多[4-5]、Her-2过表达[6-7]有着密切的联系。本组患者资料再次验证,伴有钙化的乳腺癌生物学特性差、侵袭性与转移性强的特点,表现在病理类型较之非钙化组更多合并有导管原位癌,淋巴结转移阳性率高,Her-2过表达,TNM分期较晚,Ki-67>14%。对于相关风险因素的分析中,病理类型为浸润性导管癌伴原位癌、淋巴结转移和Ki-67>14%是钙化的相关风险因素。 HONG等[6]在对721例乳腺浸润性导管癌的患者的Meta分析中提到,伴有钙化的患者在肿瘤直径大,淋巴结转移个数多,ER、PR低表达,Her-2过表达上占有较高的比例。这与本研究得出的钙化与淋巴结转移个数多相一致。
在以往的研究分析中[3-4,8-9],影像学中可见的钙化灶被作为乳腺癌预后的一个指标。 HOLMBERG等[8]在1 046例患者的随机试验研究中认为在年轻乳腺癌患者中,伴有沙粒样或铸状钙化其组织学分级更高,肿瘤直径也更大,且推断伴有铸形钙化的乳腺癌术后局部复发率增加,预后更差。本研究中钙化组患者的3年无病生存率单因素分析提示,仅与淋巴结转移、钙化和病理类型有密切关系。与国外相关研究结果一致[9-10]。而在本研究所有患者的有效随访中发现,钙化组有较高的复发转移风险,3年无病生存率明显小于非钙化组。这与国外一些相关研究一致,提示伴有钙化的乳腺癌预后较差[11-12]。本研究中COX比例风险回归模型分析结果提示钙化及淋巴结阳性是乳腺癌预后的相关危险因素。而对于小直径的乳腺癌肿瘤,大多时候认为患者的预后较好。在此项研究中,对于肿瘤直径在1~20 mm时,钙化同样是浸润性导管癌的预后危险因素。
综上所述,钙化和淋巴结转移可以预测T1乳腺浸润性导管癌的预后情况。若在乳腺X线检查中发现乳腺钙化影像表现,必要时需行活检明确肿瘤良恶性。认为钙化是乳腺癌的预后的危险因素,对于肿瘤直径在T1期的患者,其预后也不容乐观,应选择合适的手术方式,建议行保乳或全乳切除加前哨淋巴结活检术,若术中前哨淋巴结有转移或术前影像学评估发现淋巴结可疑转移的,建议行腋窝淋巴结清扫术。术后严格规范化治疗。本研究为单中心回顾性病理对照研究,样本量有限,随访时间较短。但本研究提出了以钙化作为研究乳腺癌的预后切点,临床应用上具有广阔的前景。伴有钙化的T1浸润性乳腺癌的预后究竟如何有待于长时间的随访研究加以进一步探索发现。
[1]NASEEM M,MURRAY J,HILTON J F,et al.Mammographic microcalcifications and breast cancer tumorigenesis:a radiologic-pathologic analysis[J].BMC Cancer,2015,15(1):1-9.
[2]MYERS E R,MOORMAN P,GIERISCH J M,et al.Benefits and harms of breast cancer screening:a systematic review[J].JAMA,2015,314(15):1615-1634.
[3]TABAR L,CHEN H H,DUFFY S W,et al.A novel method for prediction of long-term outcome of women with T1a,T1b,and 10-14 mm invasive breast cancers:a prospective study[J].Lancet,2000,355(9202):429-433.
[4]TABAR L,CHEN H H T,YEN M F A,et al.Mammographic tumor features can predict long-term outcomes reliably in women with 1-14-mm invasive breast carcinoma[J].Cancer,2004,101(8):1745-1759.
[5]邵真真,刘佩芳,张淑平,等.钙化性乳腺癌MRI表现及其与预后因子的相关性分析[J].中国肿瘤临床,2013(7):389-394.
[6]HONG L,LIU Z B,XU L H,et al.Malignant calcification is an important unfavorable prognostic factor in primary invasive breast cancer[J].Asia Pac J Clin Oncol,2013,9(2):108-114.
[7]于霞,孟菲,徐海龙,等.乳腺癌X线摄影恶性钙化征象与其预后因素的相关性分析[J].实用放射学杂志,2008,24(6):821-823.
[8]HOLMBERG L,WONG Y N S,TABR L,et al.Mammography casting-type calcification and risk of local recurrence in DCIS:analyses from a randomised study[J].Br J Cancer,2013,108(4):812-819.
[9]DONNELLY P,EVANS A,DUNN J.MAMMO-50:mammographic surveillance in breast cancer patients over 50 years of age - The results of the 2 year feasibility study[J].Eur J Surg Oncol,2015,41(6):S75.
[10]EVANS A.Detection of DCIS and reduced invasive interval cancers[J].Lancet Oncol,2016,17(6):14-15.
[11]PEACOCK C,GIVEN-WILSON R M,DUFFY S W.Mammographic casting-type calcification associated with small screen-detected invasive breast cancers:is this a reliable prognostic indicator?[J].Clin Radiol,2004,59(9):165-170.
[12]BENNETT R L,EVANS A J,KUTT E,et al.Pathological and mammographic prognostic factors for screen detected cancers in a multi-centre randomised,controlled trial of mammographic screening in women from age 40 to 48 years[J].Breast,2011,20(6):525-528.

