森林土壤中多功能降解菌的分离筛选及鉴定
骆 婷,夏 虹,冯定胜,高 友,王一丁*(.四川师范大学生命科学学院,四川 成都 600;.四川师范大学投资管理有限公司,四川 成都 60068)
【研究意义】土壤微生物是土壤生态系统的重要组成部分,数量庞大且种类丰富,在形成土壤结构、分解有机质及矿物质、固氮、调节植物生长等方面发挥着重要作用[1]。土壤微生物资源的开发利用对于生态系统稳定性的提升、农产品质量的保障和土壤可持续利用等都至关重要[2]。随着现代分子生物学技术的发展,土壤微生物资源的相关研究已成为当前热点,且研究重点多在功能性菌株的筛选与应用。【前人研究进展】当前,多种功能性降解菌(如有机磷降解菌[3]、蛋白降解菌[4-5]、淀粉酶产生菌[6-8]、纤维素降解菌[9-10]、油脂降解菌[11-12]等)已广泛应用于农业、工业、医药、食品及环保等各个领域。但是,相比于土壤微生物的丰富性,已知功能性菌株的数量微乎其微,大量土壤微生物的筛选及功能鉴定有待进一步加强。【本研究切入点】森林土壤表面覆盖大量枯枝落叶,其降解与土壤微生物的群落结构和多样性紧密相关[13],目前森林土壤微生物的研究主要集中在土壤微生物参与凋落物降解的动态变化[14-16],这点在高山、亚高山森林土壤微生物的研究中尤为突出,而对森林土壤中功能性降解菌的筛选、应用研究涉及甚少。高山森林土壤每年会出现长达5~6个月的季节性冻融期,土壤冻结导致不耐低温的细菌类群死亡或休眠,部分耐受低温的细菌类群得以存活并保持一定的活性;高山森林土壤的冻结在一定程度上提高了土壤细菌的优势度[17],其中可能存在产酶活性很高的降解菌属。【拟解决的关键问题】本研究采集四川汶川的高山森林土壤,通过稀释涂布平板法、透明圈法等对能够同时降解纤维素、淀粉、蛋白质、油脂及过氧化氢(H2O2)的多功能资源菌株进行分离、筛选及鉴定,以期对土壤微生物资源的进一步开发利用提供参考。
1 材料与方法
1.1 实验材料
1.1.1 样品来源 2015年12月,采集四川汶川海拔2950 m(E103°0′19.08″,N30°51′50.66″)森林下覆盖腐烂落叶的土壤样品,封于塑料袋中,标记采样日期、地点,冷藏备用。
1.1.2 培养基 ①富集培养基。马铃薯液体培养基(PDA):马铃薯200 g/L,蔗糖20 g/L,pH自然;②分离培养基。牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂20 g/L,pH 7.0;③筛选培养基。淀粉培养基:蛋白胨10 g/L,氯化钠5 g/L,牛肉膏5 g/L,可溶性淀粉2 g/L,琼脂20 g/L;油脂培养基:蛋白胨10 g/L,牛肉膏5 g/L,氯化钠5 g/L,花生油10 g/L,1.6 %中性红水溶液1 mL/L,琼脂20 g/L,pH 7.2;脱脂牛奶培养基:脱脂奶粉5 g/L,琼脂20 g/L,pH自然;刚果红培养基[18]:羧基纤维素钠2.0 g/L,磷酸二氢钾0.5 g/L,七水硫酸镁0.25 g/L,硫酸铵1.0 g/L,刚果红0.1 g/L,琼脂20 g/L。
1.2 方法
1.2.1 菌株的分离与纯化 称取土壤样品10 g,放入150 mL PDA液体培养基中,于28 ℃和100 r/min振荡培养48 h。吸取上清液进行10倍梯度稀释,取10-5、10-6、10-7稀释液各100 μl涂布于分离培养基平板上,每个处理重复3次,然后置于28 ℃中倒置培养48 h。根据菌落形态、颜色、质地、形状、边缘等初步统计分离细菌的种类,并将分离到的细菌转接到分离培养基上进行纯化培养[19]。
1.2.2 多功能菌株的筛选 将分离出的菌株分别点种到刚果红培养基、脱脂牛奶培养基、淀粉培养基筛选培养基平板上,设置3个重复,28 ℃培养1~3 d后,根据菌落生长情况及菌落周围变化进行相关功能的鉴定[5,8,20]。菌株在筛选培养基生长且在菌落周围形成透明水解圈,表明该菌株具备纤维素、蛋白质及淀粉的降解能力,同时透明圈的大小在一定程度上反映了菌株降解能力的强弱;因此,本研究以“透明圈直径/菌落直径的比值(D)”初步判定菌株的纤维素、蛋白质、淀粉的降解能力,从而进行功能菌株的初步筛选。
将分离出的菌株点种到油脂培养基上,观察菌落生长情况及菌落周围是否产生红色斑点,若产生红色斑点则表明菌株有降解油脂的能力[21]。油脂水解产生的脂肪酸致使培养基pH降低,培养基中的中性红指示剂使培养基从淡红色转变为深红色,从而在菌落周围形成深红色的水解圈,水解圈越大,则红色斑点越多,可根据水解圈大小或红色斑点数量初步判断菌株降解油脂的能力。
在无菌操作台上,使用高温灭菌的牙签挑取少量菌体分别涂抹在滴有1滴3 % H2O2的载玻片上,肉眼观察是否产生气泡并依据气泡产生的速率简单判定菌株分解H2O2的能力。同时,以不接菌的空白灭菌牙签放入H2O2中观察气泡产生情况作为对照。
筛选并保存能够同时降解蛋白质、纤维素、油脂、淀粉和H2O2的菌株。
1.2.3 菌株的鉴定 形态学鉴定。参照《常见细菌系统鉴定手册》[22],对筛选得到的多功能菌株进行常规形态学观察,从而进行初步的鉴定。
分子生物学鉴定。离心收集发酵培养的菌体,按照康为世纪(北京)生物科技有限公司细菌基因组DNA提取试剂盒的标准操作流程提取总DNA.用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增细菌16S rDNA 基因片段。PCR反应体系(25 μl):Mix 9.5 μl;引物27F、1429R及模板DNA各1 μl;双蒸水12.5 μl。PCR反应扩增条件为:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min.反应产物用1 %琼脂糖凝胶电泳检测合格后,由擎科生物有限公司进行序列测定。测序结果在NCBI上GenBank中进行BLAST比对,然后用MEGA5.1软件进行序列相似性分析,以Neighbor-joining方法构建系统发育树,用Bootstrap进行检验,重复1000次。
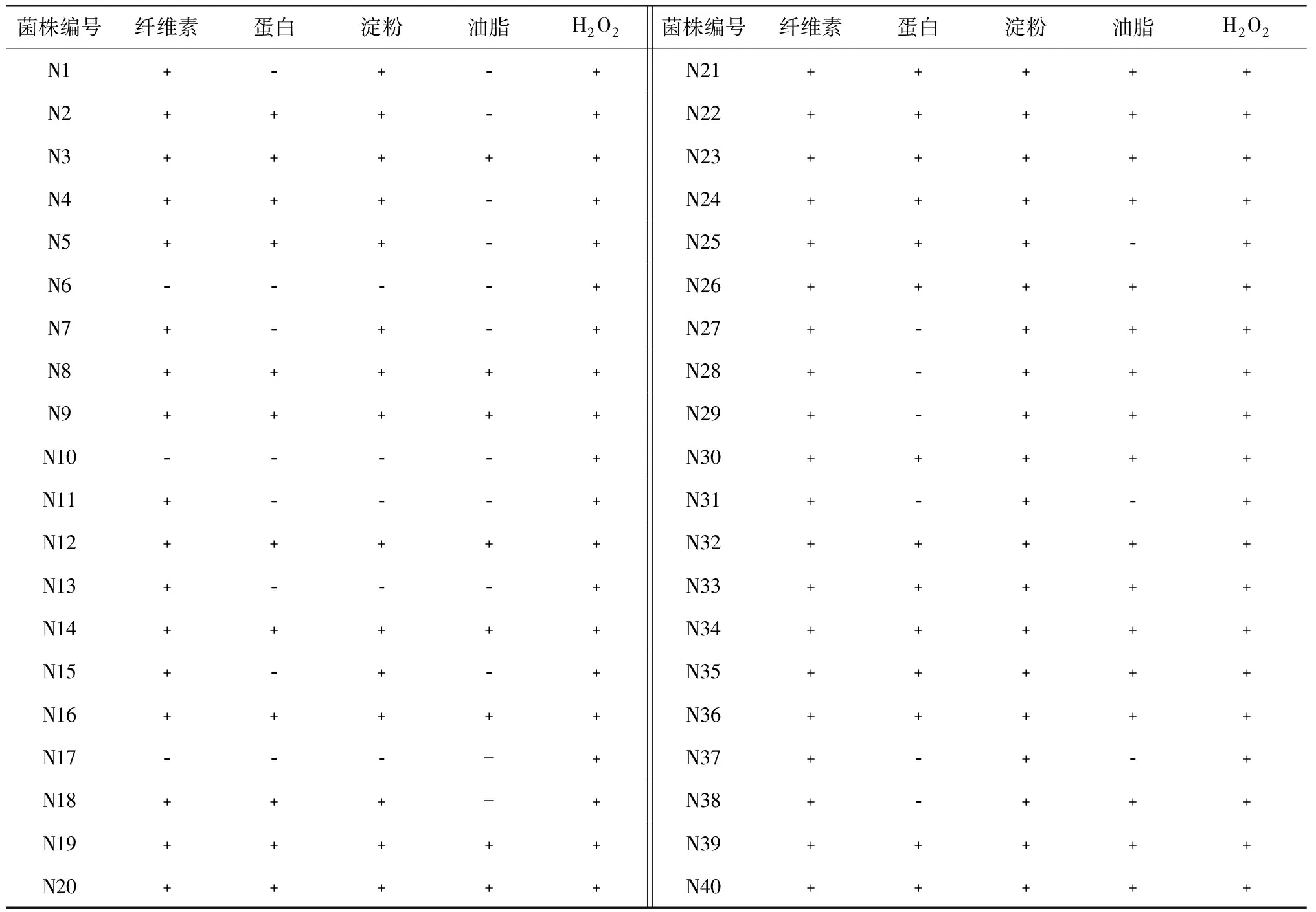
表1 森林土壤可培养细菌的多项降解功能鉴定Table 1 Identification of several degradation functions of bacteria in forest soil
注:“﹢”表示可降解;“﹣”表示不可降解。
2 结果与分析
2.1 菌株的分离及多功能菌株的初步筛选
森林土壤样品经富集培养,通过稀释涂布法分离、纯化,共得到40株可培养细菌,标记为N1~N40。
采用透明圈等方法对细菌N1~N40分别进行多项功能鉴定,由表1可知,40株细菌全部都能分解过氧化氢;纤维素降解菌、蛋白降解菌、淀粉降解菌和油脂降解菌分别有37、26、35、25株,能够同时降解纤维素、蛋白质、淀粉、油脂及过氧化氢的菌株共21株。
透明圈的大小能在一定程度上反映菌株的降解能力。由表2可知,经刚果红培养基平板筛选得到37株纤维素降解菌,其透明圈直径与菌落直径的比值在1.0~9.2,其中比值大于5的有菌株N3、N8、N14、N21、N32,菌株N14的透明圈直径与菌落直径的比值最大为9.2。经脱脂牛奶培养基平板筛选得到的26株蛋白质降解菌,透明圈直径与菌落直径的比值在1.3~4.5,其中菌株N12的比值最大为4.5,降解能力最强。从淀粉培养基平板上筛选到的35株淀粉降解菌,其透明圈直径与菌落直径的比值在1.3~4.3,其中菌株N32的比值最大为4.3。部分菌株的降解效果见图1。
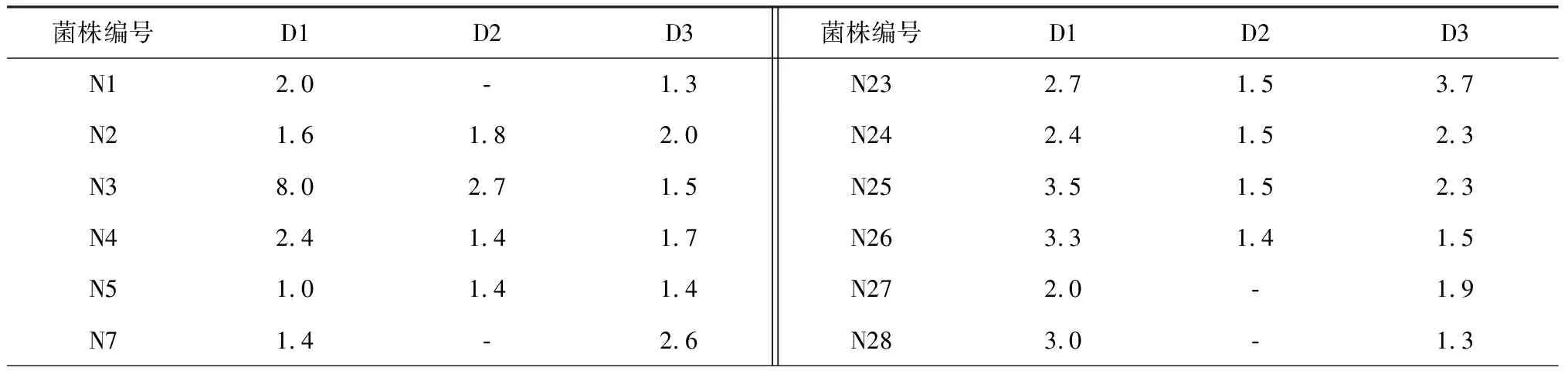
表2 纤维素、蛋白质、淀粉降解菌透明圈直径与菌落直径的比值大小Table 2 The diameter ratio of the transparent circle to the colony of cellulose, protein, starch decomposing microorganisms
续表2 Continued table 2
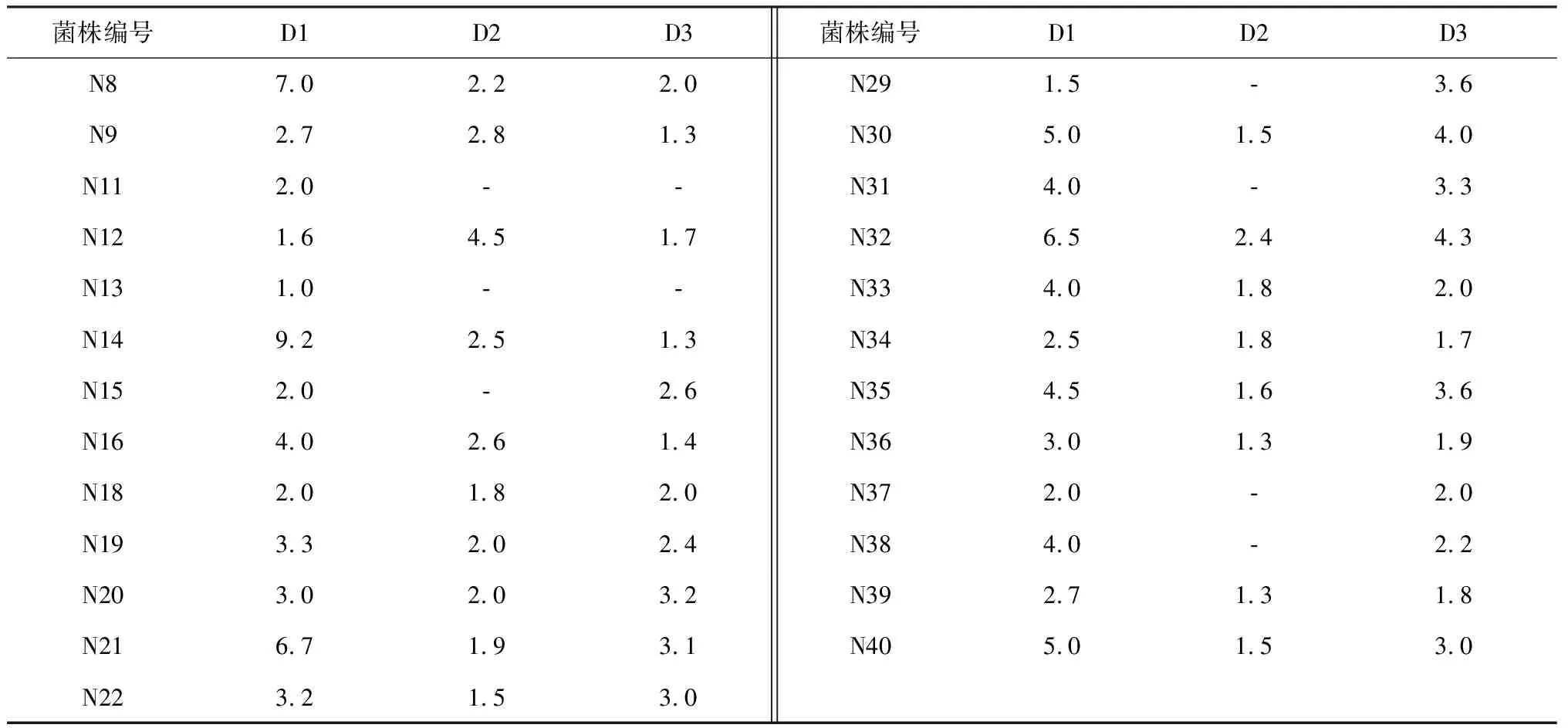
菌株编号D1D2D3菌株编号D1D2D3N87.02.22.0N291.5﹣3.6N92.72.81.3N305.01.54.0N112.0﹣﹣N314.0﹣3.3N121.64.51.7N326.52.44.3N131.0﹣﹣N334.01.82.0N149.22.51.3N342.51.81.7N152.0﹣2.6N354.51.63.6N164.02.61.4N363.01.31.9N182.01.82.0N372.0﹣2.0N193.32.02.4N384.0﹣2.2N203.02.03.2N392.71.31.8N216.71.93.1N405.01.53.0N223.21.53.0
注:D1,纤维素降解菌透明圈直径与菌落直径的比值;D2,蛋白降解菌透明圈直径与菌落直径的比值;D3,淀粉降解菌透明圈直径与菌落直径的比值。
通过将不同菌株点种到油脂培养基上,依据菌落周围颜色是否变红,共筛选到25株油脂降解菌。各降解菌株在油脂培养基中培养3 d后,菌落周围出现红色斑点(表3),其中菌株N12、N16、N19、N20菌落周围深红色水解圈较大(图2),初步判断这4株菌的油脂降解能力较强;其余菌株菌落周围的深红色水解圈较小,或红色斑点紧挨着菌苔不形成水解圈。
在无菌操作台上,不接菌的空白高温灭菌牙签在H2O2中不产生气泡;使用高温灭菌的牙签挑取少量菌体分别涂抹在滴有1滴3 % H2O2中,先后出现不同数量的气泡(表3),其中菌株N9在H2O2中产生的气泡速率最快(图3),初步判断菌株N9分解H2O2的能力较强。
2.2 森林土壤多功能菌株的鉴定
2.2.1 形态学鉴定 从森林土壤中共分离到可培养细菌40株,其中筛选出能够同时降解纤维素、蛋白质、淀粉、油脂和H2O2的多功能菌株21株,21株可培养多功能细菌的菌体形态特征见表4。

A.刚果红培养基;B.脱脂牛奶培养基;C.淀粉培养基A. Congo red medium; B. Skim milk medium; C. Starch medium图1 菌株在选择培养基上的降解效果Fig.1 The degradation effect of the strains on the selection medium

表3 菌株对油脂和过氧化氢的降解结果Table 3 The result of bacteria degrading oil and hydrogen peroxide
注:“﹣”表示无;“﹢”表示少;“﹢﹢”表示多;“﹢﹢﹢”表示很多。
2.2.2 菌株系统发育分析 通过对21株可培养多功能细菌进行16S rDNA基因测序,并将测序结果在GenBank中用blast进行同源性比对,比对结果见表5。其中,菌株N19与芽孢杆菌属Bacillussp.(HM567046.1)、N21与解淀粉类芽孢杆菌Paenibacillusamylolyticus(AB115960.1)的序列相似率达99 %,构建系统发育树(图3)后位于同一分支上,结合其菌体特征可知,菌株N19、N21分别属于芽孢杆菌属和类芽孢杆菌属。N8和N34与 泛菌属Pantoeasp.(KJ865571.1)的序列相似性最大,但只达66 %,这就显示出采样区森林土壤微生物种群可能存在新的物种资源[23]。另外,从图3可知,其他17株多功能细菌均属于假单胞菌属,其中, N3、N14和N20;N23、N39和N40;N12、N16、N22和N30分别位于同一分支,相互之间亲缘关系高达99 %,可以确定它们分别属于同一个种,但其各自之间的形态特征有所不同(表4),可见它们很可能是同一个种下的不同菌株[24];N26与恶臭假单胞菌Pseudomonasputida(KF285966.1)、N32与Pseudomonasvranovensis(KC246044.1)、N36与米氏假单胞菌Pseudomonasmigulae(KP762559.1)的序列相似率达97 %以上,构建系统发育树(图3)后,分别位于同一系统发育分支上;N24与Pseudomonassp.(JQ977479.1)达100 %,构建系统发育树(图3)后位于同一分支上。

D.油脂降解;E.过氧化氢降解D. Oil degradation;E. Hydrogen peroxide degradation图2 部分菌株的油脂降解和过氧化氢降解结果Fig.2 The result of some bacteria degrading oil and hydrogen peroxide

表4 21株土壤可培养多功能细菌的形态特征Table 4 Morphological characteristics of 21 Soil cultured bacteria
综上所述,经16S rDNA基因测序及同源性比对分析,21株可培养多功能资源菌归属于4个属,其中绝大多数属于假单胞菌属(17株,80.95 %),表明假单胞菌属是采样区森林土壤的绝对优势菌群。

表5 森林土壤可培养多功能细菌测序比对结果Table 5 The result of blast by Genbank of the multifunctional strains in forest soil
续表5 Continued table 5

菌株编号相似菌株相似度登录号N21Paenibacillus amylolyticus99AB115960.1N22Pseudomonas sp. CCOS 86499LT009706.2N23Pseudomonas sp. GT 4-0499KM253092.1N24Pseudomonas sp. Bma1100JQ977479.1N26Pseudomonas putida98KF285966.1N30Pseudomonas sp. CCOS 86499LT009706.2N32Pseudomonas vranovensis99KC246044.1N33Pseudomonas sp. EA_S_5499KJ642298.1N34Pantoea sp. MSc-166KJ865571.1N35Pseudomonas sp.strain Hc02598KY465519.1N36Pseudomonas migulae99KP762559.1N39Pseudomonas sp.AT-A-S699KU671213.1N40Pseudomonas sp.AT-A-S699KU671213.1
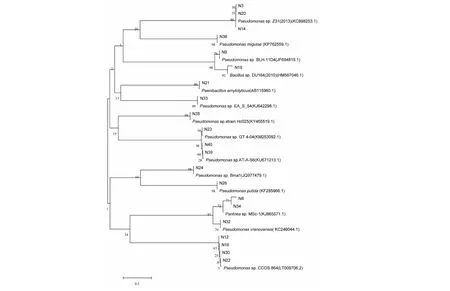
图3 森林土壤多功能细菌的系统发育分析Fig.3 Phylogenetic tree of the multifunctional strains in forest soil
3 讨 论
土壤作为最丰富的菌种资源库,所含微生物数量巨大,以细菌居多[25]。马丽艳木·阿木东等[26]使用LB和TSA两种培养基从新疆沙雅县极端干旱的胡杨林土壤中共分离出57株可培养细菌,分别属于13个属,其中芽孢杆菌属(Bacillus)为主要的优势细菌属。何小丽等[27]采用牛肉膏蛋白胨培养基培养,从上海市大莲湖池杉林湿地土壤中共分离得到20个菌落形态不同的菌株,分别属于9个属,其中芽胞杆菌属(Bacillus)和不动杆菌属(Acinetobacter)细菌是优势菌。由此可见,因环境差异,不同类型不同地区土壤中的可培养细菌种类数量、优势菌群不尽相同。此外,李淼等[28]采用NM、TSA、R2A 3种培养基从我国高海拔冻土区的4个土壤样品中分离得到102株细菌,经16S rRNA 基因部分序列分析表明它们归属于5个属,其中优势菌群为假单胞菌属(Pseudomonas)。相比之下,本文研究结果表明了该地区高山森林土壤具有较高的可培养细菌多样性,并且在分解枯枝落叶中发挥重要作用的优势菌群与我国其他高海拔地区的研究结果[28]一致,这可能与这类细菌适应低温环境有关。本研究只选用牛肉膏蛋白胨培养基进行细菌分离,可能导致获得细菌的数量和种属有限,采用更多的培养基或改良培养基等进一步分离土壤微生物菌种资源,以及结合宏基因组学等免培养分析技术可促进对高山森林土壤微生物多样性特征的认识。
由于微生物肥料等土壤微生物制剂在生产生活中广泛使用及巨大作用[18,30-31],人们越来越偏向从不同类型土壤尤其是特殊环境土壤中筛选功能性菌株加以应用。比如:李静等[32]通过筛选得到15株纤维素降解菌,构建复合菌系来研究其对秸秆的降解,且降解效果较好。贺军军等[12]从甘蔗渣堆积场分离的54个菌株中筛选出21个有降解淀粉能力的菌株,并借此研究甘蔗渣更高效的处理方法。孟静等[32]从受油脂污染的土壤中分离出13株细菌,筛选得到9株油脂降解菌,通过优化降解条件以达到高效处理油脂废水的目的。但当前高山森林土壤中功能性菌株的分离、筛选及应用研究相对较少;本研究从高山森林土壤分离得到的40株可培养细菌中,具有过氧化氢降解功能、纤维素降解功能、蛋白降解功能、淀粉降解功能和油脂降解功能的菌株分别占100 %、92.5 %、65 %、87.5 %和62.5 %,功能菌数量多、降解能力较高。本研究筛选到的纤维素降解菌中,透明圈与菌落直径比大于5的菌株有5株,相比湿地[33]等类型土壤,高山森林土壤中纤维素降解菌的降解能力更强,猜测可能与高山森林土壤存在冻融期,土壤微生物降解森林下枯枝落叶层周期短有关。
随着人类大规模生产生活的需要,微生物菌种资源的基础及开发应用研究逐步受到重视,而高山森林土壤中资源菌的分离、筛选及开发作为微生物菌种资源研究的重要方向,其研究尚显不足。本文通过对高山森林土壤中可培养细菌的分离,以及初步筛选已分离细菌的多种降解功能,有助于初步了解森林土壤微生物的产酶活性;同时通过对降解纤维素、蛋白质、淀粉、油脂和过氧化氢的21株多功能资源菌株的分子鉴定,初步认识了高山森林土壤中功能性资源菌株的多样性和群落结构。可以说,本文研究成果为高山森林土壤资源菌的应用奠定了较好的研究基础,进一步研究方向主要在于功能性资源菌株复合菌系的构建以及它们在提高农业耕地土壤肥力和改善农作物品质方面的应用及效果研究。
4 结 论
本研究从四川汶川的高山森林土壤中分离得到细菌40株,从中筛选出能够同时降解纤维素、蛋白质、淀粉、油脂及过氧化氢的菌株共21株,其中筛选到的纤维素降解菌中,透明圈与菌落直径比大于5的菌株有5株。经鉴定这21株多功能资源菌归属于4个属,其中绝大多数属于假单胞菌属(17株,80.95 %),是该地区土壤的绝对优势菌群。本文研究结果表明该地区高山森林土壤具有较高的可培养细菌多样性,其中的功能菌数量多且降解能力较高,因此,该结果在高山森林土壤资源菌的应用方面奠定了较好的研究基础。
参考文献:
[1]佚 名. 土壤微生物的作用与培养[J]. 中国农资, 2014(27):24-24.
[2]林先贵,陈瑞蕊,胡君利. 土壤微生物资源管理、应用技术与学科展望[J]. 生态学报, 2010, 30(24):7029-7037.
[3]孙 薇,谷 洁,李玉娣,等. 土壤有机磷降解菌的筛选、鉴定及其生长特性研究[J]. 西北农林科技大学学报自然科学版, 2014, 42(2):199-206.
[4]张艳芳,贾彩凤,何 灿,等. 蛋白质谷氨酰胺酶产生菌的分离筛选和鉴定[J]. 食品工业科技, 2015, 36(1):170-176.
[5]郭文坛,王 艳,叶 方,等. 一株蛋白水解酶产生菌的分离鉴定及发酵产酶条件优化[J]. 大连工业大学学报, 2015(6):422-425.
[6]阙祖俊,刘赵玲,李文婷,等. 一株α-淀粉酶生产菌的分离鉴定及其产酶条件优化[J]. 浙江万里学院学报, 2010, 23(5):83-89.
[7]任世英,邵 奎,李 雯,等. 耐酸性α-淀粉酶产生菌的筛选及其产酶条件优化[J]. 中国饲料, 2016(17):10-12.
[8]李鑫玲,孙晓菲,李 欣. α-淀粉酶产生菌的筛选鉴定及其发酵条件的优化[J]. 食品研究与开发, 2016, 37(12):163-165.
[9]陈 静,匡成兵.纤维素降解真菌的分离筛选[J]. 西南大学学报(自然科学版), 2016, 38(8):22-26.
[10]范金霞,王 瑶,王宏燕,等. 松针纤维素降解菌的筛选及其混合发酵[J]. 东北林业大学学报, 2014(4):101-104.
[11]肖 翰,刘 标,尹红梅,等. 病死猪堆肥高效油脂降解菌的筛选及堆肥效果研究[J]. 浙江农业学报, 2017, 29(1):44-50.
[12]孟 静,王海燕,郭秀锐,等. 油脂降解菌的筛选鉴定及降解条件优化[A]. 中国环境科学学会, 2016:7.
[13]王洋清,杨红军,李 勇. DGGE技术在森林土壤微生物多样性研究中的应用[J]. 生物技术通报, 2011(5):75-79.
[14]谭 波,吴福忠,秦嘉励,等. 川西亚高山、高山森林土壤微生物生物量和酶活性动态特征[J]. 生态环境学报, 2014(8).
[15]杨 林,陈亚梅,和润莲, 等. 高山森林土壤微生物群落结构和功能对模拟增温的响应[J]. 应用生态学报, 2016, 27(9):2855-2863.
[16]孙清芳,刘延坤,邵英男, 等. 中国森林土壤微生物动态变化研究进展[J]. 环境科学与管理, 2011, 36(6):117-121.
[17]刘 利,吴福忠,杨万勤,等. 季节性冻结初期川西亚高山/高山森林土壤细菌多样性[J]. 生态学报, 2010, 30(20):5687-5694.
[18]李 静,张瀚能,赵 翀,等. 高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J]. 应用与环境生物学报, 2016(4):689-696.
[19]杨文博. 微生物学实验[M]. 北京:化学工业出版社教材出版中心, 2004.
[20]陈丽燕,张光祥,黄春萍,等. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J]. 微生物学通报, 2011, 38(4):531-538.
[21]沈 萍,陈向东. 微生物学实验[M]. 北京:高等教育出版社, 2007.
[22]蔡妙英,东秀珠.常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[23]Ryan R P, Germaine K, Franks A, et al. Bacterial endophytes: recent developments and applications[J]. Fems Microbiology Letters, 2008, 278(1):1.
[24]宋清姿,王一丁,周艳玲, 等. 耕作土壤中蚯蚓肠道可培养放线菌的多样性研究[J]. 四川师范大学学报(自然科学版), 2016, 39(2):284-288.
[25]华 梅. 长白山森林土壤纤维素酶基因多样性分析及基因克隆与表达[D]. 东北师范大学, 2015.
[26]马丽艳木·阿木东,谢仁娜依·甫拉提,卡依尔·玉素甫,等.沙雅县胡杨林土壤可培养细菌的多样性分析[J]. 新疆农业科学, 2011, 48(5):832-840.
[27]何小丽,张 群,朱 义,等. 大莲湖池杉林湿地土壤可培养细菌的分离与鉴定[J]. 微生物学杂志, 2010, 30(2):18-23.
[28]李 淼,冯海艳,杨忠芳,等. 中国典型冻土区土壤可培养细菌多样性[J]. 微生物学报, 2011, 51(12):1595-1604.
[29]于 迪,吕雅悠,余本玉,等. 微生物肥对辣椒促生长及疫病防治效果[J]. 北方园艺, 2015(12):162-165.
[30]秦亚芬,张 杰. 液体复合微生物菌剂对小麦萌发及生长的影响[J]. 上海农业学报, 2016(1):47-51.
[31]吕爱英,王永歧,沈阿林,等. 6种微生物肥料在不同作物上的应用效果[J]. 河南农业科学, 2004, 33(4):49-51.
[32]贺军军,罗 萍,李勤奋,等. 甘蔗渣淀粉功能降解菌筛选及s2g5-1和s3g4-8的鉴定[J]. 安徽农业科学, 2011, 39(13):45-49.
[33]罗春良,张 琇,徐小春,等. 湿地土壤产纤维素降解菌株的筛选及其性质研究[J]. 化学与生物工程, 2016(7):43-47.

