绵羊体外胚胎对移植受胎率及后代生长性能的影响
汪立芹, 陈大勇, 周 云, 陈 莹, 林嘉鹏, 吴阳升, 黄俊成*
(1. 农业部草食家畜繁育生物技术重点开放实验室,新疆 乌鲁木齐 830000;2.内蒙古赛诺草原羊业有限公司,内蒙古 呼和浩特 010000;3.江苏省苏州市相城区农业局黄桥动物防疫站,江苏 苏州 215131)
【研究意义】超数排卵及胚胎移植技术(MOET)是提高优秀母畜繁殖力的有效方法和措施,也是胚胎生物工程中必不可少的组成部分。但做了多次胚胎移植的供体,就存在子宫角、输卵管、卵巢等相互粘连的情况,无法再用来冲胚,甚至无法繁殖后代。若体外胚胎生产技术(IVP)的卵母细胞来源于这些供体,IVP就能成为MOET的有效补充,能使每只供体在胚胎移植的基础上又可多得后代,达到“废物利用”的目的。【前人研究进展】随着体外胚胎生产技术在牛[1]、绵羊和山羊[2-3]等动物上研究的深入,将逐步应用于畜牧业生产,未来的应用规模也将越来越大。MOET技术一般以移植桑椹至囊胚期的胚胎为主,包括牛[4]、绵羊[5]、山羊[6]的胚胎移植。但此时期胚胎回收率要低于2~8细胞期的早期胚胎[7]。【本研究切入点】因而,为了最大限度地提高供体生产效率,需要研究早期胚胎移植受胎率、产羔率是否与胚胎数量有关,尤其是移植胚胎的数量对体外胚胎移植效率的影响,而这方面的研究鲜见报道。【拟解决的关键问题】本研究通过对体外胚胎与体内胚胎移植效果的比较,可以直观反应二者之间的差距,并且通过对后代生产性能的检测,为确定体外胚胎生产技术能否大规模推广应用奠定基础。
1 材料与方法
1.1 试验材料
本研究在新疆巴里坤健坤牧业有限公司和内蒙古赛诺草原羊业有限公司实施,于2015-2016年秋季进行。供体羊为体格健壮、无明显疾病症状的萨福克纯种母羊。使用的海绵栓和CIDR栓为新西兰辉瑞公司生产,促卵泡激素(FSH)、氯前列醇钠(PG)、孕马血清(PMSG)和垂体促黄体素(LH)为宁波三生药业有限公司生产,体外培养试剂除特殊标注外皆由Sigma公司生产。
1.2 胚胎来源
体内胚胎:将CIDR栓放置于供体母羊阴道内,设为第0天,在放栓第10天,供体开始肌肉注射总剂量为210 mg的FSH,共注射6针,每次注射间隔12 h,剂量逐渐递减,注射第5针FSH的同时,肌肉注射PG 1 mL,并撤去CIDR栓,12 h后用试情公羊试情,发情母羊做好标记,肌肉注射200 mg LH,禁食禁饮。发情12 h后,用腹腔镜向双侧子宫角各输精0.1 mL稀释后的新鲜精液。在供体羊发情的第3天时,使用手术方式,从输卵管伞冲出2~8细胞期的早期胚胎,冲胚液和胚胎保存液购自澳大利亚ICP公司。
体外胚胎:使用因多次胚胎移植等原因导致输卵管、子宫角、腹膜相互粘连而无法继续使用的萨福克母羊作为供体,在其阴道内放置海绵栓,FSH剂量、处理方式同体内胚胎的供体,只需注射6针FSH, 不注射PG,第5针时禁饮禁食12~24 h,通过活体采卵,回收卵母细胞,按照陈大勇等[3]描述的方法,得到2~8细胞期的体外受精早期胚胎。
1.3 受体羊的处理
受体羊需进行同期发情处理,因其发情时间集中在撤栓后36~48 h,所以撤栓时间与供体略有不同。体内胚胎移植用的受体羊,早于供体12 h撤栓,即供体注射第4针FSH时撤栓,同时肌肉注射孕马血清(PMSG)330 IU和PG 1 mL,发情时间在供体发情时间的±12 h内可以使用,超过该范围内的受体弃用。体外胚胎使用的受体羊,撤栓时间为供体注射第5针FSH时,发情时间在体外受精前后12 h内的受体羊留用,否则弃用。移植手术前24 h禁饮禁食。
1.4 胚胎移植
通过手术方式,将输卵管暴露于体外,从伞部移植早期胚胎。根据实验设计,每只受体移植1枚或2枚体内或体外早期胚胎,同时肌肉注射黄体酮0.1 mL。胚胎移植40 d左右,用B超检测受体怀孕率(怀孕母羊数/移植受体数),5月后统计产羔率(产羔数/移植受体数)。
1.5 后代生产性能测定
胚胎移植后代出生后及时称量其初生重,确定羔羊性别,于3月龄时统计羔羊成活率。
1.6 数据统计
所有数据使用SPSS 13.0统计软件的t检验方法,以平均数±标准误表示。
2 结果与分析
2.1 绵羊体外早期胚胎数量对移植效果的影响
由表1显示,将体外受精获得的绵羊早期胚胎随机移植1枚或2枚至同期发情受体输卵管内。移植40 d后B超检测怀孕率结果:移植2枚早期胚胎的受胎率为60.42 %,显著高于移植单枚胚胎的受胎效果48.54 %(P<0.05)。且产羔率(74.68 %)极显著高于移植单胚的41.96 %(P<0.01)。

表1 体外早期胚胎数量对移植效果的影响Table 1 The effect of in vitro early embryo on transplantation
注:同列数据不同大写字母表示差异极显著(P<0.01)。
Note: Different capital letters in the same column have extremely significant difference(P<0.01).

表2 单枚体内或体外胚胎对移植效果的比较Table 2 Comparison of the effects of single in vivo or in vitro embryos on transplantation

表3 2枚体内或体外胚胎对移植效果的比较Table 3 Comparison of the effects of two in vivo or in vitro embryos on transplantation
2.2 单枚体内胚胎和体外胚胎对移植效果的比较
表2显示,将移植胚胎数量同为单枚的体内胚胎和体外胚胎移植效果相比较,通过t检验方法分析后发现,体内胚胎受胎率(64.12 % vs 48.54 %,P<0.05)和产羔率(62.88 % vs 41.96 %,P<0.05)都显著高于体外胚胎。
2.3 移植双枚体内或体外胚胎对受胎率影响的比较
表3显示,将移植胚胎数量同为2枚的体内胚胎和体外胚胎移植效果用t检验比较,无论是受胎率(67.87 % vs 60.42 %)还是产羔率(84.93 % vs 74.68 %),二者间没有差异(P>0.05)。
2.4 胚胎来源对后代性别比例的影响
表4显示,将自然繁殖、体内胚胎移植和体外胚胎移植的后代公母羔比例进行统计分析,体外胚胎移植后代公羔数比例为52.9 %,显著高于自然繁殖的公羔数比(44.08 %)(P<0.05);体内胚胎移植后代公羔比例为51.4 %,介于体外胚胎和自然繁殖直接,且与二者差异皆不显著(P>0.05)。
2.5 胚胎来源对羔羊初生重的影响
表5显示,体外胚胎移植的后代初生重平均为4.98 kg,极显著低于体内胚胎后代的6.2 kg(P<0.01),但与自然繁殖后代没有差异(P>0.05)。而3月龄的体重达到37.03 kg,与自然繁殖组和体内胚胎组没有差异。三者间3月龄存活率在90.15 %~91.9 %,也没有差异(P>0.05)。
3 讨 论
MOET因技术成熟、操作简单,自20世纪70年代已在普通的养殖企业中得到广泛应用,与20世纪40年代的人工授精技术发展相似,成为优良种畜常规的繁殖方法。随着体外受精技术研究的深入,IVP将会继MOET后成为新的应用趋势[8]。自40多年前,在首次获得人的试管婴儿以来,辅助生殖技术(ART)取得了显著的进步[9],动物体外胚胎的研究也越来越多。Bhandari S等[10]觉得,在人的体外胚胎移植中,并不是移植的胚胎数量越多越好,但在动物生产中,需要充分考虑移植胚胎数量与生产效率的关系。

表4 胚胎来源对后代性别比例的影响Table 4The effect of embryonic origin on the sex ratio of offspring
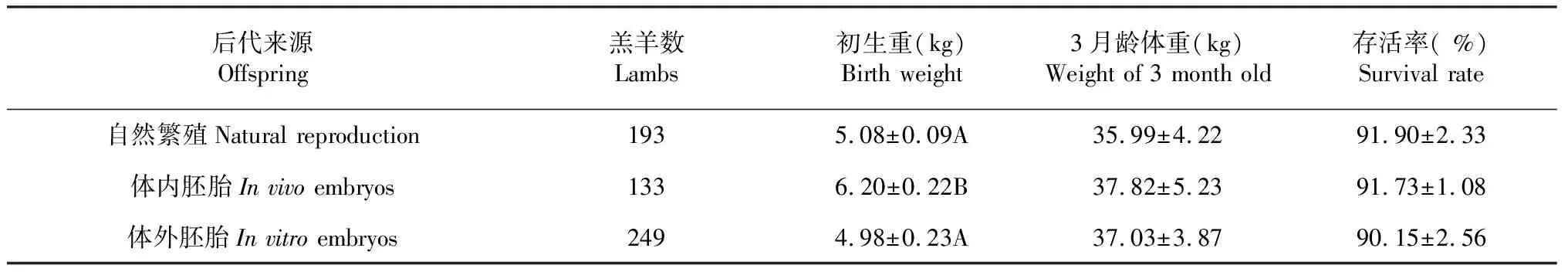
表5 胚胎来源对羔羊初生重的影响Table 5 The effect of embryonic origin on the birth weight of lamb
通过超数排卵处理,萨福克供体可以得到2~8细胞期的早期胚胎8枚左右。每只同期发情的受体移植单枚胚胎和移植2枚胚胎的受胎率间没有差异,均在60 %以上。虽然移植2枚胚胎产羔率高于单枚的20 %以上,但从整体生产效率计算,移植单枚胚胎反而高于2枚胚胎20 %。经查阅国内外文献,该方面的研究报道极少,只有1985年王达珍[11]等通过对54只细毛羊移植单枚2~16细胞期胚胎的受胎率进行了统计,怀孕率高达76 %,产羔率为69.81 %,与本研究结果相近,但其没有进行移植2枚胚胎的对照结果。因此,体内早期胚胎应以移植单枚胚胎为主,生产效率最高。
哺乳动物体外胚胎生产技术在我国因受卵母细胞来源质量的限制,目前主要作为技术平台,应用于实验室的各类研究[12-13]。除了在人类试管婴儿中应用较为广泛外[14-15],其他动物的体外胚胎很少在生产中进行移植。对于早期体外胚胎数量对移植受胎效果影响的研究参考数据较少。本研究通过对体外早期胚胎的移植结果分析后发现,移植单枚胚胎的受胎率虽然只低于双胚的11.88 %,但产羔率却降低了约32.72 %,综合生产效率只比移植双枚胚胎高4.62 %(41.96-74.68/2),再加上受体饲养管理和胚胎移植的成本,移植单枚胚胎的经济效益低于移植2枚胚胎的。因此,相对于体外早期胚胎,每只受体移植2枚更为经济。
Corcoran D等[16]证明,体内和体外胚胎经培养诱导的转录和翻译因子mRNA丰度的变化明显。Rizos D等[17]通过实验证实,虽然来源于体内培养和体外培养液培养获得囊胚的数量之间没有差异,但在体内培养获得的囊胚经玻璃化冷冻后的存活率要高于体外受精的胚胎,从而说明体内胚胎质量高于体外胚胎。Enright BP等[18]研究了体内外胚胎冷冻保存后的存活率,结果表明,体外培养胚胎冷冻后的存活率显著低于在母羊输卵管中培养的体外受精胚胎或由供体超排获得的胚胎。因而,以上几位研究者的结果可以证明,体外胚胎的质量比体内胚胎差。比较了分别移植1枚2~8细胞期体内或体外早期胚胎妊娠结果,体外胚胎的受胎率和产羔率都显著低于体内胚胎,进一步验证了体外胚胎质量要低于体内胚胎。但每只受体移植2枚体内或体外胚胎,二者间的怀孕率和产羔率却没有差异,具体原因需待进一步研究。值得借鉴的是,人类的IVF-ET,也以移植2枚胚胎为主[19]。
对于种绵羊生产企业,公羔比例越高,生产效益越好。通过本研究发现,体外胚胎移植后代的公羔比例显著高于自然繁殖组,与体内胚胎移植后代虽然没有统计学差异,但也略高于后者。虽然后代初生重要低于体内胚胎移植组,但3月龄的体重却没有差异,且存活率也没有统计学差异。因此,体外胚胎移植对后代的生产效率没有影响,可以在生产中大规模推广应用。
4 结 论
移植早期体外胚胎应以移植2枚为主;移植1枚体内早期胚胎的生产效率最高;体外胚胎对后代生产性能没有影响,因此,体外胚胎能在生产实践中进行应用。
参考文献:
[1]Pinto T L, Lopes BC, Ferreira M B, et al. 245 Effects of gyr(bos taurus indicus) donor mitochondrial DNA and ovum pickup order oninvitroembryo production[J]. Reprod Fertil Dev, 2015, 27(1):212.
[2]ParamioM T, Izquierdo D. Current Status ofinvitroembryo production in sheep and goats[J]. Reproduction in Domestic Animals, 2014, 49(4):37-48.
[3]陈大勇,汪立芹,范利宏,等. 影响杜泊羊体外胚胎生产效率的因素[J]. 华中农业大学学报, 2016, 35(5):1-5.
[4]An L, Ling P P, Zhu X, et al. Successful Vitrification ofInvivoEmbryos collected from superovulated Japanese Black Cattle (Wagyu)[J]. Reprod Domest Anim, 2016, 51(2):255-261.
[5]Fry R. The use of long-acting FSH- MAP5 in sheep superovulation programs[J]. Reprod Fertil Dev, 2016, 29(1):208-209.
[6]Balaro M, Brand?o F Z, Maia A, et al. Pre-selection test to identify high responder donor goats[J]. Reprod Domest Anim, 2016, 51(3):386-391.
[7]张果平,王金文,王德芹,等. 影响杜泊绵羊超数排卵效果的因素分析[J]. 西南农业学报, 2008, 21(6):1728-1732.
[8]Phillips P E, Jahnke M M. Embryo transfer (Techniques, Donors, and Recipients) [J]. Vet Clin North Am Food Anim Pract, 2016, 32(2):365-385.
[9]Bortoletto P, Bakkensen J, Anchan R M. Embryo transfer: a review of timing and techniques[J]. Minerva Endocrinol, 2017, doi: 10.23736/S0391-1977.17.02649-9. [Epub ahead of print]
[10]Bhandari S, Ganguly I, Agarwal P, et al. Relationship of number of embryos transferred with perinatal outcome of singleton pregnancy[J]. J Reprod Infertil, 2017, 18(1):179-184.
[11]王达珍, 廖友桂, 张锁链,等. 绵羊受精卵(早期胚胎)的移植[J]. 内蒙古大学学报(自然版), 1985(2):139-144.
[12]Bevacqua R J, Fernandez-Martín R, Savy V, et al. Efficient edition of the bovine PRNP prion gene in somatic cells and IVF embryos using the CRISPR/Cas9 system[J]. Theriogenology, 2016, 86(8):1886-1896.
[13]Luchetti C G, Bevacqua R J, Lorenzo M S, et al. Vesicles Cytoplasmic Injection: an Efficient Technique to Produce Porcine Transgene-Expressing Embryos[J]. Reprod Domest Anim, 2016, 51(4):501-508.
[14]Boltz M W, Sanders J N, Simonsen S E, et al. Fertility treatment, use of in vitro fertilization, and time to live birth based on initial provider type[J]. J Am Board Fam Med, 2017, 30(2):230-238.
[15]Qin J C, Fan L, Qin A P. The effect of dehydroepiandrosterone (DHEA) supplementation on women with diminished ovarian reserve (DOR) in IVF cycle: Evidence from a meta-analysis[J]. J Gynecol Obstet Hum Reprod, 2017, 46(1):1-7.
[16]Corcoran D, Rizos D, Fair T, et al. Temporal expression of transcripts related to embryo quality in bovine embryos cultured from the two-cell to blastocyst stage in vitro or in vivo[J]. Mol Reprod Dev, 2007, 74(8):972-977.
[17]Rizos D, Ward F, Duffy P, et al.Consequences of bovine oocyte maturation, fertilization or early embryo development in vitroversus in vivo: implications for blastocyst yield and blastocyst quality[J]. Mol Reprod Dev, 2002, 61(2):234-248.
[18]Enright B P, Lonergan P, Dinnyes A, et al. Culture of in vitro produced bovine zygotes in vitro vs in vivo: implications for early embryodevelopment and quality[J]. Theriogenology, 2000, 54(5):659-673.
[19]Preutthipan S, Amso N, Curtis P, et al. The influence of number of embryos transferred on pregnancy outcome in women undergoing in vitro fertilization and embryo transfer (IVF-ET) [J]. J Med Assoc Thai, 1996, 79(10):613-617.

