陆地棉叶片特异性表达启动子的克隆与表达分析
司爱君,杨维才,谢宗铭,田 琴,董永梅,李有忠,马盼盼
(1.新疆农垦科学院棉花研究所/农业部西北内陆区棉花生物学与遗传育种重点实验室/新疆兵团棉花遗传改良与高产栽培重点实验室,新疆 石河子 832000;2.中国科学院遗传发育学研究所,北京 100101;3.新疆农垦科学院生物技术研究所,新疆 石河子 832000)
【研究意义】启动子是基因表达调控的“开关”,为基因准确转录所必需。在以往的植物基因工程研究中,组成型启动子由于简单方便而得到广泛应用。由于组成型启动子驱动外源基因在棉花的不同时期和不同部位均能表达,容易积累大量异源蛋白或代谢产物,打破体内原有代谢平衡,从而影响植物正常生长,使得遗传改造的棉花农艺性状较差。谢德意[1]研究发现, CaMV 35S启动子组成型表达,可能会降低棉株体内杀虫物质的浓度,同时还消耗棉株大量能量,影响其杀虫效果。侯丙凯等[2]研究发现,CaMV 35S组成型启动子使得抗虫基因在棉花生长发育全周期及各组织中都存在,在这样长期选择压力下,将会大大提高昆虫对转基因植物产生抗性的几率。随着Tail-PCR、Site Finding-PCR等克隆基因未知侧翼序列技术的发展[3-4],更多的组织特异型和诱导表达型启动子也逐渐应用到基因工程研究中[5-7]。【前人研究进展】宋阳等[8]克隆了一个大豆豆荚特异性启动子PSP, 在转基因烟草的花荚中检测到GUS高水平表达。张利东等[9]将GOS2启动子转化水稻验证其在其在水稻中的组织表达特性。余艳等[10]利用水稻基因芯片筛选到1个全新的叶片特异性不表达的启动子,并通过GUS组织化学染色分析验证其功能。【本研究切入点】虽然已有不同来源的组织特异性启动子被研究利用,但在棉花中的报道相对较少[11-13]。本研究从陆地棉(GossypiumhirsutumL.)Coker 312中筛选出一个叶片特异性表达基因(Ghi.10424),同时采用染色体步移法分离该基因上游的启动子序列LSP (leaf specific promoter),并通过农杆菌介导法将构建的Ghlsp启动子表达载体转化拟南芥,对转基因株系进行GUS组织化学染色分析,验证启动子的组织表达特异性。【拟解决的关键问题】为其进一步应用于棉花分子改良育种提供重要的理论依据。
1 材料与方法
1.1 植物材料
供试材料为陆地棉Coker 312,由中国科学院遗传与发育学研究所实验室提供,并由新疆农科学院棉花研究所保存。实验材料选取生长15 d左右的棉花幼苗,采用CTAB/酸酚法分别提取棉花的根、茎和真叶的总RNA[14],交由博奥生物有限公司完成基因表达谱芯片,其余用来合成cDNA进行基因的组织特异性分析以及全长扩增和序列测定。
1.2 试剂、质粒与菌株
大肠杆菌(Escherichiacoli)DH5α、植物表达载体pPZP111,农杆菌(Agrobacteriumtumefaciens)GV3101由中国科学院遗传与发育学研究所实验室提供。Genome Walking Kit (D316)、克隆载体pMD18-T购自TaKaRa公司,琼脂糖凝胶回收试剂盒、DNA Marker、TaqDNA聚合酶购自北京康为世纪生物技术公司,限制性内切酶与T4DNA ligase 购自Fermentas公司,其他试剂均为进口或国产分析纯试剂。引物合成、测序均由上海英俊生物技术有限公司完成。
1.3 试验方法
1.3.1 棉花基因组DNA的提取 以棉花的幼叶为材料提取DNA,采用改良的CTAB法[15]。
1.3.2 陆地棉叶片特异表达基因的筛选及扩增 以陆地棉基因表达谱芯片为参考,初步筛选出一个叶片特异性表达的基因Ghi.10424。将此表达序列标签ESTs(expressed sequence tags)序列在NCBI上Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,搜索UNIGENE数据库对相似序列进行聚类,将两端含有重叠序列的ESTs组装成一个叠连群进行电子拼接装配,得到一条完整的cDNA序列。根据Lasergene软件搜索基因开放阅读框ORF(Open Reading Frame),并通过同源基因在蛋白水平上的比对以及基因是否含有上游非编码区特有序列、编码框下游是否有polyA加尾信号等,以此判定所得cDNA序列即为基因全长。根据电子拼接序列设计引物10424-F1及10424-R1(表1)进行半定量RT-PCR分析,以棉花肌动蛋白Actin为内参基因,引物为已发表Pactin-F、Pactin-R[16];并根据该基因的最大开放阅读框(ORF)设计引物10424-F及10424-R进行基因全长扩增。
1.3.3 Genome walking法扩增GhLsp启动子序列 利用基因特异性引物从基因组DNA中扩增GhLsp进行序列测定,并根据经验证的已知序列区(最好不少于500 bp)依次设计从3′端到5′端的3条特异性引物:SP1、SP2、SP3(表1)。由于一次扩增得不到启动子全长,还需根据扩增结果设计引物,朝3′端方向继续扩增,因此又分别设计了第2轮及第3轮扩增的SP1、SP2、SP3特异性引物。将3轮扩增所得序列用DNAstar软件进行拼接和组装获得启动子全长序列,设计引物GhLsp-F、GhLsp-R1 与GhLsp-R2,并在上下游引物中分别引入PstI /XbaI酶切位点。
染色体步移法具体操作步骤参照TaKaRa公司的Genome Walking Kit说明书,根据具体情况略有变动。以基因组DNA为模板,用AP1、AP2、AP3及AP4 Primer分别与特异性SP1 Primer进行第1轮PCR;将1stPCR反应液稀释100倍后,取1 μl作为2ndPCR反应的模板,分别以AP1、AP2、AP3、AP4 Primer为上游引物,SP2 Primer为下游引物,进行第2轮PCR反应。将2ndPCR反应液稀释100倍后,取1 μl作为3rdPCR反应的模板,分别以AP1、AP2、AP3、AP4 Primer为上游引物,SP3 Primer为下游引物,进行第3轮PCR反应。用高保真酶KOD FX(TOYOBO)进行启动子PCR扩增,将扩增产物进行回收,连接到pMD 18T(TaKaRa)载体并测序验证。对测序正确的阳性克隆提取质粒,命名pMD 18T-GhLsp。高保真酶KOD FX(TOYOBO)扩增反应体系:2×PCR Buffer 25 μl;2 mmol·L-1dNTPs 10 μl;KOD FX 1 μl;模板1 μl;正反向引物各1 μl,补充水至50 μl。反应条件为94 ℃ 2 min;98 ℃ 10 s;58 ℃ 30 s;68 ℃ 2 min,30个循环;68 ℃ 5 min。
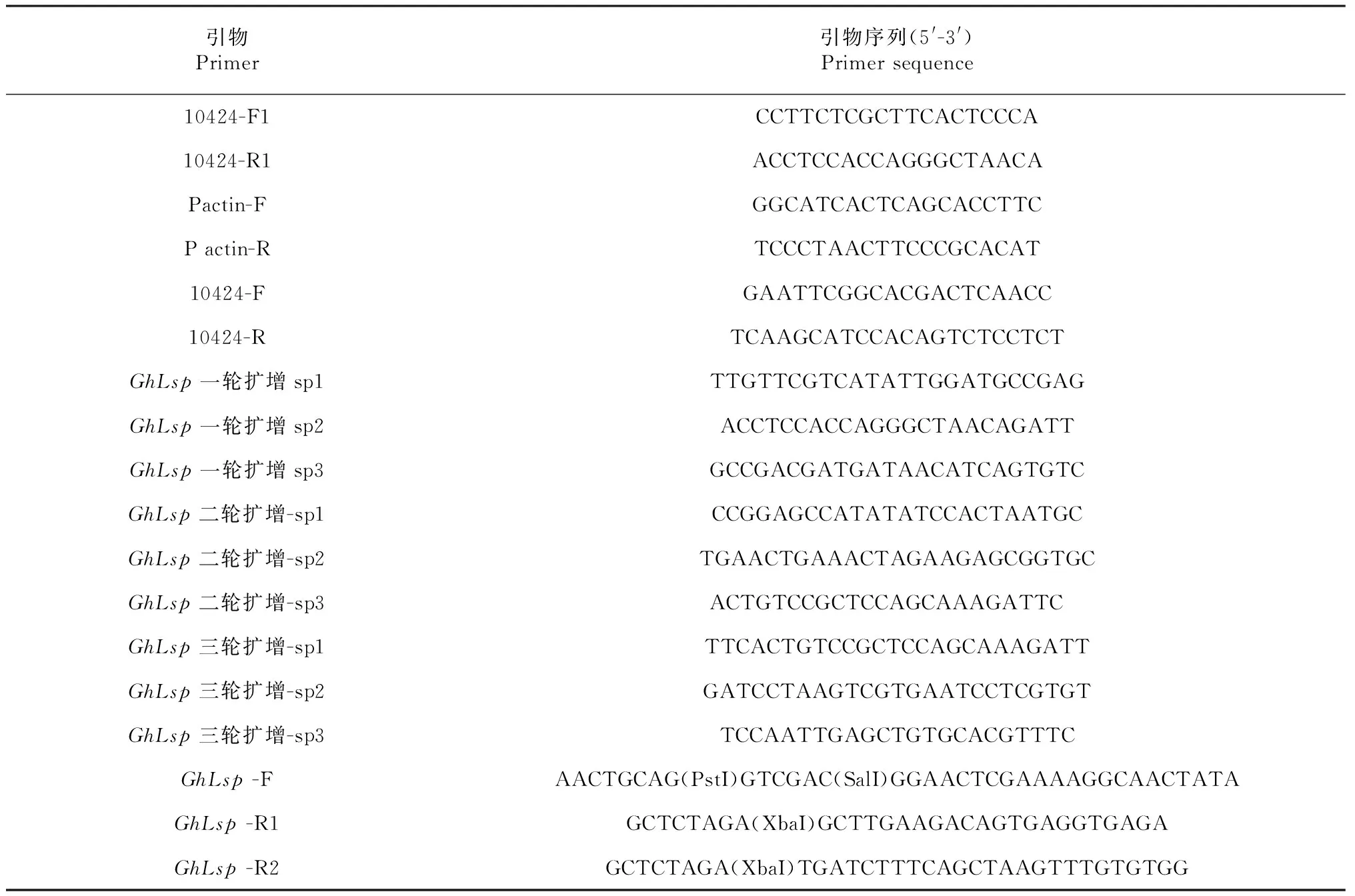
表1 本研究所用的引物
1.3.4 叶片特异性表达载体Ppzp111-Ghlsp构建及植物转化 用引物GhLsp-F分别与GhLsp-R1和GhLsp-R2组合,从棉花C312的DNA基因组中扩增10424启动子。GhLsp1为包含ATG后42 bp的启动子序列,GhLsp2为不含ATG的启动子序列。用限制性内切酶BamH I和EcoR I将GUS及NOS片段从植物表达载体pBI121上切下,同时双酶切植物表达载体pPZP111,用T4DNA连接酶将GUS及NOS片段连接至pPZP111载体,获得改造质粒载体pPZP111-GUS。再用PstI、xbaI双酶切载体 pPZP111-GUS和重组pMD 18T-GhLsp,分别将2个promoter片段和质粒载体pPZP111-GUS大片段连接,转化大肠杆菌并鉴定阳性克隆,从而最终获得叶片特异性表达载体pPZP111-Ghlsp(图1)。利用冻融法将pPZP111-Ghlsp载体转化农杆菌GV3101,并通过农杆菌介导法转化拟南芥col生态型,同时将植物表达载体pBI121转化拟南芥作为阳性对照。
1.3.5 陆地棉GhLsp启动子的GUS活性分析 将经过卡那霉素筛选的转基因拟南芥T1代移栽蛭石中培养,随机取T1代植株的花序、角果用于GUS组织化学染色分析;分别取生长10与30 d的T2代转基因幼苗用于GUS组织化学染色分析,方法参照[17]。将植物材料置于含有X-Gluc反应液(50 mmol/L磷酸钠缓冲液,pH 7.0;0.5 mmol/L K3[Fe( CN)6];0.5 mmol/L K4[Fe(CN)6];10 mmol/L EDTA ;0.1 % Triton X-100;2 mmol/L X-gluc)的离心管中,抽真空20 min,37 ℃染色0.5 h,最后用70 %乙醇脱色,然后观察拍照。
2 结果与分析
2.1 叶片特异表达基因的筛选及基因扩增
通过对棉花叶片、根、茎cDNA进行RT-PCR分析,发现Ghi.10424基因在叶片中表达量较高,在茎段有少量表达,在根部几乎不表达(图2);在NaCl的胁迫下Ghi.10424基因表达量较弱,随着时间的延长表达量逐渐降低,12 h后达到最高值;在PEG6000的处理下几乎看不到其表达,由此说明Ghi.10424为叶片特异性表达基因。
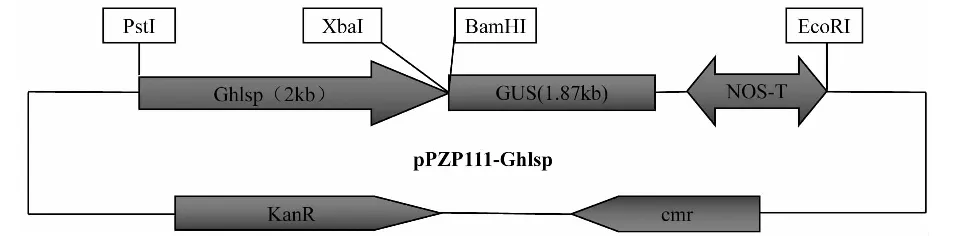
图1 表达载体pPZP111-Ghlsp的构建Fig.1 Construction of the expression vector pPZP111-Ghlsp

R: 根; S: 茎; L: 叶R: Root; S: Stem; L: Leaf图2 Ghi.10424基因不同组织的半定量RT-PCR检测Fig.2 Semi-quantitative analysis of Ghi.10424 under different tissues

图3 NaCl(200 μM)胁迫下Ghi.10424基因的半定量RT-PCR检测(h)Fig.3 Semi-quantitative analysis of Ghi.10424 under NaCl treatment of different period
2.2 陆地棉GhLsp启动子序列的扩增
将第三轮PCR反应结束后的产物经1.0 %琼脂糖凝胶电泳,结果见图5。启动子第1轮扩增得到1.5 kb(图5A),启动子第2轮扩增得到400 bp(图5B),启动子第3轮扩增得到700 bp(图5C)。将3轮扩增产物进行拼接并除去重叠DNA序列,3轮扩增得到启动子序列总长度约2 kb(图5D)。

图4 PEG6000处理下Ghi.10424基因不同时期的半定量RT-PCR检测(h)Fig.4 Semi-quantitative analysis of Ghi.10424 under PEG6000 treatment of different period
2.3 陆地棉GhLsp启动子的序列分析
运用PlantCARE在线分析软件查找GhLsp启动子序列的重要顺式作用元件和叶片特异表达的序列,结果表明:GhLsp启动子序列具有典型的TATA框和CAAT框,分别位于转录起始位点上游-145和-182 bp处(图7与表2)。启动子序列除了含有核心元件及顺式元件外,还存在光反应元件、低温诱导元件、MYB干旱诱导结合位点等多个特异性作用元件。
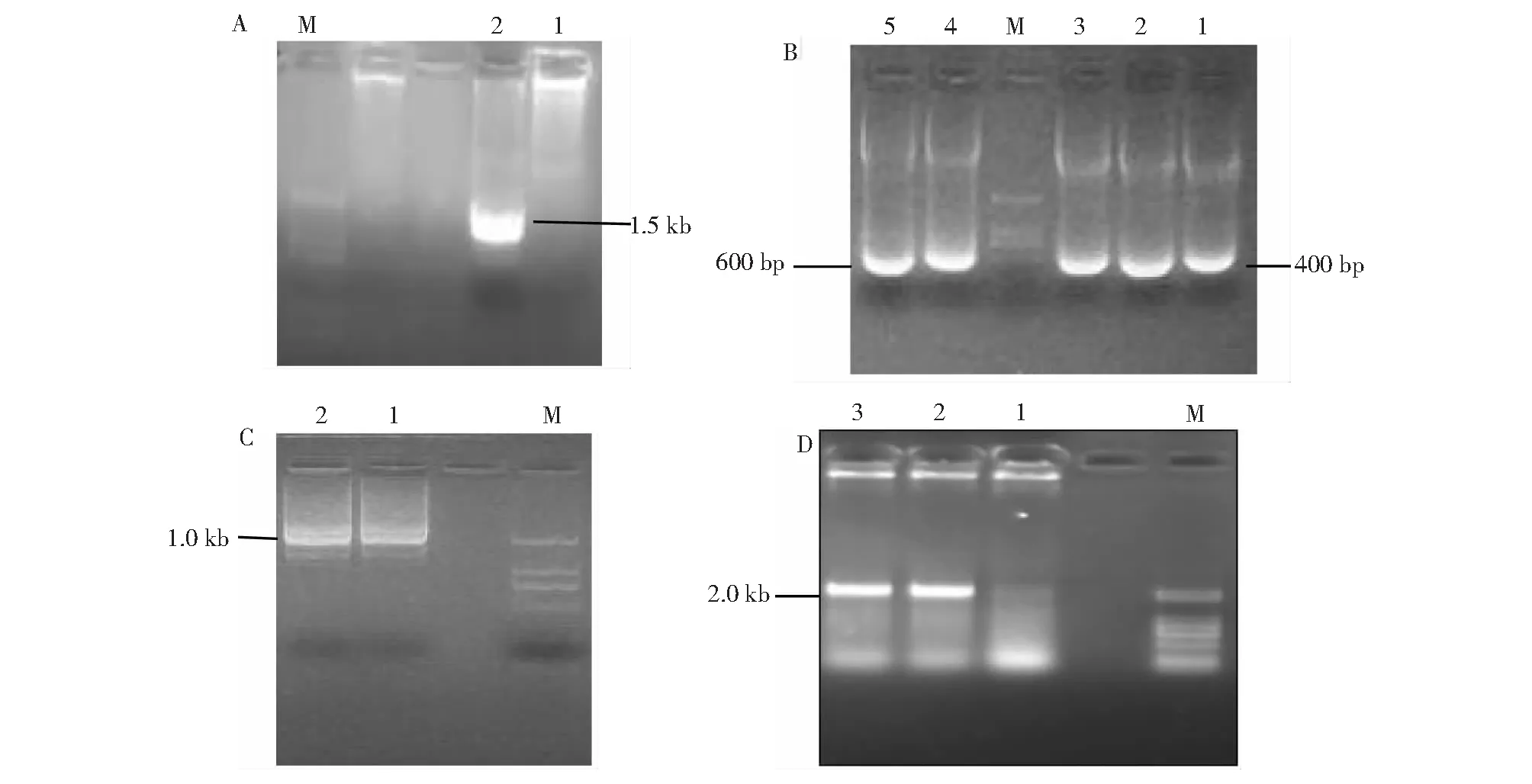
A:启动子第1轮扩增产物;M:DNA marker 2000;2:PCR第3轮扩增产物1.5 kb;B:启动子第2轮扩增产物;M:DNA marker 2000;1~3:PCR第3轮扩增产物400 bp;4~5:PCR第3轮AP2引物扩增产物;C:启动子扩增第3轮产物;M: DNA marker 2000;1~2:PCR第3轮扩增产物1.0 kb;D:启动子全长扩增;M:DNA marker 2000;1~3:启动子全长扩增到产物2.1 kbA: Promoter product for the first round; M: DNA marker 2000; 2: PCR product of the 3rd round;B: Promoter product for the second round; M: DNA marker 2000; 1-3: PCR product for the 3rd round;C: Promoter product for the third round; M: DNA marker 2000; 1-2: The 3rd round of PCR product;D: The full-length of promoter; M: DNA marker 2000; 2: The full-length of promoter product图5 GhLsp启动子的扩增Fig.5 Cloning of GhLsp promoter
图6 经过3次染色体步移获得GhLsp启动子序列Fig.6 Succeeded in getting the GhLsp promoter after three times of genome walking
2.4 植物表达载体的构建
将扩增启动子片段GhLsp1、GhLsp2分别连接中间载体pPZP111-GUS后转化大肠杆菌DH5a感受态,对转化子进行PCR检测及酶切鉴定,限制性内切酶BamHI/EcoRI双酶切片段与目标片段大小一致(图8),获得叶片特异性植物表达载体pPZP111-Ghlsp1及pPZP111-Ghlsp2。
2.5 陆地棉GhLsp启动子的GUS活性分析
将试验得到的转化Ghlsp启动子的拟南芥种子进行卡那霉素筛选,随机取T1代植株经过组织化学GUS染色发现,转化Ghlsp启动子的拟南芥仅叶片显示明显蓝色,而其他部位几乎不显色,但阳性对照的野生型拟南芥的叶片、茎、根部、花、角果等均被染成蓝色(图9),说明Ghlsp启动子特异性地启动GUS基因在叶片中表达。
3 讨 论
近年来,从拟南芥、水稻、马铃薯等植物中已克隆很多组织特异表达启动子,可以有目的地提高转基因植物特定组织的基因表达量进而改善其品质。颜彦[18]从水稻中获得一个绿色组织特异表达启动子GSP,并通过缺失载体的构建鉴定出启动子核心区域;郭燕[19]从拟南芥基因组中筛选出1个叶片特异性表达和2个角果特异性表达的启动子,并转化拟南芥验证其功能;瞿韵[20]从马铃薯中分离出一个光诱导型茎叶特异表达启动子。虽然人们一直没有停止对新型启动子的发现和探索,但已有的研究大都局限于拟南芥、水稻等模式植物,而在重要经济作物棉花中却研究的相对较少。刘峰[12]从新陆早33号中获得Lea(Late embryogenesis abundant)基因的种子特异性启动子,实验证明其驱动GUS基因在种子中特异表达;王芳[13]通过转基因拟南芥GUS表达分析证明棉花α球蛋白A基因启动子是一个种子特异性启动子;琦明玉[11]从亚洲棉中克隆了Lea蛋白基因D113、D34基因的启动子,生物信息学分析证明该启动子具有较高种子特异性。综上所述,在棉花基因工程研究中越来越多的棉花内源启动子被开发出来,但关于棉花叶片特异性表达启动子的研究,有关的报道相对较少。棉花叶片是进行光合作用的主要器官,在能量的固定和利用中起着十分重要的作用,叶片特异性启动子可以使基因表达产物富集在叶片中,增加目的基因在叶片中的表达量,不仅可以减少棉花无需的物质能量消耗,有效改善光合作用,而且可以有目的地改良棉花的品质和产量。

图7 GhLsp启动子序列的分析Fig.7 The sequence analysis of GhLsp promoter
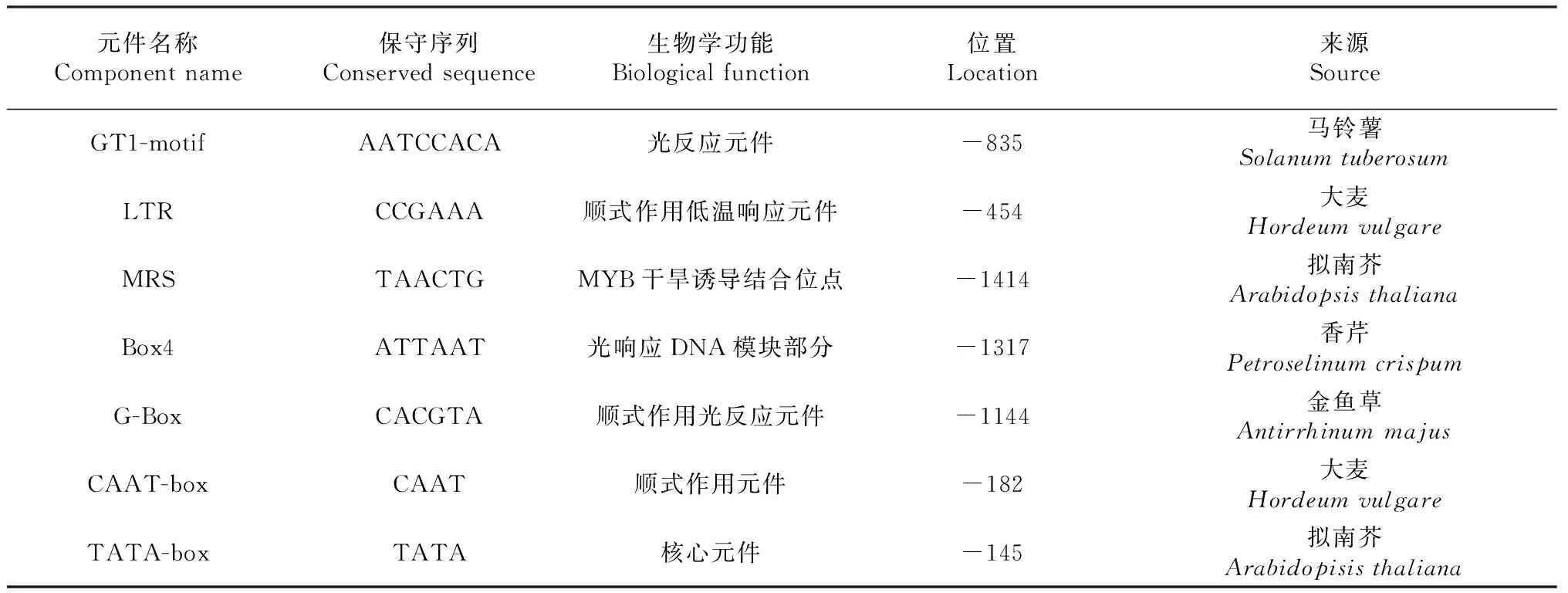
元件名称Component name保守序列Conserved sequence生物学功能Biological function位置Location来源SourceGT1-motifAATCCACA光反应元件-835马铃薯Solanum tuberosumLTRCCGAAA顺式作用低温响应元件-454大麦Hordeum vulgareMRSTAACTGMYB干旱诱导结合位点-1414拟南芥Arabidopsis thalianaBox4ATTAAT光响应DNA模块部分-1317香芹Petroselinum crispumG-BoxCACGTA顺式作用光反应元件-1144金鱼草Antirrhinum majusCAAT-boxCAAT顺式作用元件-182大麦Hordeum vulgareTATA-boxTATA核心元件-145拟南芥Arabidopisis thaliana
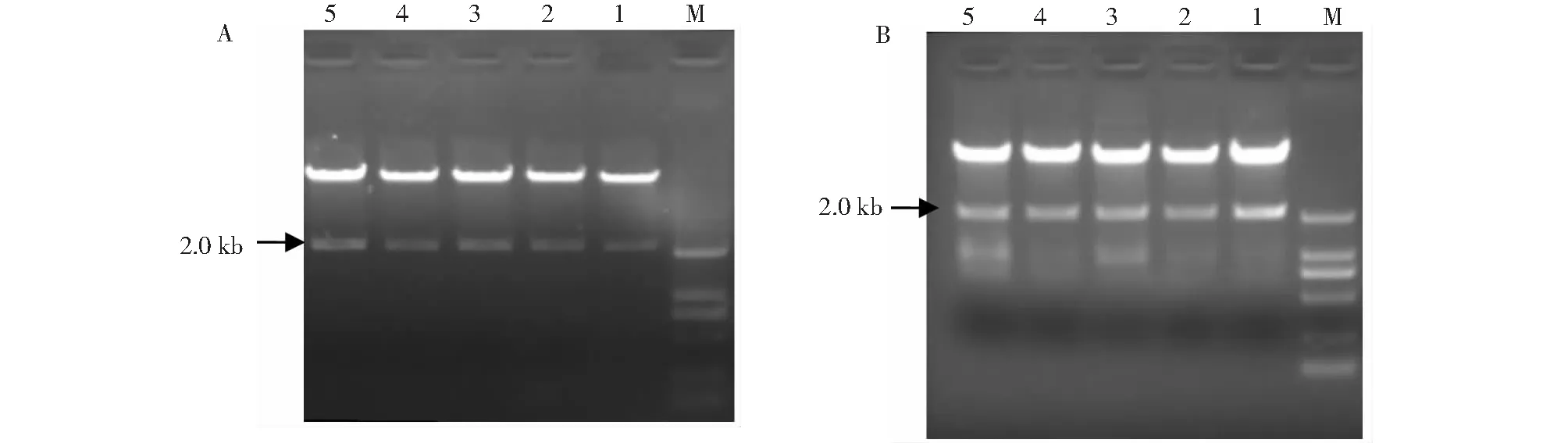
A:pPZP111中间载体的构建;M:DNA marker 2000;1~5:转化质粒BamHI/EcoRI双酶切。B:叶片特异性表达载体的构建;M:DNA marker 2000;1~5:转化质粒PstI/xbaI双酶切A: Construction of pPZP111 intermediate vector; M: DNA marker 2000; 1-5: double digestion of BamHI / EcoRI for transformed plasmid.B: Construction of leaf-specific expression vector; M: DNA marker 2000; 1-5: double digestion of PstI / xbaI for for transformed plasmid图8 植物表达载体pPZP111的构建Fig.8 The construction of plant expression vector pPZP111

A.幼苗期拟南芥GUS组织染色分析;B.莲座期拟南芥GUS组织染色分析;C.拟南芥的角果与花的GUS组织染色分析A.GUS staining analyisis of Arabidopsis thaliana in seedling stage;B.GUS staining analyisis of Arabidopsis thaliana in rosette stage;C.GUS staining analyisis of silique and flower in Arabidopsis thaliana图9 GUS活性的组织染色分析Fig.9 Tissure staining analysis of GUS activity
4 结 论
本研究从陆地棉(GossypiumhirsutumL.)Coker 312克隆了1个叶片特异表达启动子序列,命名为LSP (leaf specific promoter),通过转化拟南芥进行GUS活性染色分析证实GhLsp特异性在叶片中表达。PlantCARE在线分析表明,GhLsp启动子序列除了含有核心元件及顺式元件外,还存在光反应元件、低温诱导元件及MYB干旱诱导结合位点等多个特异性作用元件。作为起重要调控作用的光诱导启动子,这一类启动子在生物反应器的研发以及在抗虫、抗病、抗旱、抗高渗胁迫等抗逆特性的转基因植物优良品种选育等方面具有很大潜力,能使得外源基因表达的定时、定点、定量三维精确调控,可通过利用棉花内源启动子本身的特性,进而启动耐旱、抗虫等改良基因在棉花中的高效表达。本研究为外源基因在棉花叶片中的定位表达研究奠定基础,不仅在改良棉花性状的同时减少对棉花生理方面的副作用,而且为今后棉花分子育种及相关启动子的开发与筛选提供了一种可行的方法和新的视野,将在棉花抗逆转基因育种中将会得到更加广泛的应用。
参考文献:
[1]谢德意. 转基因抗虫棉研究进展、问题及对策[J].中国棉花,2001,28(2):6-8.
[2]侯丙凯,陈正华. 植物抗虫基因工程研究进展[J].植物学通报2000,17(5):385-393
[3]Liu Y G, Whittier R F. Thermal asymmetric interlaced PCR:automatable amplification and sequencing of insert end fragments from P1 and YAC clones for chromosome walking[J]. Genomics. 1995, 25(3):674-81.
[4]Tan G H, Gao Y, Shi,M ,et al. SiteFinding-PCR: a simple and efficient PCR method for chromosome walking[J]. Nucleic Acids Research, 2005, 33(13 ): e122.
[5]包秋华,王 磊,牛一丁,等. 甜瓜黄瓜素基因启动子表达载体的构建及分析[J].西北植物学报, 2011,31(11): 2153-2157.
[6]张金辉,龙 海,邓光兵,潘志芬,余懋群.水稻花药特异表达启动子的克隆与活性检测[J].应用与环境生物学报,2008,14(3): 328-331.
[7]王奇峰, 胡清泉, 赵 玥,等. 光诱导和组成型启动子控制柠檬酸合酶基因过量表达对转基因烟草耐铝性影响的比较[J]. 浙江大学学报(农业与生命科学版), 2011, 37(1):31-39.
[8]宋 阳,王丕武,张学明,等. 大豆豆荚特异性启动子的克隆及功能分析[J].西北农林科技大学学报:自然科学版,2014(10):63-69.
[9]张利东,朱 骞,董陈文华,等.水稻GOS2基因高活性启动子的分离及其在叶片中的特性鉴定[J].分子植物育种,2015,13(1):32-38.
[10]余 艳, Pedro, S.C.F.Rocha,等.水稻叶片特异性不表达启动子pOsMTG3的克隆与表达分析[J].杂交水稻, 2016(1):45-50.
[11]琦明玉,陆才瑞,邹长松,等.棉花种子特异性启动子的克隆及表达载体构建[J]. 棉花学报2011,23(5):427-432.
[12]刘 峰, 汪小东, 赵彦鹏,等. 棉花种子特异表达的LEA启动子克隆及功能验证[J]. 棉花学报, 2014, 26(4):310-317.
[13]王 芳, 魏琦超, 张 锐,等. 棉花种子特异表达α球蛋白A基因启动子的功能分析[J]. 棉花学报, 2016, 28(3):189-198.
[14]宋国立,崔荣霞,王坤波,等.改良CTAB法快速提取棉花DNA[J].棉花学报,1998,10(5):273-275.
[15]蒋建雄,张天真.利用CTAB/酸酚法提取棉花组织总RNA[J].棉花学报,2003,15(3):166-167.
[16]Jie-Yin Chen, Xiao-Feng Dai.Cloning and characterization of the Gossypium hirsutum major latex protein gene and functional analysis in Arabidopsis thaliana[J]. Planta, 2010, 231(4):861-873.
[17]Jefferson R A. Assaying chimeric genes in plants:The GUS gene fusion system. Experimental protocols[J]. Plant Mol Biol Re,1987, 5:387-405.
[18]颜 彦,林拥军.一个水稻鞘叶特异表达启动子的克隆及功能鉴定[J].农业生物技术学报,2013, 21(7): 757-763
[19]郭 燕,詹高森,杨晓燕,华玮,吕应堂.拟南芥叶片和角果特异性启动子的筛选与分析[J].中国油料作物学,2015,37(1);001-008.
[20]瞿 韵,张 宁,常 璟,等.马铃薯光诱导型茎叶特异表达启动子ST-LS 1的克隆与功能分析[J].农业生物技术学报,2013,21(7): 828-837.
[21]曾小林,刘传亮,张朝军,等.启动子在棉花基因工程中的应用与研发[J].分子植物育种,2009,7(6):1193-1199.
[22]CUMMINS J,Ho M W,Ryan A,et al.Hazardous CaMV promoter[J].Nature Biotechnol,2000,18(4):363.
[23]王 淼, 王旭静, 唐巧玲,等. 高等植物绿色组织特异表达启动子研究进展[J]. 中国农业科技导报, 2010, 12(2):33-37.

