应用琼脂糖微球抗体筛选原代乳鼠肺微血管内皮细胞新方法的建立
刘姗,刘艳霞,闫承慧,田孝祥,刘丹,刘美丽,张坡,韩雅玲
血管内皮细胞覆盖于血管内膜表面,是研究血管生物学的常用模型。血管内皮细胞不仅是血液与血管之间的机械屏障,还分泌缩血管因子和舒血管因子与自身细胞受体结合,在血管通透性、炎症反应、血管生长等方面发挥重要作用[1-3]。微血管内皮细胞是研究血管生长、通透性等的重要模型[4-6]。本研究采用琼脂糖微球抗体筛选法,建立了一种简便、高效的分离肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)的方法,现报告如下。
1 材料与方法
1.1 实验动物 小于1周龄的清洁级健康C57BL/6乳鼠(购自辽宁长生生物有限公司),实验动物许可证号:SCXK(辽)2015-0001。
1.2 主要试剂与仪器 蛋白A/G琼脂糖微球、Hanks液、胶原酶Ⅰ(美国Thermo Scientific公司),大鼠抗小鼠CD31抗体(美国BD Pharmingen公司),BSA牛血清白蛋白、CCK-8(中国Beyotime公司),异氟烷(中国河北一品制药股份有限公司),内皮细胞培养基、胎牛血清、抗生素、生长因子(美国Sciencell公司),胰蛋白酶(中国上海生工公司),明胶(美国Sigma公司),基质胶(美国Corning公司),山羊抗CD31抗体、兔抗血管性血友病因子(vWF)抗体、Cy3山羊抗兔荧光二抗、Cy3驴抗山羊荧光二抗、DAPI、抗荧光淬灭封片剂(中国谷歌生物公司),常温离心机(英国Grant-Bio公司),低温离心机、酶标仪(德国Eppendorf公司),旋转混合仪(中国宁波新芝公司),倒置相差显微镜、共聚焦显微镜(日本Olympus公司),CO2培养箱(德国Heraeus公司)。
1.3 乳鼠PMVECs的分离与培养
1.3.1 制备CD31抗体琼脂糖微球 在超净台内,取无菌EP管,将20μl琼脂糖微球加入400μl 0.1%BSA溶液中,将EP管置于旋转混合仪上旋转1min;静止5min后吸除上清,用0.1% BSA重悬,置于旋转混合仪旋转。该操作重复3次,尽量去除琼脂糖微球溶液中对细胞有害的叠氮化钠。上述EP管中加入10μl的CD31抗体,制备成CD31抗体琼脂糖微球,置于旋转混合仪上旋转混合,于4℃冰箱内孵育过夜。
1.3.2 原代PMVECs的培养 将乳鼠用异氟烷麻醉后,以75%乙醇浸泡处死。在超净台内解剖乳鼠,用无菌生理盐水冲洗肺脏,尽量去除血细胞,取肺脏边缘组织置于含有Hanks液的100mm培养皿中。然后用无菌剪刀尽量将肺脏剪碎约1min。先将25ml的0.2%胶原酶置入50ml离心管中,在37℃水浴箱中预热。再将剪好的肺脏放入预热的胶原酶中,在37℃、200r/min的摇床内孵育45min。用无菌的玻璃研磨器研磨肺组织悬液,小心避免起泡沫。将研磨后的肺组织放入无菌的15ml离心管中,4℃、1300r/min离心8min,吸尽上清及未研碎的组织,剩下细胞沉淀。用1ml的0.1%冰BSA溶液重悬细胞,4℃、1300r/min离心8min,吸尽上清,剩下的沉淀为肺内混合细胞(本步骤重复3次)。用1ml的PBS溶液重悬细胞,吸至新的1.5ml无菌EP管中,再加入50μl CD31抗体琼脂糖微球,将EP管置于旋转混合仪中,室温旋转混合10min,使PMVECs特异性地与CD31抗体琼脂糖微球结合。1000r/min离心2min后,混合液分3层,吸尽上清及下层未与微球结合的细胞,留取中层微球至新的EP管中。用1ml的内皮细胞培养基重悬微球细胞,尽量使细胞与微球分离,将混合液加入含1ml内皮细胞培养基的6孔板(0.1%明胶包被)中。PMVECs的分离示意图见图1。
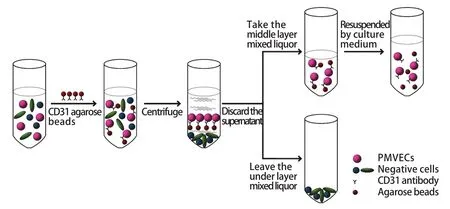
图1 PMVECs分离示意图Fig.1 Sketch of isolating PMVECs
1.3.3 传代培养 细胞贴壁后,用PBS洗3次,更换新鲜的内皮细胞培养基,去除残留的微球。当内皮细胞融合达到80%时,吸尽培养基,PBS洗3次,加入0.25%胰酶消化3min,加入内皮细胞培养基及时终止消化。1000r/min离心5min,用内皮细胞培养基重悬细胞,按照1:2比例传代至6孔板内。
1.4 形态学观察 用倒置显微镜观察细胞生长状态和形态学变化。将倒置显微镜调至100倍放大倍数,观察单个细胞形态及整体细胞生长情况并拍照。
1.5 细胞鉴定
1.5.1 免疫荧光染色 用免疫荧光染色法分别检测CD31、vWF的表达。用第2代细胞制备细胞爬片。4%多聚甲醛固定15min,PBS洗3次,0.2% Triton X-100穿膜通透15min,PBS洗3次,5%山羊血清封闭,室温孵育30min。加入CD31抗体(1:100)100μl,4℃冰箱内孵育过夜。PBS洗3次,加入Cy3驴抗山羊荧光二抗(1:100)100μl,室温避光孵育1h。PBS洗3次。DAPI(1:1000)100μl染细胞核30s。最后用抗荧光淬灭封片剂封片,荧光显微镜观察、拍照。vWF免疫荧光染色方法同上,采用Cy3山羊抗兔荧光二抗。两种抗体免疫荧光染色各随机选取5个视野,重复3次,分别计算PMVECs阳性率。PMVECs阳性率=(阳性细胞数/细胞总数)×100%
1.5.2 PMVECs体外血管形成实验 实验前1d将基质胶放在冰上,置于4℃冰箱过夜融化。用预冷的枪头取出基质胶,在24孔板上每孔加入289μl基质胶。将24孔板置于37℃培养箱内孵育30min,使基质胶凝固。轻轻滴加PMVECs细胞悬液300μl(105个细胞)。采用倒置显微镜每隔2h观察1次PMVECs的体外血管形成情况。
1.6 CCK8法绘制PMVECs生长曲线 取第2代PMVECs以每孔5000个细胞接种在96孔板上。实验分为对照组和PMVECs组,每组设3个复孔。在细胞贴壁后,吸出原培养基,加入10μl CCK-8溶液和新鲜内皮细胞培养基90μl,在37℃培养箱内孵育2h,检测450nm波长处的吸光度(OD)值。同法连续测7d。绘制PMVECs的生长曲线。
2 结 果
2.1 PMVECs的形态学观察结果 PMVECs贴壁24h后,倒置显微镜下可见细胞呈短梭形、类圆形贴壁生长(图2A);PMVECs贴壁72h后,可见细胞单层融合呈典型铺路石样排列(图2B)。
2.2 细胞鉴定
2.2.1 细胞免疫荧光染色 山羊抗CD31抗体免疫荧光染色后,胞质呈红色荧光,DAPI染细胞核呈蓝色荧光(图3A)。兔抗vWF抗体免疫荧光染色后,胞质呈红色荧光,DAPI染细胞核呈蓝色荧光(图3B)。两种内皮细胞特异性抗体CD31、vWF均表达阳性,证实培养的细胞为PMVECs。通过随机选取5个视野,重复3次,CD31染色PMVECs阳性率为91.35%±3.06%,vWF染色PMVECs阳性率为92.99%±2.67%。
2.2.2 PMVECs体外血管形成实验 PMVECs接种至基质胶,每隔2h观察1次,发现在接种8h后,已完整形成血管网状结构(图4)。
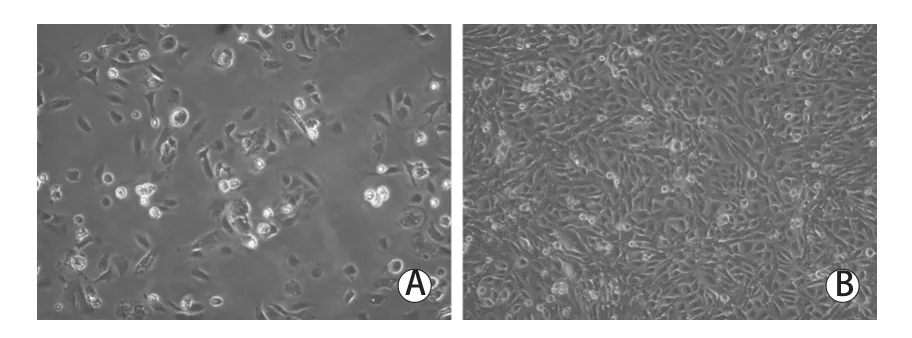
图2 倒置显微镜下观察的细胞形态学结果(×100)Fig.2 Morphology of PMVECs (Inverted microscope ×100)

图3 免疫荧光染色结果(×100)Fig.3 Immunofluorescence staining of PMVECs (×100)

图4 PMVECs接种8h后基质胶上形成的血管管状结构(×40)Fig.4 Vascular tubular structure formed on matrigel 8h after inoculation of PMVECs (×40)
2.3 CCK8法绘制生长曲线 PMVECs接种后前2d,细胞贴壁生长,细胞增殖较为缓慢。接种后2~5d,细胞处于对数期生长。接种后7d,细胞增殖减慢,甚至出现凋亡现象(图5)。
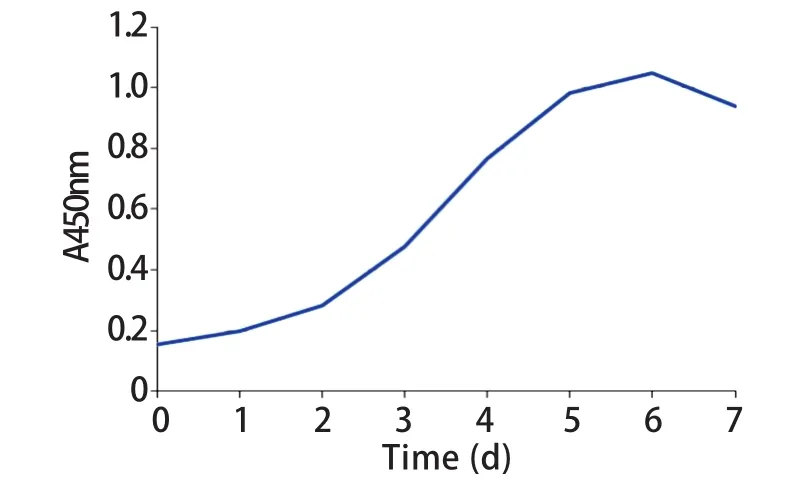
图5 CCK8法绘制的生长曲线Fig.5 Growth curve drawn by CCK8 method
3 讨 论
获取微血管内皮细胞的常用方法有组织块贴壁法[7]、酶消化法[8]、免疫磁珠法[9]。通过组织块贴壁法获得的PMVECs培养时间长,首次传代时间为13.0±0.7d。通过酶消化法获得的PMVECs阳性率(61.05%±7.38%)不高[10]。通过免疫磁珠法获得的PMVECs虽然细胞纯度较高,但操作需有特殊仪器,且试剂比较昂贵。本研究采用的CD31抗体琼脂糖微球法是通过抗原抗体结合的方式筛选出PMVECs,具有培养时间短、阳性率高、操作简便等优势,首次传代时间少于4d,PMVECs阳性率超过90%。
蛋白A/G琼脂糖微球是将蛋白A/G共价耦联在固体载体琼脂糖微球上,常用于免疫沉淀或免疫共沉淀实验,对蛋白功能进行研究。CD31被称为血小板内皮细胞黏附分子,主要表达于内皮细胞、血小板、巨噬细胞,被认为是一种不成熟和成熟的血管内皮细胞标记物[11]。CD31的同种型是IgG2a,与蛋白A/G的结合属于强结合[12]。蛋白A/G琼脂糖微球和CD31抗体预先孵育,使微球能够特异性吸附抗原,而PMVECs细胞表面存在与CD31抗体结合的特异性抗原,这样就可以通过琼脂糖微球将PMVECs吸附分离出来。本方法重复多次,均可成功分离、培养出PMVECs。
在本实验的PMVECs培养过程中需要注意以下5个方面:①选用1周内的乳鼠,其细胞增殖能力强,可缩短细胞培养周期。细胞在3代以内生长快且形态稳定,可用于实验研究。②采用0.1%明胶包被6孔板,有利于细胞的贴壁生长。分离培养过程中,有时混杂少量成纤维细胞,采用内皮细胞专用培养基、内皮细胞生长因子,可抑制成纤维细胞的生长。另外,采用差速消化法,传代过程中胰酶消化3min及时终止消化,此时大多数内皮细胞被消化下来,而成纤维细胞仍旧贴壁。③选用胶原酶Ⅰ,能温和地将研磨后的肺组织消化成单个细胞,优于其他消化酶。④CD31表达于内皮细胞表面,其免疫荧光染色阳性是内皮细胞的经典鉴定方式。vWF仅在内皮细胞、血小板、巨核细胞和合体滋养细胞中表达,在内皮细胞中存储于杆状Weibel-Palade小体中,可产生核周染色[13]。⑤基质胶是从Engelbreth-Holm-Swarm小鼠肉瘤(富含细胞外基质蛋白)中提取的,其主要成分是层粘连蛋白,其次是Ⅳ型胶原、硫酸乙酰肝素蛋白多糖等。实验证明内皮细胞借助基质胶可形成血管管状结构[14]。
综上,本实验室采用琼脂糖微球抗体筛选法分离、培养乳鼠原代PMVECs,方法简便、高效,是一种值得推广的分离培养乳鼠PMVECs的新方法,为血管功能研究等提供了参考。
[1]Xia L, Ding F, Zhu JH, et al. Resveratrol attenuates apoptosis of pulmonary microvascular endothelial cells induced by high shear stress and proinflammatory factors[J]. Hum Cell, 2011, 24(3):127-133.
[2]Sakaue T, Maekawa M, Nakayama H, et al. Prospect of divergent roles for the CUL3 system in vascular endothelial cell function and angiogenesis[J]. J Biochem, 2017, 162(4): 237-245.
[3]Pan ZG, Shao Y, Geng Y, et al. Influence of ulinastatin on the proliferation of vascular endothelial cells and IL-6 and TNF-α release under heat stress[J]. Med J Chin PLA, 2015, 40(5): 362-365. [潘志国, 邵玉, 耿焱, 等. 乌司他丁对热打击血管内皮细胞增殖及炎症因子释放的影响[J]. 解放军医学杂志, 2015,40(5): 362-365.]
[4]Sobczak M, Dargatz J, Chrzanowska-Wodnicka M. Isolation and culture of pulmonary endothelial cells from neonatal mice[J]. J Vis Exp, 2010, (46): pii2316.
[5]Liu YN, Xu QL, Guo XH, et al. Effects of MAPKs signaling on heat stress-induced apoptosis of pulmonary microvascular endothelial cells and its mechanism[J]. Med J Chin PLA, 2017,42(4): 279-284. [刘亚楠, 徐秋林, 郭晓华, 等. MAPKs家族在中暑小鼠肺微血管内皮细胞凋亡中的作用及机制研究[J].解放军医学杂志, 2017, 42(4): 279-284.]
[6]Yu BJ, Peng N, Gu ZT, et al. Role and mechanism of endoplasmic reticulum stress and Ca2+overload in pulmonary endothelial cell damage induced by heat stress[J]. Med J Chin PLA, 2017,42(6): 488-494. [余保军, 彭娜, 古正涛, 等. 内质网应激和Ca2+超载在热打击诱导的肺微血管内皮细胞损伤中的作用与机制[J]. 解放军医学杂志, 2017, 42(6): 488-494.]
[7]Huang CX, He T, Xing YQ. Primary cultivation of mouse pulmonary microvascular endothelial cells by improved adherence method combined with endothelial cell culture medium[J]. Chin J Tissue Eng Res, 2012, 16(15): 2691-2694.[黄偲璇, 贺涛, 邢怡桥. 改良贴壁法结合内皮细胞培养基培养小鼠肺微血管内皮细胞[J]. 中国组织工程研究, 2012,16(15): 2691-2694.]
[8]Meng H, Zhu MZ, Huang C, et al. Culture and biological characteristics of rat myocardial microvascular endothelial cells[J]. Med J Chi PLA, 2008, 33(9): 1153-1154. [孟华, 朱妙章, 黄晨, 等. 大鼠心肌微血管内皮细胞的培养及其生物学特性[J]. 解放军医学杂志, 2008, 33(9): 1153-1154.]
[9]Mackay LS, Dodd S, Dougall IG, et al. Isolation and characterisation of human pulmonary microvascular endothelial cells from patients with severe emphysema[J]. Respir Res, 2013,14: 23.
[10]Zhou LP, Feng C, Tang XB, et al. Comparison of different methods for mouse pulmonary microvascular endothelial cells culture[J]. J Wenzhou Med Univ, 2016, 46(8): 590-593. [周玲萍, 冯成, 汤雪斌, 等. 免疫磁珠分选法原代培养小鼠肺微血管内皮细胞[J]. 温州医科大学学报, 2016, 46(8): 590-593.]
[11]Kato R, Mizuno S, Kadowaki M, et al. Sirt1 expression is associated with CD31 expression in blood cells from patients with chronic obstructive pulmonary disease[J]. Respir Res,2016, 17(1): 139.
[12]Maccarrone G, Bonfiglio JJ, Silberstein S, et al. Characterization of a protein interactome by co-immunoprecipitation and shotgun mass spectrometry[J]. Methods Mol Biol, 2017, 1546: 223-234.
[13]Hewett PW. Vascular endothelial cells from human microand macrovessels: isolation, characterization and culture[J].Methods Mol Biol, 2009, 467: 95-111.
[14]Benton G, Arnaoutova I, George J, et al. Matrigel: from discovery and ECM mimicry to assays and models for cancer research[J].Adv Drug Deliv Rev, 2014, 79-80: 3-18.

