基于对通透性及紧密连接的影响探讨益艾康对HIV/AIDS肠黏膜屏障损伤的保护作用*
桑 锋 李 强 钱洁玉 李 杰 刘 真岳静宇 沈俊岭 邓博文 李承乘 徐立然△
(1.河南中医药大学第一附属医院,河南 郑州 450000;2河南省病毒性疾病中医药防治重点实验室,河南 郑州 450000)
艾滋病患者肠道屏障功能严重受损,HIV感染使机体免疫功能过度激活,免疫细胞大量释放肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)等细胞因子,进而损伤肠道屏障功能,肠腔内的细菌及内毒素通过肠壁进入淋巴、血液及远隔器官,引起机体感染及损伤。因此,HIV在肠黏膜大量复制,损伤肠黏膜上皮屏障,导致肠道微生物易位,是全身免疫异常激活的重要原因[1-2]。益艾康胶囊是治疗艾滋病的临床经验复方,临床疗效肯定,尤其是减少腹泻等HIV/AIDS患者机会性感染发生频次,提高患者生存质量,降低病死率。本实验利用IFN-γ刺激Caco-2肠黏膜屏障体外模型模拟体内HIV损伤肠黏膜的病理过程,观察益艾康干预后,肠黏膜屏障的通透性和完整性的改变,探讨益艾康胶囊对肠黏膜的保护作用。现报告如下。
1 材料与方法
1.1 实验动物 SPF级Wistar雌性大鼠30只,体质量(230±20)g,由河南省实验动物中心提供,许可证号:SCXK(豫)2010-0002,饲养环境温度 20~25 ℃,相对湿度50%~65%。
1.2 试药与仪器 1)试药。Caco-2细胞:购自中国科学院上海细胞生物学研究所。DMEM高糖培养基、胎牛血清:Hyclone,Thermo 公司(美国)。 噻唑蓝(MTT):Sigma公司(美国)。 荧光素钠(粉剂):Sigma公司(美国)。益艾康胶囊:河南省中医药研究院提供,制剂批号:Lz05002。IFN-γ:Sigma公司(美国)。 兔抗 ZO-1多克隆抗体、小鼠抗β-Actin单克隆抗体、牛抗小鼠IgG二抗、山羊抗兔IgG二抗:Santa Cruz公司(美国)。2)仪器。CO2细胞培养箱:Termo 3111,美国。超净工作台:DL-CJ-2ND,哈尔滨东联。倒置荧光相差显微镜:Olympus CKX41-A32PH,日本。台式低速离心机:TD24-WS,长沙湘仪。电阻测定仪:Millipore Millicell-ERS,美国。酶标仪:BD 680,美国。
1.3 肠黏膜单层屏障模型的构建 Caco-2细胞接种在24孔Transwell培养板(0.4 μm孔径,0.65 cm直径)中,接种密度为 5×104个/cm2,每孔 200 μL,基底侧加入培养液800 μL,接种24 h后更换培养液,接下来1周隔天换液,1周后每日换液。细胞培养21 d后待用。
1.4 益艾康含药血清的制备 SPF级Wistar雌性大鼠随机分为空白对照组和益艾康组。益艾康组给药剂量按照正常成人临床等效剂量折算,大鼠灌服2.08 g/kg,空白组给予等量蒸馏水。每日2次,连续4 d。末次灌胃1 h后腹主动脉取血。分离血清,56℃灭活30 min,0.22 μm微孔滤膜过滤除菌后,分装,-80℃冰箱中保存备用。
1.5 不同浓度益艾康含药血清对Caco-2细胞活性和增殖的影响 取对数生长期Caco-2细胞接种于96孔培养板,细胞分为实验组和空白对照组,实验组分别加入含不同浓度益艾康含药血清的培养基(5%、10%、15%、20%,用空白鼠血清将各含药血清组按照最大浓度含药血清组所含血清量补足),空白对照孔加入空白鼠血清。分别培养 12、24、48、72 h 后,MTT 法检测各实验组细胞的增殖率。
1.6 益艾康含药血清对Caco-2单层细胞跨细胞电阻(TEER)的影响 细胞Caco-2细胞形成单层屏障后,用IFN-γ、益艾康含药血清进行干预并分组:空白对照组(空白鼠血清)、IFN-γ 组(模型组)、益艾康组、IFN-γ+益艾康组,每组3个复孔,设3个时相点:24 h、48 h、72 h。用电阻仪测量各组单层细胞不同时间点的跨膜电阻值。
1.7 益艾康含药血清对Caco-2单层细胞荧光素钠渗漏量的影响 分组方法同“1.6”项下方法。在相应时间点吸弃培养板内培养液,在腔侧加入荧光素钠(用Hanks液配制质量浓度为2 g/L)200 μL,基底侧加入Hanks液 800 μL,培养 2 h 后分别取样 100 μL,在激发波长427 nm,发射波长536 nm的条件下,检测荧光强度,根据标准曲线计算荧光素钠在基底侧转运液的浓度及渗透系数,荧光素钠渗漏率=基底侧荧光素钠漏出量/腔侧荧光素钠加入量×100%。
1.8 Western blot检测各组细胞总蛋白中ZO-1的表达变化 用细胞刮刮下Transwell腔侧的Caco-2单层细胞,PBS洗2次,RIPA裂解液裂解细胞,提取细胞总蛋白。按照BCA蛋白浓度测定试剂盒说明书进行蛋白定量。SDS-PAGE电泳,转膜,脱脂奶粉封闭,一抗(ZO-1)4℃孵育过夜,二抗室温孵育1 h,ECL孵育3~5 min,暗室曝光、显影、定影。扫描X光片上的蛋白条带,利用软件分析计算各条带的灰度值,以目的蛋白条带灰度值与内参蛋白(β-actin)条带灰度值的比值表示目的蛋白的相对表达量。
1.9 Real time PCR检测各组细胞ZO-1 mRNA的表达变化 收集Transwell腔侧的Caco-2单层细胞,PBS洗2次。试剂盒提取细胞总RNA,核酸蛋白测定仪测定样品RNA浓度和纯度,参照试剂盒说明书配置反转录体系,42℃30 min、85℃ 5 min进行反转录反应。引物由上海生工生物工程股份有限公司合成。GAPDH序列:上游 5′-AAGACCTTGGGCTGGGACTG-′3,下游 5′-TGGCTCGGCTGGCGAC-3′,产物 168 bp。ZO-1 序列:上游 5′-TTATTTGGGCTGTGGCGTGA-3′,下游 5′-AA TCCAGGAGCCCTGTGAAG-3′,产物 184 bp。 以反转录获得的cDNA为模板,参照SYBR®Green Master Mix试剂盒说明书配制荧光定量PCR反应体系,35~40个循环。GAPDH作为内参基因,利用2-△△Ct法分析各组目的基因的表达变化。2-△△Ct≥2,组间比较目的基因表达明显增高;2-△△Ct≤0.5,组间比较目的基因表达明显降低。
1.10 统计学处理 应用SPSS17.0统计软件。计量资料以(±s)表示,组间比较采用t检验;计数资料用百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度益艾康含药血清对Caco-2细胞增殖活性的比较 见表1。与空白对照组比较,5%、10%益艾康含药血清能不同程度的促进Caco-2的增殖活性,以10%含药血清最为明显;15%、20%益艾康含药血清在短时间能促进Caco-2的增殖,随时间延长其增殖能力下降。因此本研究后续实验以10%含药血清浓度为最佳干预浓度。
表1 不同浓度益艾康含药血清对Caco-2细胞增殖活性的比较(%,±s)
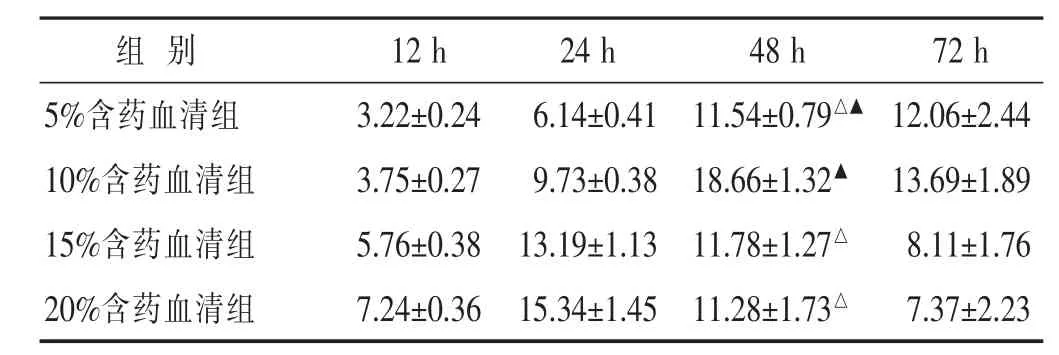
表1 不同浓度益艾康含药血清对Caco-2细胞增殖活性的比较(%,±s)
与10%含药血清组48 h比较,△P<0.05;与本组24 h比较,▲P<0.05。
组 别12 h 24 h 48 h 72 h 5%含药血清组10%含药血清组15%含药血清组3.22±0.24 6.14±0.41 11.54±0.79△▲ 12.06±2.44 3.75±0.27 9.73±0.38 18.66±1.32▲ 13.69±1.89 5.76±0.38 13.19±1.13 11.78±1.27△ 8.11±1.76 20%含药血清组7.24±0.36 15.34±1.45 11.28±1.73△ 7.37±2.23
2.2 各组细胞肠黏膜屏障TEER变化比较 见表2。与空白对照组相比,IFN-γ干预不同时间点TEER值均有所降低,48 h降低最为显著(P<0.05),与 IFN-γ组相比,益艾康在不同时间点均能提高模型组Caco-2细胞单层TEER值。
表2 各组细胞肠黏膜屏障TEER变化比较(%,±s)

表2 各组细胞肠黏膜屏障TEER变化比较(%,±s)
与空白对照组比较,△P<0.05;与 IFN-γ 组比较,▲P<0.05。 下同。
组 别24 h 48 h 72 h空白对照组IFN-γ组益艾康组537±89 529±53 562±73 462±52 275±35△ 312±173 558±72 539±82▲ 573±64 IFN-γ+益艾康组484±64 393±87▲ 488±66
2.3 各组细胞肠黏膜屏障通透性比较 见表3。结果显示,IFN-γ干预不同时间后,荧光素钠渗漏量均有不同程度的增加,48 h后增加已非常明显,与空白对照比较,差异显著(P<0.05);与 IFN-γ 组相比,益艾康能明显降低荧光素钠的渗漏量(P<0.05)。
表3 各组细胞荧光素钠透过率比较(%,±s)
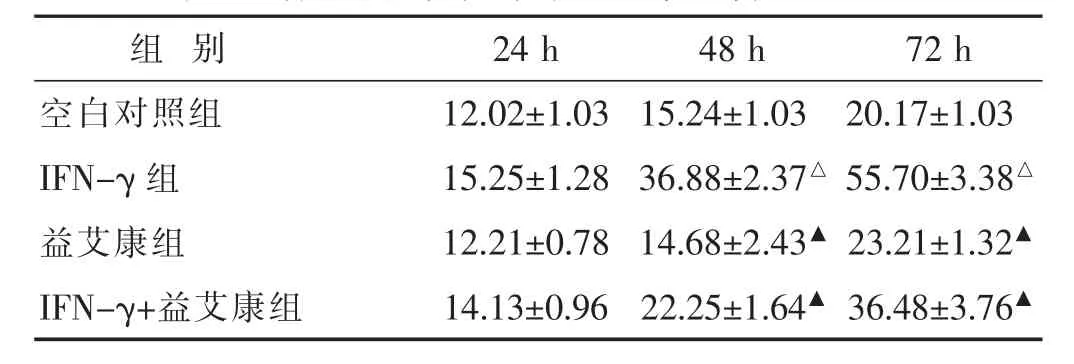
表3 各组细胞荧光素钠透过率比较(%,±s)
组 别24 h 48 h 72 h空白对照组IFN-γ组益艾康组12.02±1.03 15.24±1.03 20.17±1.03 15.25±1.28 36.88±2.37△ 55.70±3.38△12.21±0.78 14.68±2.43▲ 23.21±1.32▲IFN-γ+益艾康组14.13±0.96 22.25±1.64▲ 36.48±3.76▲
2.4 各组细胞ZO-1蛋白表达变化比较 见图1,表4。与空白对照组相比,IFN-γ干预后,ZO-1蛋白表达量显著降低(P<0.05);益艾康能明显提高 ZO-1蛋白的表达,与IFN-γ组比较,差异有统计学意义(P<0.05)。
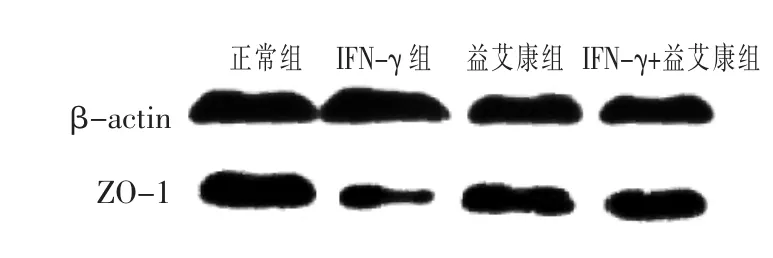
图1 各组细胞紧密连接蛋白ZO-1的表达
表4 各组细胞细胞ZO-1蛋白表达比较(±s)

表4 各组细胞细胞ZO-1蛋白表达比较(±s)
组 别ZO-1相对表达量空白对照组IFN-γ组益艾康组1.14±0.25 0.45±0.13△1.07±0.21▲IFN-γ+益艾康组0.94±0.27▲
2.5 各组细胞ZO-1 mRNA表达变化比较 见表5。IFN-γ组ZO-1 mRNA相对表达量明显低于空白对照组,益艾康组ZO-1 mRNA相对表达量明显高于IFN-γ组。
表5 各组细胞ZO-1 mRNA表达比较(%,±s)
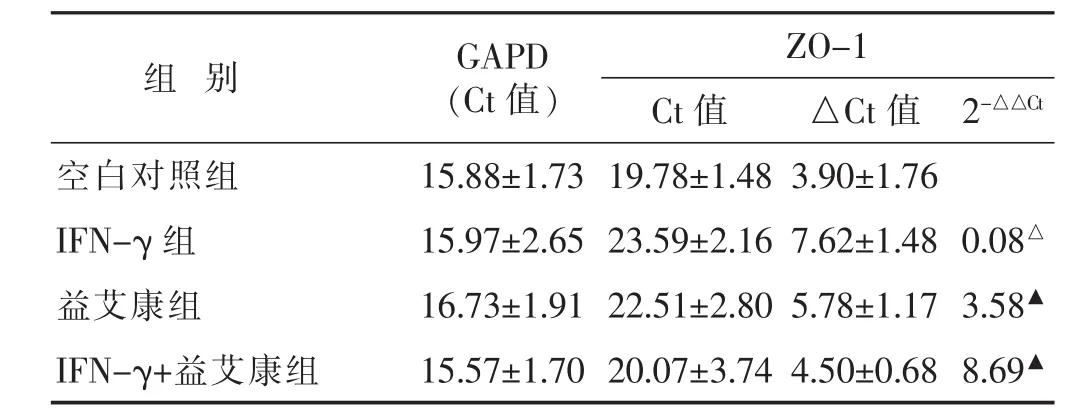
表5 各组细胞ZO-1 mRNA表达比较(%,±s)
组别 GAPD(Ct值)ZO-1 Ct值 △Ct值 2-△△Ct空白对照组 15.88±1.73 19.78±1.48 3.90±1.76 IFN-γ 组 15.97±2.65 23.59±2.16 7.62±1.48 0.08△益艾康组 16.73±1.91 22.51±2.80 5.78±1.17 3.58▲IFN-γ+益艾康组 15.57±1.70 20.07±3.74 4.50±0.68 8.69▲
3 讨 论
胃肠道黏膜病变是HIV感染的一个代表性特征。超过85%的艾滋病毒感染是通过黏膜传输进行,在HIV感染的所有阶段均存在定量和定性的黏膜免疫感染。肠道是HIV复制的主要场所,HIV感染的主要特点是胃肠道固有层中CCR5+记忆CD4+T细胞的大量丢失[3-4]。这种损失归因于HIV对细胞的直接杀伤作用和未感染细胞的凋亡作用。而肠道内CD4+T细胞的损耗意味着免疫功能异常和肠道上皮完整性的破坏,进而导致微生物易位增加、免疫激活和疾病的进展[5-6]。此外,派氏淋巴小结及固有层CD4+T细胞的消耗使产生分泌型IgA和防御素的能力降低,使肠道微生物持续过度生长,微生物易位导致血浆中脂多糖(LPS)和16S rRNA水平增加,进而可以引起慢性局部和全身性免疫激活的发展,最终使病情恶化[7-9]。
中医学认为,脾胃为人体后天之本,是气血生化之源,脏腑经络之枢。“脾旺四季不受邪”“内伤脾胃,百病由生”。徐立然等提出艾滋病中医“脾为枢机”的观点,认为艾滋病的病因为“疫毒”内侵,经血液、黏膜或胚胎而侵入体内,首先损伤脾脏,脾虚是其发病的重要环节,更是贯穿艾滋病发病全过程的基本病机[10-13]。中医脾胃系统的功能与现代医学认为胃肠道具有消化吸收、能量代谢、黏膜屏障和免疫防御等生理功能基本一致。《灵枢·五癃律液别》“脾为之卫”更可以看做是对肠道屏障功能的高度概括。
益艾康胶囊是1996年河南省艾滋病治疗专家到艾滋病高发区巡诊后拟定的临床经验方,临床疗效肯定,经过10余年的临床应用及研究初步证实益艾康胶囊能够改善HIV/AIDS患者临床症状、体征,尤其是减少HIV/AIDS患者机会性感染发生频次,提高患者生存质量,降低病死率[14-16]。本研究结果显示,用10%的益艾康含药血清处理后,Caco-2细胞单层TEER值明显高于IFN-γ组,荧光素钠的渗漏量明显降低。这些均提示,益艾康能降低IFN-γ引起的肠黏膜屏障的通透性增加,维持肠黏膜屏障的完整性,益艾康对IFN-γ引起的肠黏膜屏障体外模型的损伤有一定的保护作用。对HIV/AIDS肠黏膜屏障的保护作用可能是益艾康改善机体免疫状态、降低机会性感染发生频率的重要机制。细胞间紧密连接是构成肠黏膜机械屏障、维持肠黏膜完整性的主要结构,ZO-1是最早发现的紧密连接的重要成分之一,其表达量的变化能够影响正常肠黏膜结构的完整性。本研究结果发现,IFN-γ干预后,肠黏膜屏障ZO-1表达量明显降低,而益艾康含药血清能明显抑制这种变化的发生,益艾康与IFN-γ共同干预肠黏膜屏障后,与单纯IFN-γ组相比,Caco-2单层屏障细胞中ZO-1的表达量显著升高。这提示,益艾康保护肠黏膜的机制可能与增加紧密连接蛋白ZO-1的表达从而维持肠黏膜细胞之间紧密连接结构的完整性有关。
[1]SM Dillon,EJ Lee,CV Kotter,et al.An altered intestinal mucosal microbiome in HIV-1 infection is associated with mucosal andsystemic immune activation and endotoxemia [J].Mucosal Immunol.2014,7(4):983-994.
[2]Steele AK,Lee EJ,Vestal B,et al.Contribution of intestinal barrier damage,Microbial translocation and HIV-1 infection status to an inflammaging signature[J].PLoS ONE,2014,9(5):e97171.
[3]康伟芳,蒋就喜.HIV感染与肠道免疫系统关系的研究进展[J].实用医学杂志,2013,29(6):1007-1009.
[4]徐玉,王昆华.肠道免疫与HIV感染的关系[J].广东医学,2012,33(21):3338-3341.
[5]Alyson C.Yoder,Kejun Guo,Stephanie M.Dillon,et al.The transcriptome of HIV-1 infected intestinal CD4+T cells exposed to enteric bacteria PLoS Pathog[J].2017,13(2):e1006226.
[6]Stephanie M.Dillon,Eric J.Lee,Andrew M.Donovan,et al.Enhancement of HIV-1 infection and intestinal CD4+T cell depletion ex vivo by gut microbes altered during chronic HIV-1 infection[J].Retrovirology,2016,13(5):1-14.
[7]Brenchley JM,Douek DC.HIV infection and the gastrointestinal immune system[J].Mucosal Immunol,2008,1(1):23-30.
[8]Kotler DP.HIV infection and the gastrointestinal tract[J].AIDS,2005,19(2):107-117.
[9]Brenchley JM,Price DA,Schacker TW,et al.Microbial translocation is a cause of systemic immune activation in chronic HIV infection[J].Nat Med,2006,12(12):1365-1371.
[10]徐立然,陈关征,李欢.艾滋病“脾为枢机”的认识[J].辽宁中医杂志,2010,37(9):1675-1676.
[11]徐立然,李欢,陈关征.论气虚是艾滋病的基本病机[J].中医学报,2010,25(2):196-199.
[12]徐立然,马秀霞,孟鹏飞.脾在艾滋病中的作用[J].环球中医药,2012,5(1):35-37.
[13]徐立然,孟鹏飞,马秀霞.浅析气虚为艾滋病病毒携带者/艾滋病患者中医病机的基础[J].环球中医药,2011,4(5):330-332.
[14]常博,李建伟,方根成.益艾康胶囊对AIDS患者病死率的影响[J].河南预防医学杂志,2010,21(3):214-215.
[15]李发枝,徐立然,张明利,等.益艾康胶囊与辨证施治相结合治疗艾滋病患者885例临床观察[J].中医杂志.2010,51(9):808-810.
[16]徐立然,李发枝,何英,等.益艾康胶囊治疗HIV/AIDS病人60个月CD4+T细胞计数和病毒载量临床观察[J].中国艾滋病性病,2010,16(3):231-233.

