结直肠癌患者术前GPS与术后并发症及预后的相关性
张宇澄 盛宇伟 乔治 宋海瑚 沈彪
上海市第一人民医院宝山分院1普外科,2乳腺外科(上海 200940)
结直肠癌是一种常见的消化系统恶性肿瘤,发病率及死亡率仅次于胃癌。其常用的治疗方式有手术及放化疗,手术治疗中的腹腔镜已在临床中被广泛采用[1-3]。格拉斯哥预后评分系统(glasgow prognosis score,GPS)以炎性反应及营养为基础,证实与多种癌症的不良预后有关[4-6]。近年来,有许多GPS与肿瘤关系方面的研究探索,龚兰等[7]发现,患者术前CEA及肿瘤分期越高,GPS评分也越高,说明消化系统肿瘤与GPS评分之间存在一定的关系,但仅凭GPS评分对肿瘤预后评估,预测能力存在一定的局限性。EREN等[8]证实,GPS是恶性肿瘤总生存时间的独立预后因素,同样也没有对单一一种恶性肿瘤进行分析。同时,崔瑶等[9]发现,GPS不仅是胃癌术后生存时间的预后因素,还与围手术期并发症发生率有关,但没有说明是否适用于结直肠癌。从ROXBURGH等[10]研究发现中可以看出,机体炎性状态也随时影响着肿瘤的发生、进展及预后。而结直肠癌腹腔镜术后预后与全身炎症状态密切相关,且近年来的研究均显示GPS可预测多种肿瘤的短期和长期的预后状态,但GPS是否可以作为结直肠癌腹腔镜切除的预后指标目前尚不清楚。本文旨在通过对腹腔镜下结直肠癌切除患者进行,分析其GPS评分与术后生存情况,探讨GPS评分与结直肠癌术后并发症及预后的关系,以减轻病痛,避免复发,改善预后。
1 对象与方法
1.1 研究对象回顾性分析2014年3月至2015年9月我院进行腹腔镜下结直肠癌切除术的患者120例作为研究对象,其中男78例,女42例。患者年龄36~72岁,平均(52.92±10.04)岁。纳入标准:(1)患者病例资料完整;(2)经病理科确诊为结直肠癌,癌症类型明确并进行分期;(3)年龄>30岁。排除标准:(1)合并感染及其他系统疾病等对炎性反应指标有影响的疾病。(2)出现消化系统出血、梗阻以及穿孔等急诊手术患者。(3)合并其他肿瘤。(4)围手术期死亡患者。本研究患者均接受腹腔镜手术治疗。所有参与者均签署有关知情同意书,并获我院伦理委员会批准。
1.2 研究方法
1.2.1 临床资料记录患者入院后整理并收集完整临床资料,包括身高、病程、病史、合并症、病程、肿瘤部位、肿瘤大小、病理学类型、肿瘤位置、脉管癌栓、淋巴结转移情况。
1.2.2 血清CRP、ALB及CEA水平的测定所有研究对象进行术前及术后随访过程中抽血检验,抽血方式为:晨起空腹状态下抽取静脉血液3 mL,依次进行抗凝、离心,取血浆置Eppendorf管中,在-80℃的冰箱中冷冻保存待检。(1)CRP含量测定:采用免疫浊度法,使用HITACtti7600全自动生化分析仪测定及湖南永和阳光科技有限责任公司hCRP试剂盒对CRP水平进行测定(CRP>10 mg/L判定为阳性)。(2)ALB含量测定:采用溴甲酚绿方法,使用HITACtti7600全自动生化分析仪及北京利德曼公司试剂盒对ALB水平进行测定(ALB<35 g/L判定为阳性)。(3)CEA含量测定:ELISA法直接检测血清CEA浓度(CEA>5 ng/mL判定为阳性)。
1.2.3 GPS评分指标患者外周血CRP水平以及ALB水平均判定阳性记作2分;2项指标中有1项判定为阴性记作1分;2项指标均为阴性记作0分。
1.3 手术方式患者入院后予以二级护理,低盐低脂饮食,术前进行灌肠、控制血压血糖、备血等术前准备;在全麻下行“腹腔镜结直肠癌根治术”,从建立气腹、分离肠段、结扎血管、清扫淋巴结、切除肿瘤、吻合肠段等六部进行手术。术后观察患者生命体征变化情况;给予一级护理,对其作出“心电监护、吸氧、抗炎、抑酸”医嘱,密切观察电解质平衡,如有其他不适进行对症处理。
1.4 随访对所有参与研究的120名患者进行为期18个月的随访,每位患者随访起始时间为治疗结束后3个月,每3个月门诊随访一次,每次随访时对研究对象进行CEA值及中性粒细胞、血小板、淋巴细胞水平检测以及GPS评分。终点事件为:患者结直肠癌复发、分期上升、出现其他器官转移和因结直肠癌及其并发症导致死亡。患者拒绝访问、中途退出、死于其他与研究无关的原因定义为失访。根据随访结果,将出现终点事件的患者定义为不良预后组,其余患者定义为预后良好组。分析两组的基线资料(发病年龄、体质量指数、病理学类型、肿瘤分型、TNM分期)、CEA值,及中性粒细胞、血小板、淋巴细胞水平以及GPS评分等。
1.5 统计学方法采用SPSS 24.0软件进行统计学分析,肿瘤大小、年龄、体质量指数、CEA、中性粒细胞、血小板、淋巴细胞水平等计量资料用±s来表示,病理学6类型、肿瘤分型、TNM分期等计数资料用例数表示。采用Kaplan-Meier法绘制患者生存曲线,计算不良预后率。单因素分析对结直肠癌腹腔镜手术患者预后影响的因素。以COX回归对观察指标进行分析,筛选结直肠癌腹腔镜手术患者预后显著影响的独立影响因素。P<0.05时认为差异有统计学意义。
2 结果
2.1 患者一般资料分析本研究共纳入120例患者,男78例,女42例;平均肿瘤大小(4.53±0.63)cm;TNM分期Ⅰ期23例,Ⅱ期97例;平均淋巴结转移8.34个;脉管癌栓阴性89例,阳性31例;腺癌64例,黏液腺癌56例;术前血清CEA阳性41例,阴性79例;术前血清CRP阳性69例,阴性51例;术前血清ALB阳性65例,阴性55例。一般资料详见表1。
2.2 随访结果在随访结束时,全体患者失访9例,69例到随访结束未发生终点事件,42例出现了终点事件,其中结直肠癌复发18例、分期上升11例、肝转移7例、死亡6例。Kaplan-Meier生存曲线(图1)显示,随着时间延长,患者中不良预后的产生例数增多,在随访第5个月和12个月产生不良预后的例数增长较为明显,患者的不良预后率为37.84%。

表1 结直肠癌腹腔镜手术患者一般资料Tab.1 General data of colorectal cancer patients undergoing laparoscopic surgery 例
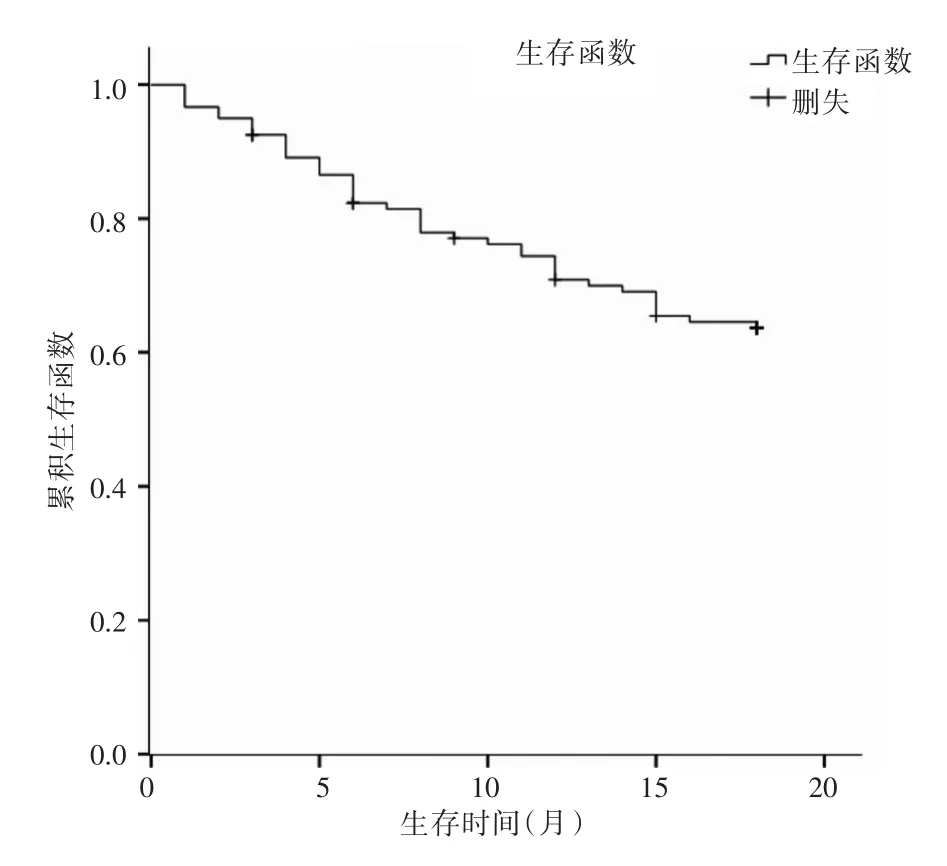
图1 结直肠癌腹腔镜手术患者不良预后发生情况(Kaplan-Meier法)Fig.1 The circumstance of poor prognosis in colorectal cancer patients undergoing laparoscopic surgery(Kaplan-Meier method)
2.2 影响某疾病患者预后转归情况的单因素分析将可能影响某疾病患者预后的因素(发病年龄、体质量指数、病理学类型、肿瘤分型、TNM分期、血清CEA水平、中性粒细胞、血小板、淋巴细胞水平以及GPS评分)逐个纳入COX比例风险模型中进行单因素分析,结果显示:体质量指数、与血小板均对结直肠癌腹腔镜手术患者预后影响无统计学意义(P>0.05);而血清指标CEA(术前)(P=0.013)、中性粒细胞(术前)(P=0.025)、淋巴细胞(术前)(P=0.029)以及GPS评分(术前)(P=0.004)对结直肠癌腹腔镜手术患者预后预后影响显著,差异有统计学意义(P<0.05),见表2。
2.3 影响某疾病预后的多因素COX回归分析筛选单因素COX回归有统计学意义的因素进行多因素COX回归分析,结果显示:中性粒细胞和淋巴细胞预后的影响不明显(P>0.05);CEA(P=0.035)和GPS评分(P=0.023)是影响预后的独立影响因素;进一步分析发现,根据RR值,对患者预 后的影响从大到小依次是CEA、GPS评分,见表3。
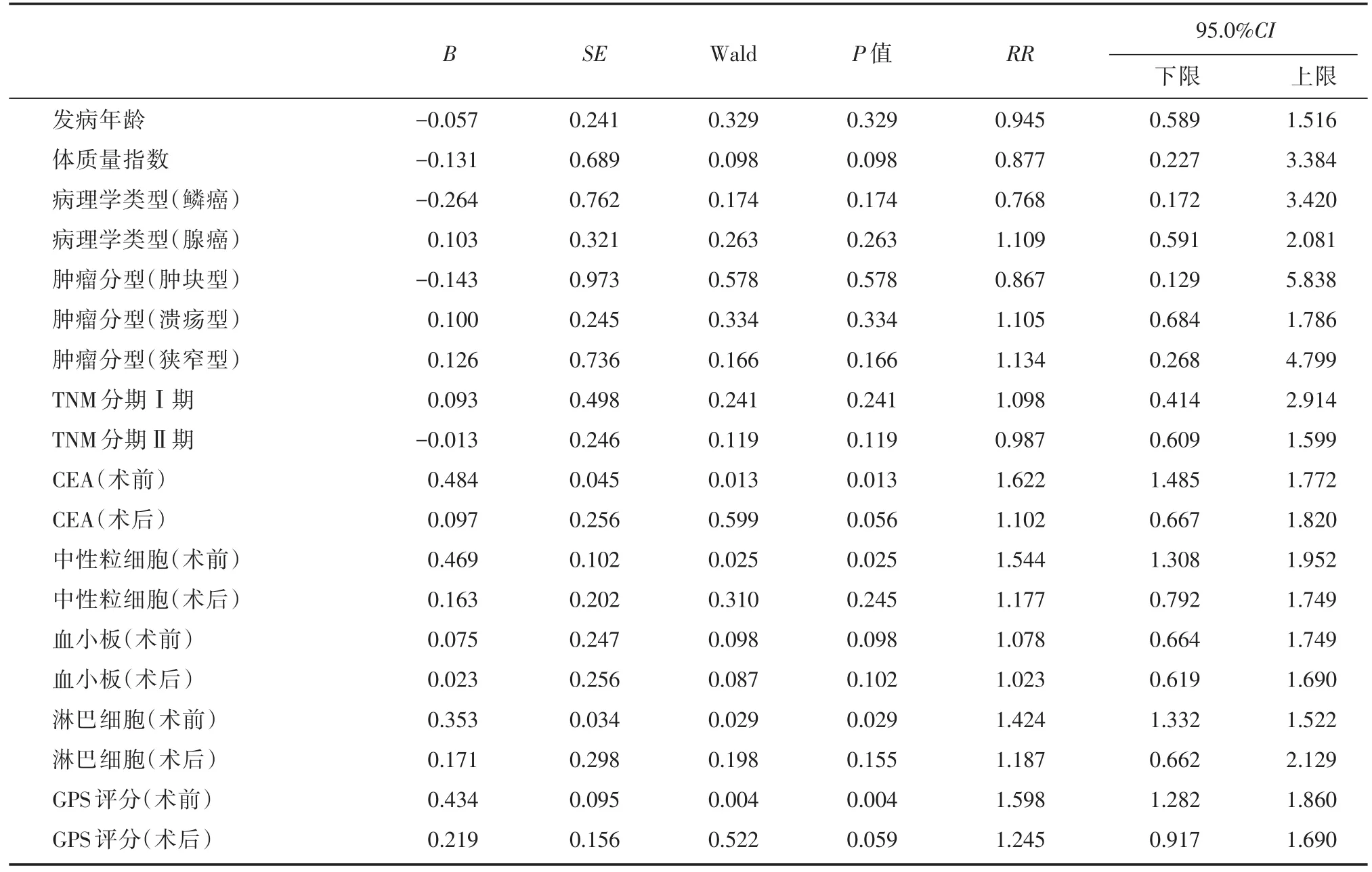
表2 结直肠癌腹腔镜手术患者不良预后的COX单因素分析Tab.2 COX single factor analysis of the prognosis of colorectal cancer patients undergoing laparoscopic surgery
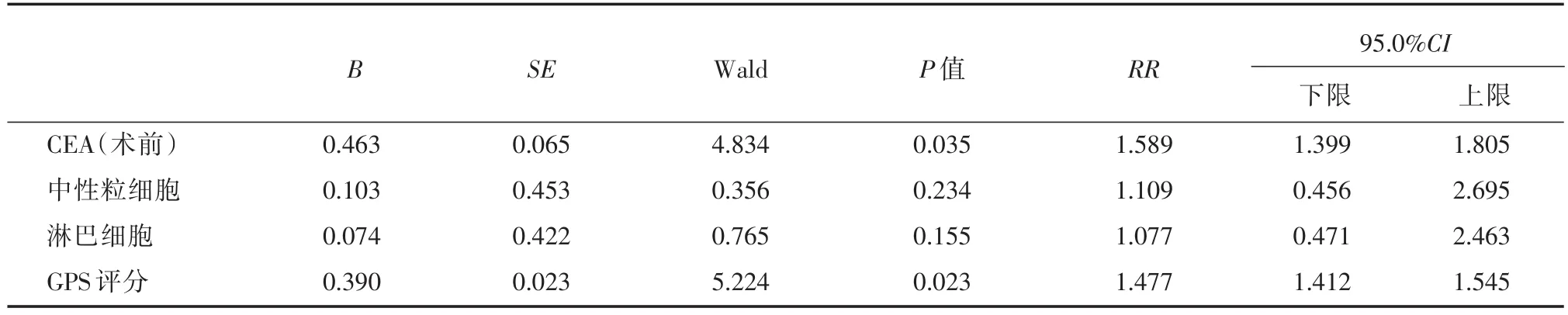
表3 结直肠癌腹腔镜手术患者不良预后的COX多因素分析Tab.3 COX multivariate factor analysis of the prognosis of colorectal cancer patients undergoing laparoscopic surgery
3 讨论
近年来结直肠癌作为常见的消化系统肿瘤,发病率呈逐年上升趋势[11]。随着对疾病的认识不断加深以及临床研究使得结直肠癌治疗后能够有更好的预后,关于其预后的研究一直是近年来的研究热点。近几年研究证明,TGF-β1、E-cadherin、Stat3、miR-152等生化指标及蛋白可不同程度地预测结直肠癌预后[12-15]。目前,临床上主要通过CEA水平、TNM分期、病理分型等基础检测手段进行疾病预测,然而,随着人们生活环境的改变,疾病也在发生着变异,目前迫切需求新的更为准确的预测指标来对结直肠癌患者进行预后评估。本研究将血清CEA水平和疾病GPS评分同时进行分析,来提高预测结直肠癌患者预后的准确性。
由于肿瘤细胞变异程度较大,对疾病的治疗困难加剧,患者预后效果显著降低。SIEGEL等[16]对结直肠癌流行病学研究表明,1、3、5年总体生存率为94.23%、74.53%、55.14%,本研究随访时间为18个月,截止随访结束样本生存率为95%,并且在随访期内随时间推移逐步降低。与SIEGEL等的研究结果基本一致。本研究定义终点事件为患者自入选时间起于随访期间发生不良预后事件。研究结果显示,由于发生终点事件的人数较多,随访期间的第5个月和第12个月左右,生存曲线下降较为明显,其中发生结直肠癌复发的患者约35%,分期上升的约25%,出现其他器官转移的约10%,因本疾病及其并发症导致死亡的约30%。笔者认为,发生生存率的偏差和终点事件的原因可能是由于随访者的年龄较高,患者多合并有如糖尿病、高血压和其他系统疾病等慢性疾病,或由于结直肠癌患者有较多致病危险因素,对预后产生了不良影响。
经过流行病统计学分析研究[17],结直肠癌患者的年龄80%分布在50~65岁之间,原因主要是以生活习惯以及生活环境为主的危险因素导致细胞癌变,同时老年人的免疫力较弱,极易发生淋巴转移,治疗及术后恢复难度较大。在结肠癌患者当中男性与女性人数之比大约为1∶0.5,男性要显著多余女性,且预后与女性相比较差,原因是由雌孕激素以及生育对女性的作用抵制癌细胞的突变。病理学类型方面,结直肠癌病理学类型分为黏液腺癌和腺癌两类,从统计学上看[18],腺癌的发生率要远高于黏液腺癌,且分化程度低,预后也极差。同时,CEA作为大肠癌组织的一种抗原可以引起患者的免疫反应,广泛存在与各种消化系统的恶性肿瘤中,同时正常组织也会有存在,但是是低水平。虽然其对结直肠癌有一定的诊断作用,但是由于其特异性和灵敏性不高,因此对肿瘤的早期及预后判断作用不明显。有研究表明[19-20],炎性作用在肿瘤的发生发展中起到了决定性作用,随着恶性肿瘤的发展,炎性细胞的水平也随之升高,例如中性粒细胞、血小板、淋巴细胞水平均可能随着癌细胞的突变而升高。而GPS更是以炎性和营养性为基础对疾病的总和评分,来判定术前术后的健康情况。
基于以往研究对影响结直肠癌患者预后危险因素的分析,我们将发病年龄、体质量指数、病理学类型、肿瘤分型、TNM分期、血清CEA水平、中性粒细胞、血小板、淋巴细胞水平以及GPS评分逐个纳入COX比例风险模型中进行单因素分析,结果显示,血清学指标CEA、中性粒细胞、淋巴细胞以及GPS评分为影响结直肠癌患者预后的独立危险因素,其中影响大小依次是CEA、GPS评分、中性粒细胞、淋巴细胞。我们分析CEA(术前)之所以为最严重的危险因素是因为CEA与肿瘤细胞的黏附与凋亡有密切关系,普遍存在于恶性肿瘤患者体内,同时随着CEA水平的升高,引起细胞的之间极性消失,从而导致细胞排列乱序,进而促进癌细胞的转移[21],因此CEA水平和结直肠癌患者的预后情况有着密切的联系。虽然肿瘤的发生发展与炎性因素有着一定的联系,中性粒细胞以及淋巴细胞会有一定水平的升高,但是中性粒细胞以及淋巴细胞的影响因素较为广泛,同时其也影响着自身的各个方面,因此中性粒细胞以及淋巴细胞的影响因素较为小。在对结直肠癌患者预后的研究中,GPS评分较少被考虑到,但是随着近几年的研究发现,肿瘤的发生发展与炎症的发展有着密切的联系,而作为专项炎性指标的评分标准,GPS评分与肿瘤的预后研究则成为现如今的热点,研究表明[22],随着肿瘤的发展、扩散以及转移,炎性指标则也随之升高,因而导致GPS评分也相应的提高。基于以上的研究,笔者认为可以在术前及术后对患者进行GPS评分,来了解判定患者身体状况以及预后恢复情况,对疾病的发生发展有更准确的认识。
但由于GPS评分仅包括血清CPR及血清ALB两个指标,与目前作为预后判断金标准的TNM分期相比,诊断性能稍弱,但由于其检测方便,给患者带来痛苦更少,成本较低,同时CEA广泛存在于结直肠癌中,但是正常人身体中也有微量存在,因此二者分别单独评估结直肠癌患者预后时敏感性相比而言较低,临床应用价值不大。
此外,本研究尚存在一些不足,研究随访对象人数较少,项目分析不完善且随访时间短,纳入结直肠癌腹腔镜手术患者预后的影响因素较少。笔者将在后续研究中,进一步增加调查人数,延长随访时间,多关注前言研究以更精确掌握静脉血栓相关危险因素,笔者在后续研究中会建立更为完整精确的评分系统或回归方程来评估预后。
综上所述,本研究表明CEA和GPS评分是影响结直肠癌患者预后的独立危险因素,在临床上具有协助筛选具有预后不良风险患者的作用,从而制定高效的治疗方案,提高患者预后。
[1]李道娟,李倩,贺宇彤.结直肠癌流行病学趋势[J].肿瘤防治研究,2015,42(3):305-310.
[2]姚宏伟,姚响芸,孙涛,等.腹腔镜结直肠癌根治性切除联合同期腹腔镜或开腹肝大部切除术治疗同时性结直肠癌肝转移的疗效分析[J].中华消化外科杂志,2016,15(2):128-134.
[3]JUSTIN G,RODRIGO D,XIN W,et al.The consensus molecular subtypes of colorectal cancer:[J].Nature Medicine,2015,21(11):1350-6.
[4]宋旭敏,任青,程忠平.格拉斯哥预后评分预测肿瘤的临床价值[J].医学综述,2017,23(12):2354-2358.
[5]崔瑶,李剑,刘明月,等.格拉斯哥预后评分对食管胃结合部腺癌患者预后的的预测价值[J].中华胃肠外科杂志,2016,19(1):54-57.
[6]WARD F G,HERNANDEZ M,PALLOT D,et al.Health state preference weights for the glasgow outcome scale following traumatic brain injury:a systematic review and mapping study[J].Value in Health,2016,20(1):141-151.
[7]龚兰,吴瑜霞,陈振宇,等.GPS评分与结直肠癌预后的关系[J].检验医学与临床,2016,13(14):1987-1989.
[8]EREN T,BURCU B,TOMBALAK E,et al.Clinical significance of the glasgow prognostic score for survival after colorectal cancer surgery[J].J Gastrointest Surg,2016,20(6):1231-1238.
[9]崔瑶,李剑,曹养辉,等.高敏感格拉斯哥评分对进展期胃癌患者新辅助化疗疗效和预后的预测作用[J].中华肿瘤杂志,2017,39(3):195-200.
[10]ROXBURGH C S,MCMILLAN D C.Cancer and systemic inflammation:treat the tumour and treat the host.[J].British Journal of Cancer,2014,110(6):1409-12.
[11]郑民华,马君俊.结直肠癌肝转移的腹腔镜微创手术治疗[J].中华胃肠外科杂志,2015(6):521-524.
[12]刘贤伟,曹俊达,熊功友,等.TGF-β1、Smad7与树突状细胞在结直肠癌肝转移中作用的初步研究[J].中国普通外科杂志,2015,24(1):63-69.
[13]秦乐,曾妍.E-cadherin缺失表达与结直肠癌患者预后相关性多元Cox回归分析[J].中国临床药理学杂志,2017,33(1):7-9.
[14]RATSIMANDRESY R A,INDRAMOHAN M,DORFLEUTNER A,et al.The AIM2 inflammasome is a central regulator of intestinal homeostasis through the IL-18/IL-22/STAT3 pathway[J].Cellular&Molecular Immunology,2017,14(1):127.
[15]汪毅,袁伟,马肖,等.miR-152在结直肠癌组织中的表达及其与预后的关系[J].中华肿瘤杂志,2016,38(10):763-766.
[16]SIEGEL R L,MILLER K D,FEDEWA S A,et al.Colorectal cancer statistics,2017[J].Ca A Cancer Journal for Clinicians,2017,67(3):177.
[17]MEESTER R G S,DOUBENI C A,ZAUBER A G,et al.Public health impact of achieving 80%colorectal cancer screening rates in the United States by 2018[J].Cancer,2015,81(5):2281.
[18]王晓娜,梁寒,王家仓,等.1829例结直肠癌患者的临床病理特征及预后分析[J].中华胃肠外科杂志,2004,7(6):439-442.
[19]陈宣辰,程军.结直肠癌相关炎性因子的研究进展[J].中国肿瘤生物治疗杂志,2012,19(1):103-106.
[20]杨静,朱元民,刘玉兰.菌群与黏膜慢性炎性反应在结直肠肿瘤发病中的作用[J].中华消化杂志,2011,31(9):643-645.
[21]ZHOU Z M,FENG Z,ZHOU J,et al.Capillary electrophoresischemiluminescence detection for carcino-embryonic antigen based on aptamer/graphene oxide structure.[J].Biosensors&Bioelectronics,2015,64:493-498.
[22]CUI Y,LI J,CAO Y H,et al.Predictive and prognostic significance of high-sensitivity modified Glasgow Prognostic Score(HS-mGPS)in advanced gastric cancer patients treated with neoadjuvant chemotherapy[J].Zhonghua Zhong Liu Za Zhi.2017,39(3):195-200.

