维吾尔族不同HER-2表型乳腺癌中Survivin和Caspase-9基因表达的相关性及其意义
石文龙 巫姜 李炳军,2 李南林 凌瑞 陈江浩
1空军军医大学(第四军医大学)西京医院甲乳血管外科(西安710032);2新疆维吾尔自治区人民医院乳腺甲状腺外二科(乌鲁木齐830001)
在全世界范围内,乳腺癌(breast cancer)是女性最常见的恶性肿瘤。统计数据显示,乳腺癌是导致美国妇女死亡的第2位病因。我国乳腺癌发病率较发达国家低,但人口基数大,总患病人数也相当的庞大。因此乳腺癌的防治是不容忽视的。乳腺癌的发病及病情进展与多种因素有关[1],特别地,不同民族人群之间有所不同[2]。维吾尔族是生活在我国西北地区的最主要少数民族,其乳腺癌发病有特点,在病理特征上也有特异之处,具有的不良预后因素较多[3]。人类表皮生长因子受体-2(HER-2)是乳腺癌预后相关因子。HER-2过表达(HER-2阳性)的乳腺癌是一种特殊类型的亚型,该亚型恶性程度高,预后较差。
Survivin是凋亡抑制蛋白家族中的重要成员,它具有抑制Caspase-9参与的内源性凋亡途径的作用,进而达到抑制肿瘤细胞凋亡之目的。本研究旨在分析HER-2阳性及阴性的维吾尔族乳腺癌患者Survivin和Caspase-9表达差异并分析其相关性。初步探明Survivin和Caspase-9两基因在维吾尔族不同HER-2表型乳腺癌发病中可能存在的作用及机制,为乳腺癌发病机制研究奠定基础。
1 资料与方法
1.1 一般资料实验采用完全随机设计,选取2014年6月至2016年12月在新疆维吾尔自治区人民医院及西京医院初次确诊为乳腺癌的维吾尔族女性患者为研究对象,经免疫组化或FISH检查确定HER-2表达情况共72例,其中HER-2阳性39例(A组),HER-2阴性33例(B组),年龄33~67岁。以病理确诊为良性病变的40例维吾尔族女性患者为正常对照(C组),年龄28~62岁。该实验经过伦理委员会审查通过,患者签署知情同意书。其中早期浸润癌19例,浸润性特殊癌17例,浸润性非特殊癌26例。按国际抗癌联盟TNM分期:Ⅰ期3例,Ⅱ期38例,Ⅲ期27例,Ⅳ期4例。两组患者在年龄、病理分型及病变分期等方面差异无统计学意义(均P>0.05),具有可比性。见表1。
1.2 纳入及排除标准纳入标准:病理确诊为乳腺癌的维吾尔族女性患者,且明确诊断HER-2表达为阳性者;HER-2确诊标准:(1)免疫组化HER-2(3+)为阳性;(2)HER-2 FISH检测比值 > 2.2者;(3)免疫组化检查HER-2(1+或-)为阴性。排除标准:入组前已行化疗、免疫或生物治疗等系统治疗;非女性患者;非首次确诊及诊治的患者。
1.3 试剂与仪器反转录试剂盒及SYBR GreenⅠreal-time PCR试剂盒(日本Takara),Trizol Reagent(美国Invitrogen),DEPC(美国Sigma),PCR产物纯化试剂盒(北京TIANGEN),一抗工作液:兔抗人Survivin多克隆抗体和兔抗人Caspase-9多克隆抗体(美国Santa-Cruz),羊抗兔二抗及DAB染色试剂盒(北京中杉金桥)。

表1 HER-2阳性患者及HER-2阴性组患者基本情况Tab.1 Condition of HER-2 Positive patients and the HER-2 Negative group 例
Real-time RT-qPCR仪(CFX96TM,美国BIORAD),低温高速离心机(美国BIO-RAD),蛋白电泳仪(美国BIO-RAD),PCR仪(C1000TM,美国BIO-RAD),凝胶成像仪(美国BIO-RAD)核酸蛋白测定仪(NanoDrop1000,美国Thermo)。
1.4 标本采集及处理采集术前微创穿刺或者术后肿瘤组织,一分为二,其中一份迅速经液氮冷冻后转至超低温冰箱中保存。另外一份经10%甲醛溶液固定。
1.5 real-time RT-PCR检测Survivin和Caspase-9表达取冰冻组织50 g,于液氮中迅速研磨,采用Trizol法提取总RNA,反转录为cDNA,分别检测Survivin和Caspase-9基因的表达;引物由大连宝生物公司设计并合成,引物序列见表2。PCR反应条件为:预变性95.0℃/3 min,变性95.0℃/10 s,退火30 s,Survivin、Caspase-9和 β-actin退火温度分别58.6、61.2和53.9℃,分别38个循环;实验以β-actin作为内参进行数据分析[1]。

表2 实时荧光定量PCR引物序列Tab.2 Real-time quantitative PCR primer sequences
1.6 免疫组化检测Survivin和Caspase-9表达取固定好的组织标本,石蜡包埋切片,免疫组化染色,具体参考课题组前期实验步骤[1]。实验设置阴性对照和阳性对照。两位病理科高年资医生,采取双盲法在400倍下随机选择5个不重复视野,Survivin和Caspase-9表达以细胞浆或(和)细胞膜被染成棕黄色或黄色者定义为阳性细胞,读取染色深度(0分为阴性,1分弱阳性,2分中等强度阳性,3分为强阳性)和面积(0分:<5%,1分:5%~24%,2分:25%~50%,3分:51%~75%,4分:>75%)。两者赋分乘积大于1分定义为阳性[1]。
1.7 统计学方法利用SPSS 20.0统计软件包分析,计量资料用±s表示,多组分析用方差分析,进一步组间比较用LSD检验,计数资料用卡方检验,P<0.05为差异具有统计学意义。
2 结果
2.1 real-time RT-PCR检测Survivin mRNA结果Survivin/β-actin比值作为相对表达量,在3组组织中均有一定表达,但表达各有差异(F=3.08,P<0.05)。A组与B组比较,A组与C组比较,Survivin表达均增强,差异均有统计学意义(均P<0.05)。B组与C组比较,Survivin表达前者略高,但差异没有统计学意义(P>0.05)。见表3、图1。
表3 Survivin mRNA在维吾尔族乳腺癌与正常对照组中的表达Tab.3 Expression of Survivin mRNA in Uygur ethnic breast cancer and control group ±s

表3 Survivin mRNA在维吾尔族乳腺癌与正常对照组中的表达Tab.3 Expression of Survivin mRNA in Uygur ethnic breast cancer and control group ±s
分组HER-2阳性组(A组)HER-2阴性组(B组)对照组(C组)例数39 33 40 Survivin/β-actin(×10-5)1.135±0.581 1.036±0.461 0.495±0.321 F值3.08<0.05 P值
2.2 real-time RT-PCR检测Caspase-9 mRNA结果Caspase-9/β-actin比值作为相对表达量,在各组中均有一定表达,但表达各有差异(F=3.01,P<0.05)。A组与B组比较,A组与C组比较,Caspase-9表达均减弱,差异均有统计学意义(均P<0.05)。B组与C组比较,Caspase-9表达前者略低,但差异无统计学意义(P>0.05)。见表4、图2。
2.3 免疫组化检测Survivin蛋白表达结果根据免疫组化检测结果显示,Survivin蛋白在各组组织中均有一定表达,其表达量不全相同(χ2=32.409,P<0.001)。A组与B性组比较,A组与C组比较,Survivin表达均增强,差异均有统计学意义(均P<0.05)。B组与C组比较,Survivin表达前者略高,但差异无统计学意义(P>0.05)。见表5、图3。
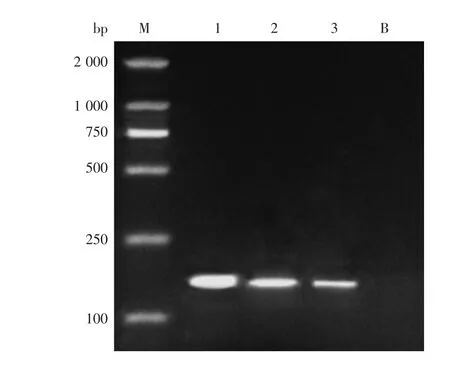
图1 Survivin在维吾尔族不同HER-2表达状态乳腺癌组织中表达的PCR结果图Fig.1 PCR results of Survivin expression of different HER-2 status in Uighur breast cancer
表4 Caspase-9 mRNA在维吾尔族乳腺癌与正常对照组中的表达Tab.4 Expression of Caspase-9 mRNA in Uygur ethnic breast cancer and Control group ±s
表4 Caspase-9 mRNA在维吾尔族乳腺癌与正常对照组中的表达Tab.4 Expression of Caspase-9 mRNA in Uygur ethnic breast cancer and Control group ±s
分组HER-2阳性组(A组)HER-2阴性组(B组)对照组(C组)例数39 33 40 Caspase-9/β-actin(×10-6)7.374±0.803 8.325±0.898 8.472±0.926 F值P值3.01<0.05
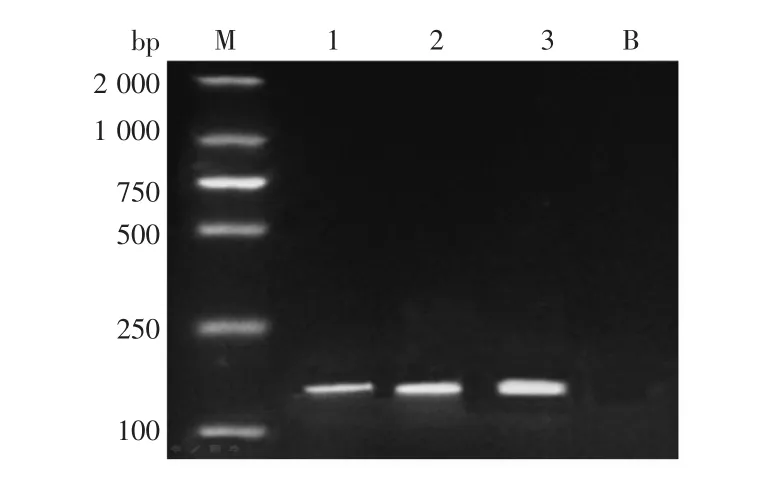
图2 Caspase-9在维吾尔族不同HER-2表达状态乳腺癌组织中表达的PCR结果图Fig.2 PCR results of Caspase-9 expression of different HER-2 status in Uighur breast cancer
2.4 免疫组化检测Caspase-9结果根据免疫组化检测结果显示,Caspase-9蛋白在各组组织中都有一定表达,其表达量不全相同(χ2=29.843,P<0.001)。A组与B组比较,Caspase-9表达均减弱,差异无统计学意义(均P>0.05)。A组与C组比较,Caspase-9表达减弱,差异均有统计学意义(P<0.05)。B组与C组比较,Caspase-9表达前者低,差异有统计学意义(P<0.05),见表6、图4。

表5 免疫组化检测Survivin表达情况Tab.5 Immunohistochemical detection of Survivin expression例
2.5 Survivin和Caspase-9基因的相关性分析对纳入实验的新疆维吾尔族妇女HER-2阳性乳腺癌患者进行数据分析,real-time RT-PCR检测结果显示Survivin和Caspase-9表达呈负相关(r=-0.648,P<0.01,表7)。免疫组化检测结果显示Survivin和Caspase-9表达呈负相关(r=-0.581,P<0.05)。见表8。
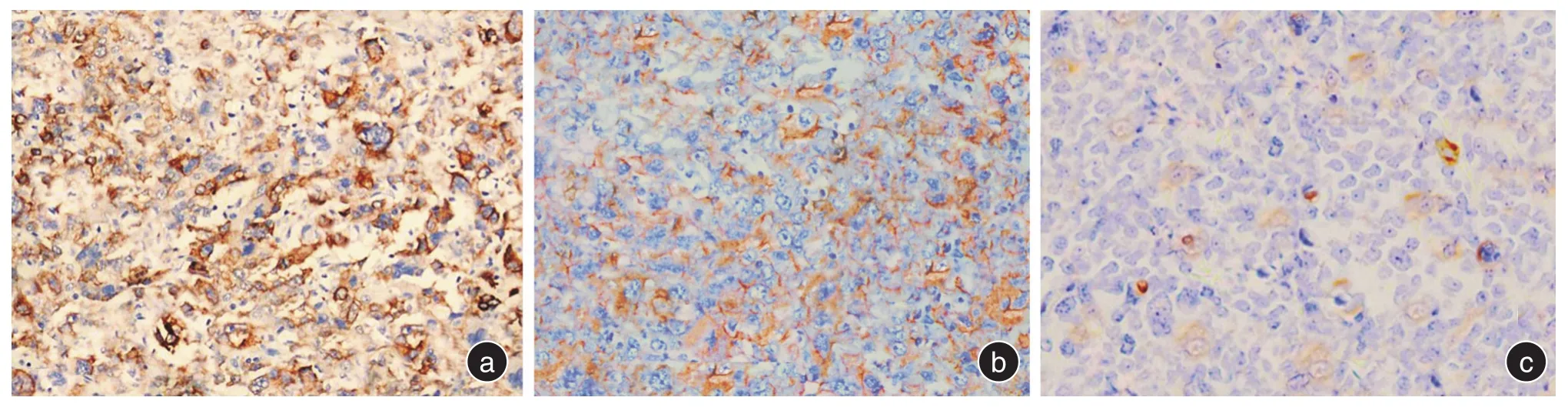
图3 Survivin在乳腺癌组织中表达的IHC结果图(SP×400)Fig.3 IHC results of Survivin expression in breast cancer(SP × 400)
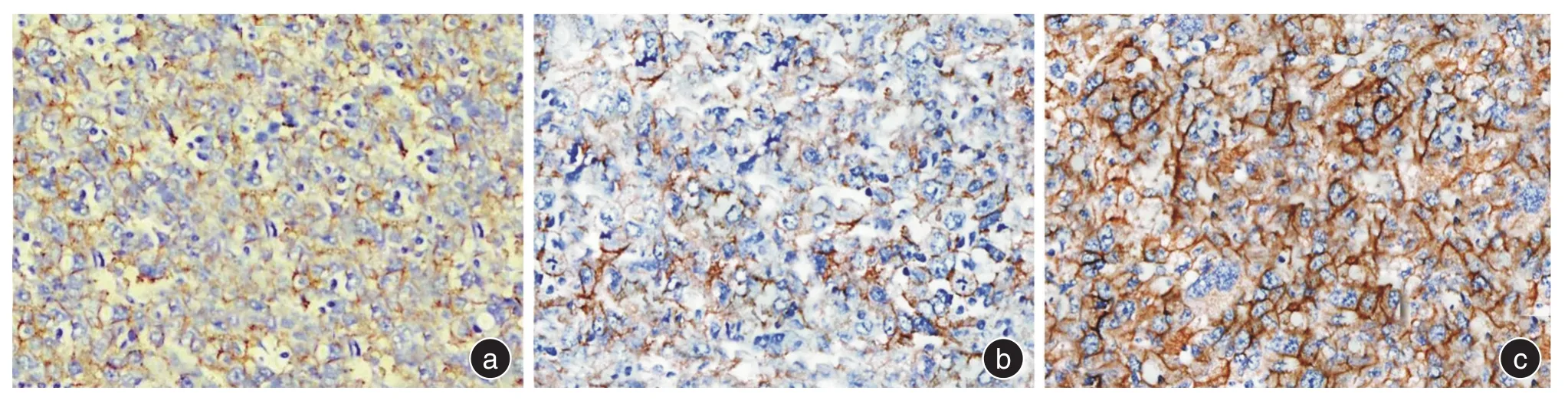
图4 Caspase-9在乳腺癌组织中表达的IHC结果图(SP×400)Fig.4 IHC results of Caspase-9 expression in breast cancer(SP × 400)
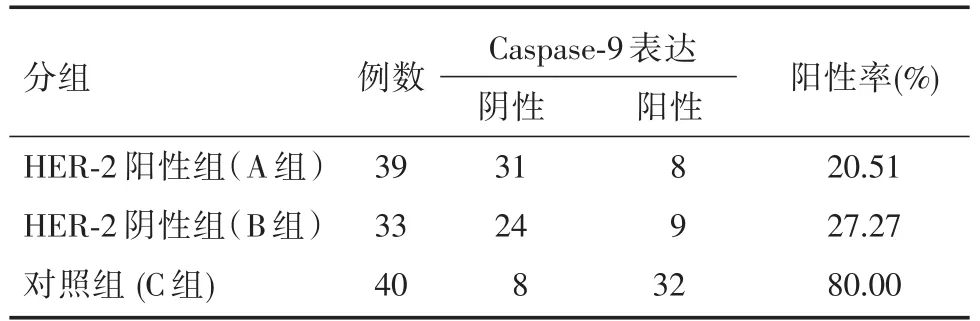
表6 免疫组化检测Caspase-9表达情况Tab.6 Immunohistochemical detection of Caspase-9 expression 例
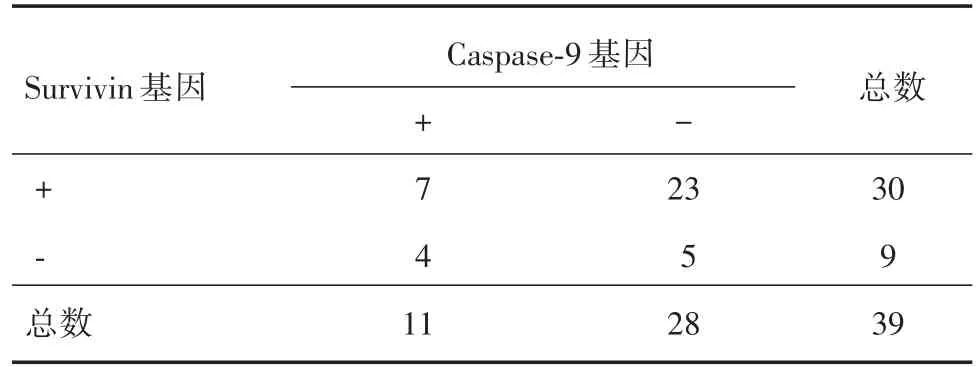
表7 HER-2阳性患者Survivin和Caspase-9的相关性(real-time RT-PCR)Tab.7 Correlation between Survivin and Caspase-9 of HER-2 positive patients(real-time RT-PCR) 例
3 讨论
乳腺癌为乳腺腺上皮来源的恶性肿瘤,作为 女性的多发癌,是威胁她们身心健康的癌肿之首,也是女性最常见的恶性肿瘤之一。乳腺癌的发生与患者的遗传背景、生活环境等因素有着密切的关系。在我国不同种族和(或)地区之间,其发病率和预后有所不同[2]。维吾尔族是我国西北地区主要的少数民族之一,具有人口众多、婚配大多局限本民族等特点。维吾尔族女性乳腺癌的发病与其他种族人群相比,既有共性也有特性。然而,维吾尔族人群乳腺癌的具体发病机制及特点目前尚未见文献报道[2,4-5]。
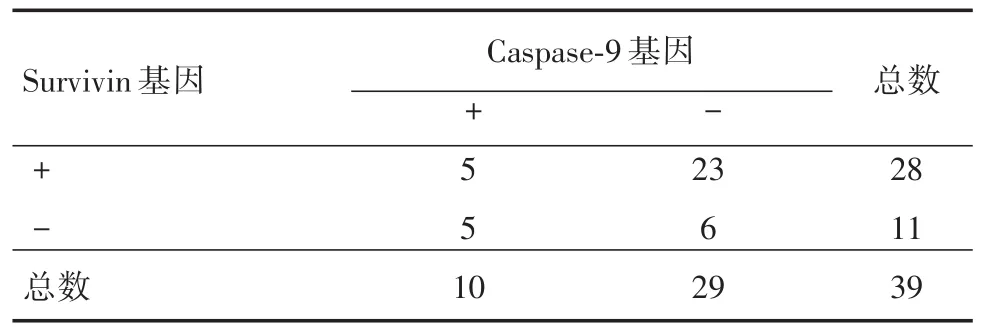
表8 HER-2阳性患者Survivin和Caspase-9的相关性(免疫组化)Tab.8 Correlation between Survivin and Caspase-9 of HER-2 positive patients(Immunohistochemistry) 例
HER-2在正常人体的细胞膜表面也有HER-2蛋白的表达;由于HER-2蛋白可以参与信号传导,调控细胞生长及分裂;因此,当乳腺癌细胞HER-2过表达时,其信号可刺激癌细胞的不断生长或增加癌细胞的侵袭性,进而使得乳腺癌患者的病情快速进展,最终导致不良的预后。因此,HER-2或是判断乳腺癌预后因素的指标之一[6],也是研究乳腺癌发病及治疗的重要环节之一。
Survivin是凋亡抑制蛋白家族成员之一。具有对抗细胞周期G2~M期凋亡的诱导[7]作用,同时有调节细胞增殖和诱导血管生成的作用[8]。其具有肿瘤特异性,在正常分化成熟组织中很少表达,当癌变时,其表达增加。因此Survivin主要表达于癌组织表面,被认为是恶性肿瘤诊断和治疗的良好指标和靶点[8-9]。GUZMAN 等[10]和管海涛等[11]研究表明:乳腺癌等癌变组织中Survivin基因表达增强。Survivin表达下调反而可诱导乳腺癌MCF-7细胞凋亡[12]。本研究结果显示:免疫组化和real-time RT-PCR结果均显示,HER-2阳性组、HER-2阴性组Survivin基因表达均强于对照组。而进一步分析显示:HER-2阳性组较HER-2阴性组Survivin基因表达增强;而HER-2阴性组也较正常对照组表达增强,但差异没统计学意义。该结果显示:维吾尔族HER-2阳性乳腺癌组织中Survivin基因高表达,这与GUZMAN等[13]及阿衣夏木古丽等[1]报道一致。这也初步说明Survivin高表达可能在促进维吾尔族HER-2阳性乳腺癌变过程中起着一定的促进作用。当然这需要进一步的研究进行证实。
ZUMBRÄGEL等[14]发现Survivin作为生存素,其抗凋亡作用是主要是通过抑制Caspase-9的作用参与的内源性凋亡途径而实现的。具体机制是Survivin基因可直接参与并抑制凋亡终末效应酶Caspase3和Caspase7的活性[15];然而这二者的活化可以由由活化后的Caspase-9所诱导[16]。在凋亡终末效应酶诱导的整个凋亡过程中,Caspase-9与Survivin则表现为抑制的效应[17]。本研究在免疫组化和real-time RT-PCR的结果均显示:HER-2阳性组、HER-2阴性组Caspase-9基因表达均低于正常对照组。这与张丙信等[18]的研究结果有相似之处。进一步分析,real-time RT-PCR结果表明:HER-2阳性组较HER-2阴性组Caspase-9基因表达减弱;而HER-2阴性组较对照组Caspase-9基因表达略低,差异没统计学意义。免疫组化结果却显示:HER-2阳性组、HER-2阴性组与正常对照组均无统计学差异。分析两种试验方法检测结果数据显示,在新疆维吾尔族妇女HER-2阳性乳腺癌患者中,Survivin基因表达增强,Caspase-9基因表达减弱,Survivin和Caspase-9基因呈负相关;根据如上研究结果可初步说明,Survivin基因可能通过抑制Caspase-9基因的激活,从而导致维吾尔族女性HER-2阳性乳腺癌的发生。但结果不是很明确,究其原因,一方面可能和纳入研究的样本数量较少有一定关系;另一方面,也可能是Caspase-9在维吾尔族HER-2阳性及HER-2阴性乳腺癌发病过程中差异不明显,但是其具体机制这需要进一步的深入研究得以证实。
终上所述,Survivin基因作为抑制凋亡发生的重要因子之一,可能在维吾尔族女性HER-2阳性乳腺癌发病过程中中起着潜在的促进作用,主要通过该基因过表达发挥其促进作用。研究还显示,Caspase-9基因通过低表达在维吾尔族HER-2阳性乳腺癌中也起到促进作用,且二者可能存在负相关关系。当然,本研究尚处于基础的阶段,二者的确实关系需要进一步明确。这需要在进一步在两基因相互作用机制中更加深入和更广的研究;以探明Survivin和Caspase-9基因在维吾尔族HER-2阳性乳腺癌中的意义,为乳腺癌的发病机制研究奠定基础。
[1]阿衣夏木古丽·艾则孜,巫姜,王芳.Survivin和Caspase-9基因在新疆维族、汉族HER-2阳性乳腺癌组织中的表达及意义[J].现代肿瘤医学,2013,21(7):1526-1530.
[2]李鸿涛,董朝,罗琳,等.维吾尔族和汉族乳腺癌中环氧合酶-2和血管内皮生长因子-C在mRNA和蛋白水平的表达[J].中华实验外科杂志,2016,33(4):891-893.
[3]吴军,孙刚,董朝,等.BRIP1基因多态性在维族、汉族妇女早发性乳腺癌的分布状况分析[J].临床外科学,2017,25(4):284-287.
[4]成芳,木克代斯,司马义.新疆维吾尔族女性乳腺癌危险因素的病例对照研究[J].中国卫生统计,2010,27(4):364-368.
[5]蒋威华,欧江华,张国庆,等.汉族与维吾尔族三阴性乳腺癌临床特征及预后差异分析[J].中国肿瘤临床,2011,38(24):1579-1583.
[6]刘琪,郭晓龙,左文述,等.乳腺癌术后复发转移间隔与临床病理因素相关性分析[J].中华肿瘤防治杂志,2014,21(7):522-527.
[7]刘婷婷,孟玲楠,李瑛,等.NSCLC survivin表达特点及其与细胞周期的关系研究[J].中华老年多器官疾病杂志,2016,15(7):547-550.
[8]BRAND,DVORSKÁ D,SLÁVIK P,et al.Survivin and gynaecological tumours[J].Pathol Res Pract,2017,213(4):295-300.
[9]SHAMSABADI F T,EIDGAHI M R,MEHRBOD P,et al.Survivin,a promising gene for targeted cancer treatment[J].Asian Pac J Cancer Prev,2016,17(8):3711-3719.
[10]LI S,WANG L,MENG Y,et al.Increased levels of LAPTM4B,VEGF and survivin are correlated with tumor progression and poor prognosis in breast cancer patients[J].Oncotarget,2017,8(25):41282-41293.
[11]管海涛,代志军,马宇光,等.Survivin与乳腺癌雌激素受体信号通路相关基因的相关性[J].现代肿瘤医学,2016,24(21):3377-3381.
[12]陈茂剑,肖潺潺,王丽,等.雷公藤甲素对乳腺癌MCF-7细胞增殖和凋亡的影响及其机制[J].实用医学杂志,2017,33(23):3867-3870.
[13]GUZMAN J R,FUKUDA S,PELUS L M.Inhibition of caspase-3 by Survivin prevents Wee1 Kinase degradation and promotes cell survival by maintaining phosphorylation of p34Cdc2[J].Gene Ther Mol Biol,2009,13B:264-273.
[14]ZUMBRÄGEL F K,MACHTENS D A,CURTH U,et al.Survivin does not influence the anti-apoptotic action of XIAP on caspase-9[J].Biochem Biophys Res Commun,2017,482(4):530-535.
[15]AMBROSINI G,ADIDA C,ALTIERI D C.A novel anti-apoptosisgene.survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917-921.
[16]徐磊,孟刚.肿瘤干细胞相关标记物CD44及CD24在乳腺癌中的表达及其意义[J].临床与实验病理学杂志,2011,27(11):1197-1201.
[17]赵岩,孙健,吴影,等.结直肠癌中Survivin、Caspase-9和Ki-67表达的相关性及临床意义[J].临床与实验病理学杂志,2017,33(4):435-438.
[18]张丙信,赵霞,陈雪,等.基底细胞样乳腺癌中Apaf-1、Caspase-9和Bax蛋白表达临床意义分析[J].实用医学杂志,2015,31(1):91-95.

