钽颗粒影响成骨细胞增殖的机制研究
康成容 李梁 李张维 周折冲 周倩冰 潘宣
广东药科大学附属第一医院口腔科(广州510080)
早期愈合、早期负重以及长期良好的生物相容性是对骨、关节植入物的基本要求。钛及钛合金材料作为传统的骨、关节植入物,具有生物相容性好、强度高等优点,但其生物活性欠佳,细胞长入植体表面并获得初期稳定性的时间较长,且其弹性模量与骨组织相差较大,容易造成应力集中,影响植体的长期稳定性。
钽金属具有熔点高、强度大、耐腐蚀等理化性质和良好的生物相容性,有“亲生物”金属之称,植入体内后,生物组织易在其表面生长[1]。通过气相沉积和渗透方法,将微米或纳米级的钽粉涂覆于种植体表面[2-3],形成性能更优的钽涂层种植体。与普通钛种植体相比,钽涂层种植体具有更优异的骨整合能力,在体外表现为成骨细胞粘附增强,细胞增殖和分化增加,细胞凋亡减少,在体内表现为骨愈合效率增强[4]。在长期的循环负载过程中,应力劳损可使钽涂层种植体表面的钽颗粒脱落。这种脱落的磨损颗粒与种植体周围组织和细胞直接接触,引起一系列应激反应,可能影响骨形成和骨吸收的动态平衡。那么,钽涂层种植体表面脱落的钽颗粒对成骨细胞增殖有什么影响?其机制如何?
1 材料与方法
1.1 实验材料与试剂微米钽、纳米钽、Rapamy-cin、3-MA(Sigma-Aldrich,美国),MC3T3-E1细胞系(中国科学院上海生命科学研究院细胞库),alpha-MEM培养基(α-MEM,Invitrogen,美国)。
1.2 实验方法
1.2.1 钽颗粒准备用透射电镜和扫描电镜对钽颗粒的表面形貌进行表征。动态光散射法(dynamic light scattering,DLS)分析颗粒在溶剂中的团聚现象。钽颗粒经伽马射线钴-60(25Ggy)消毒后经超声乳化制成10 mg/mL微米钽和1 mg/mL纳米钽母液。
1.2.2 MC3T3-E1培养将MC3T3-E1接种于含10%FBS、1%双抗的α-MEM培养基,37℃、5%CO2培养。2~3 d换1次液,80%生长满度时消化传代。
1.2.3 CCK8实验(1)实验分组:为检测不同浓度钽颗粒对细胞增殖的影响,微米钽和纳米钽均设9个浓度梯度,分别是1 ng/mL、10 ng/mL、100 ng/mL、1 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL、100 μg/mL、1 mg/mL。检测共培养 6、12、24、48 h时细胞的OD值。为验证自噬在细胞增殖中的作用,分别用自噬诱导剂Rapamycin 200 nmol/L或自噬抑制剂3-MA 10 mmol/L预处理细胞1 h,然后加入0或20 μg/mL纳米钽,共培养24 h,测OD值。(2)测OD值:以1×103/孔的密度将MC3T3-E1接种于96孔板,孵育24 h待细胞贴壁后按实验分组进行相应处理。在预定时间点按CCK8说明书检测OD450nm值。利用公式计算细胞相对增殖率(relative growth rate,RGR):RGR=[(As-Ab)/(Ac-Ab)]×100%,其中As为实验孔OD值,Ac为对照孔OD值,Ab为空白孔OD值。
1.2.4 Western blot分为阴性对照组、阳性对照组(200 nmol/L Rapamycin预处理1 h)、实验组(与100 ng/mL微米钽或20 μg/mL纳米钽共培养)。取对数生长期、状态良好的细胞,以1×106/皿的密度接种于10 cm培养皿。24 h细胞贴壁后按实验分组进行相应处理,共培养24 h,检测自噬相关蛋白LC3B和p62表达。
1.2.5 激光共聚焦显微镜实验分组及处理同Western blot。将细胞以1×104/孔的密度接种于6孔板,24 h干预结束后加入含LC3B抗体(1∶200稀释)的完全培养基,培养1 h;然后加入含70 nmol/L LysoTracker®Red DND-99的完全培养基,培养1 h;再加入含Hoechst 33342(5 μg/mL)的PBS缓冲液处理20 min;最后用抗荧光猝灭剂封片,镜下观察LC3B标记的绿色荧光表达情况。
1.2.6 透射电镜实验分组及处理同Western blot。将细胞以1×104/孔的密度接种于6孔板,24 h干预结束后收集细胞,固定、脱水、包埋、切片、染色,镜下观察细胞的超微结构。
1.3 统计分析结果以均数±标准差表示,SPSS 22.0软件进行统计分析。组间采用单因素方差分析(One Way ANOVA)检验方差齐性。方差齐则进一步进行样本均数两两比较的LSD检验;方差不齐则采用Dunnett′s T3检验。检验水准α=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1 钽颗粒表征图1为钽颗粒的电镜和DLS表征结果。微米钽形状不规则,呈多面体或近球形,直径从100 nm到5 μm不等;纳米钽为形状较规则的圆球形,粒径约8~15 nm。微米钽的平均水合粒径为1281 nm,纳米钽的平均水合粒径为292 nm。
2.2 钽颗粒与细胞增殖图2为微米钽和纳米钽处理后细胞相对增殖率的柱形图。结果表明:就浓度因素而言,钽颗粒在低浓度时促增殖作用不明显,随着浓度加大,促增殖作用逐渐显现,100 ng/mL微米钽和20 μg/mL纳米钽最明显,之后与浓度负相关;就时间因素而言,钽颗粒在共培养初期时均抑制细胞生长,随着时间延长,其促增殖作用逐渐显现,虽然48 h时钽颗粒的促增殖作用也很明显,但此时细胞太密,状态欠佳,因此后续实验均共培养24 h。
2.3 细胞自噬的检测根据CCK8结果,筛选出促增殖作用最明显的100 ng/mL微米钽和20 μg/mL纳米钽,共培养24 h。
2.3.1 Western blot如图3所示,与阴性对照组相比,微米钽组的LC3-II和p62条带没有明显变化;纳米钽组的LC3-II和p62条带分别增强和减弱。灰度值分析也符合这个趋势:相较阴性对照组,微米钽组的LC3-II/LC3-I和p62/actin比值无明显差异(P>0.05);纳米钽组的LC3-II/LC3-I比值明显升高(P<0.01),p62/actin比值下降(P<0.05)。这些结果表明,微米钽组未检测到明显的细胞自噬,20 μg/mL纳米钽在促成骨细胞增殖的同时诱导了细胞自噬。
2.3.2 激光共聚焦显微镜纳米钽组可见明显的点状聚集的绿色荧光,微米钽组未见到明显的绿色荧光,表明纳米钽诱导了明显的细胞自噬(图4)。
2.3.3 透射电镜纳米钽组可见大量的自噬泡结构以及被细胞内吞的纳米钽颗粒;微米钽组无明显的自噬泡,可见膨胀的线粒体及变形的细胞器(图5)。说明纳米钽诱导了细胞自噬,而微米钽没有。
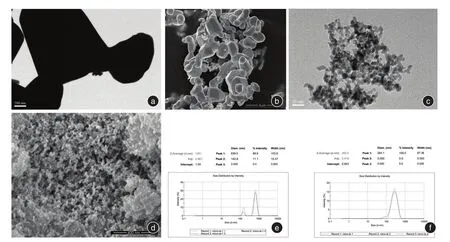
图1 钽颗粒表征Fig.1 Characterization of tantalum particles
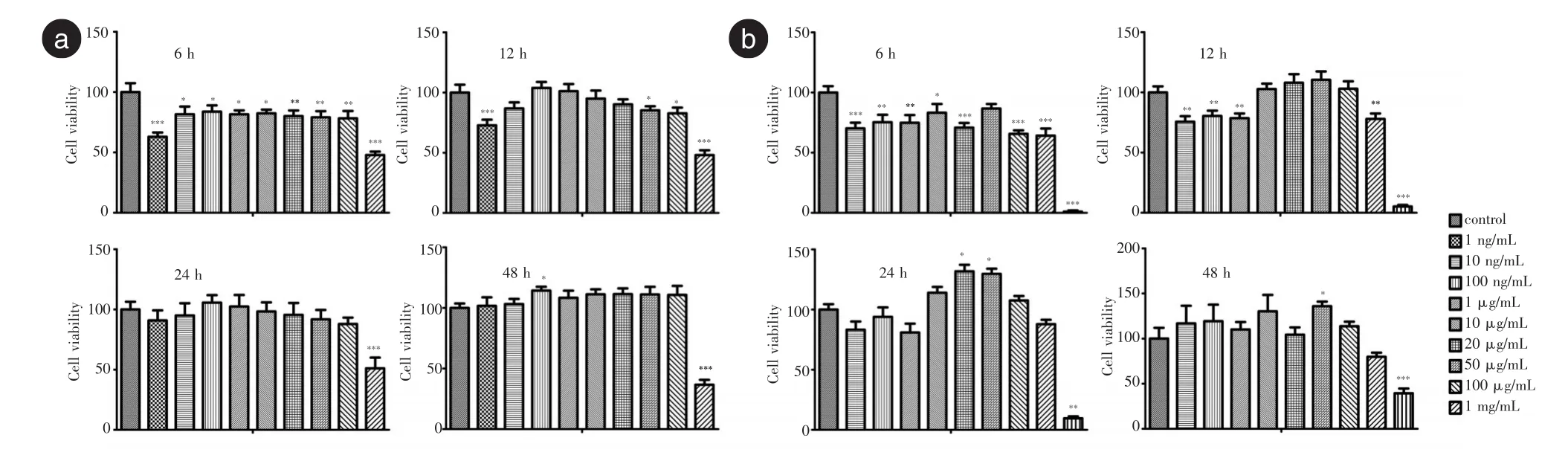
图2 微米钽和纳米钽处理后MC3T3-E1的相对增殖率Fig.2 RGR of MC3T3-E1 treated by micro-Ta and nano-Ta
2.4 自噬与细胞增殖由图6可见,自噬诱导剂或抑制剂单独处理对细胞增殖无明显影响;20 μg/mL纳米钽组,自噬诱导剂可促进细胞增殖,但无统计学差异(P>0.05),自噬抑制剂则显著抑制细胞增殖(P<0.001)。说明20 μg/mL纳米钽促进成骨细胞增殖可能主要通过诱导细胞自噬发挥作用,一旦自噬被抑制,其促增殖作用则被抵消,这为试图通过调节自噬水平而调控纳米钽的促增殖作用提供了依据。
3 讨论
成骨细胞是骨改建过程中最重要的功能细胞,主要负责骨基质的形成和钙化,在骨形成与矿化过程中发挥重要作用。作为最早接触磨损颗粒的细胞之一,成骨细胞对骨组织的代谢平衡起着重要作用。MC3T3-E1具有较高的细胞增殖能力,广泛用于各类有关成骨的研究中[5-6]。α-MEM培养基的精氨酸含量(592 μm)较DMEM培养基(367 μm)高,而MC3T3-E1生长需要消耗较多的精氨酸[7],因此MC3T3-E1在α-MEM培养基中增殖较快。

图3 Western blot检测自噬蛋白表达Fig.3 Expression of autophagy protein by Western Blot
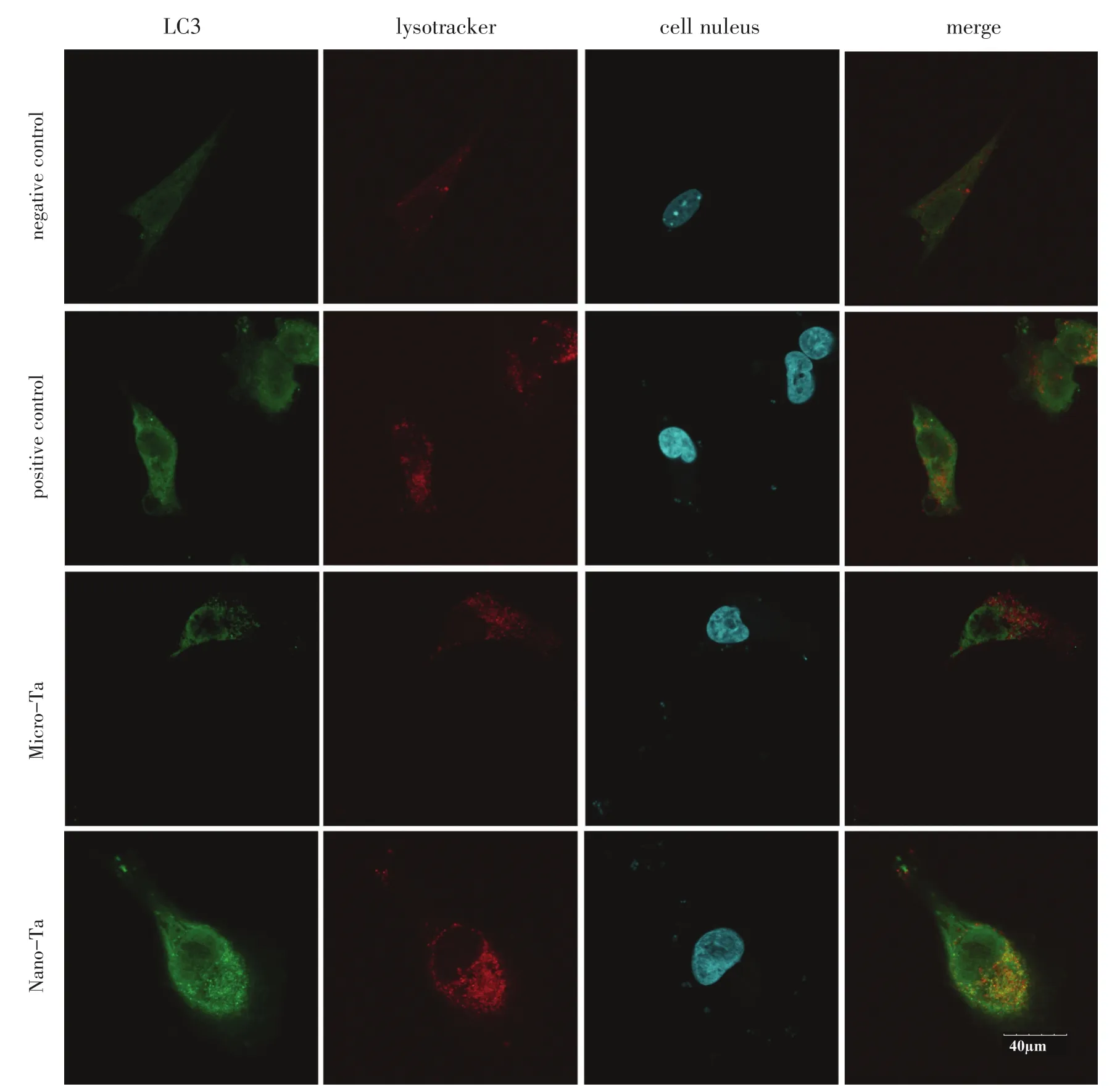
图4 激光共聚焦显微镜图像Fig.4 Laser confocal microscope image
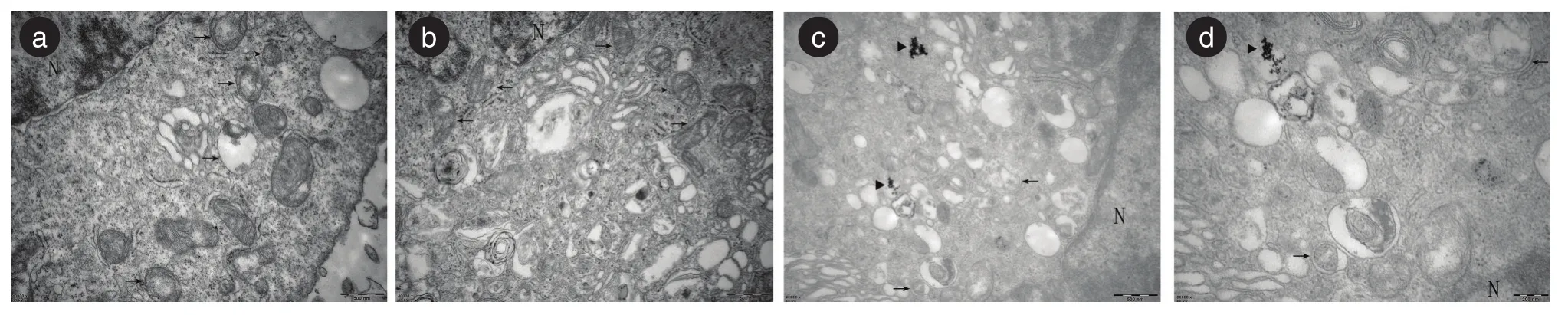
图5 透射电镜超微结构图Fig.5 Ultrastructure of transmission electron microscope
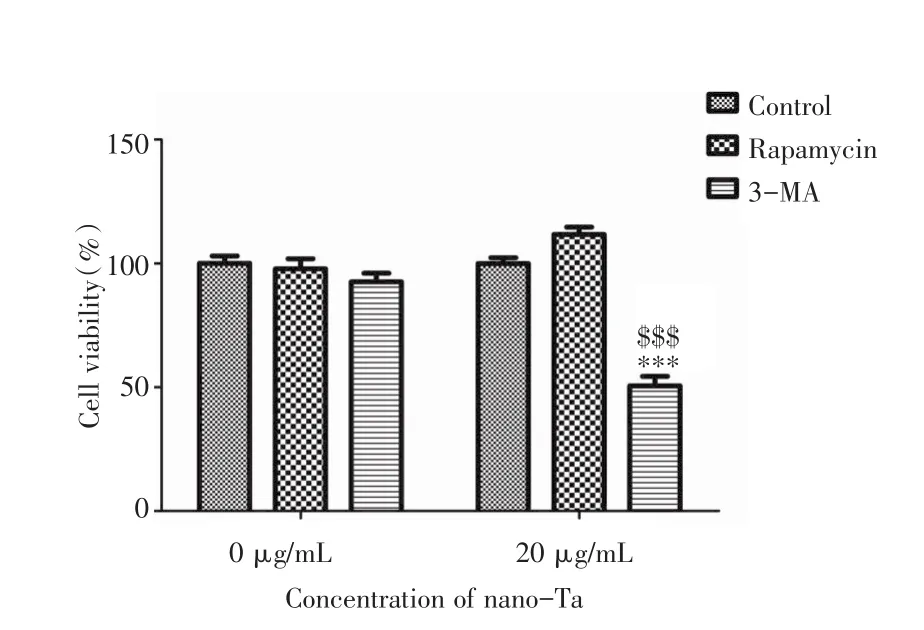
图6 纳米钽和自噬调节剂处理后MC3T3-E1的相对增殖率Fig.6 RGR of MC3T3-E1 treated by nano-Ta and autophagy regulator
传统的钛种植体存在骨愈合时间偏长、早期稳定性欠佳等问题。鉴于钽金属优异的生物学性能及其在骨科的广泛应用,钽涂层种植体正逐渐应用于口腔种植领域。SCHLEE等[8]对早期负重的钽涂层种植体进行为期1年的随访,发现其成功率为100%。另一个为期1年的多中心随机临床研究发现钽涂层种植体的成功率为95.2%[9],这些数据为钽涂层种植体的早期负重提供了理论支持。在长期的咬合负载下,种植体表面的涂层钽颗粒可能脱落,与种植体周围组织和细胞直接接触并引起一系列应激反应,可能影响种植体的长期效果。ZHU等[10]将钽薄膜涂覆的钛片浸于PBS溶液28 d,检测到<2 μg/mL钽的释放。BONUTTI等[11]报道,在一个使用多孔钽人工膝盖的全膝关节成形术后发生了钽金属颗粒的释放。因此,有必要深入研究钽颗粒对细胞生物学行为的影响。
目前有关钽片[12]、多孔钽[13-14]以及钽薄膜[10]、钽涂层[1,4]等的研究较多,而关于钽颗粒与细胞直接作用的研究却很少。临床上,长期的应力负载使钽涂层种植体表面的钽颗粒发生少量脱落,这些脱落的钽颗粒分散于种植体周围,与成骨细胞广泛接触。本文从研究细胞增殖入手,将成骨细胞与钽颗粒共培养以模拟植体周围磨损颗粒的微环境,结果发现微米钽和纳米钽分别在100 ng/mL和20 μg/mL时促增殖作用最明显;共培养初期对细胞增殖均有一定抑制作用,可能是培养初期细胞对“异物”钽颗粒的“排斥”反应,随着时间延长,钽颗粒的促增殖作用逐渐显现出来,细胞在低于阈值浓度钽颗粒的作用下,经历了“适应-共存”的过程,受损后又恢复,保持继续增殖[15]。由此可见,少量脱落的钽颗粒可促进成骨细胞增殖,这为保证钽涂层种植体的长期有效性提供了理论依据。
本实验还发现纳米钽的促增殖作用较微米钽更明显,促增殖的最佳浓度也不同,可能与各自的促增殖机制有关。HUO等[16]研究发现纳米晶相表面的钽比传统粗晶相表面的钽具有更高的表面亲水性和更强的耐腐蚀性。纳米物质有诱导细胞自噬的能力,而自噬是细胞降解受损细胞器和外来有害物质并转化为生长所需氨基酸、能量等物质的过程,可发挥促细胞生存作用[17-18]。细胞识别外来物质为异物,并将其吞噬、降解,引发包括自噬在内的一系列应激反应,以试图清除外来物质[19]。外来物质主要通过3种途径进入细胞:(1)小窝/脂筏介导的内吞作用:发生于膜富含胆固醇的区域(大约60~80 nm),与细胞信号调节有关;(2)网格蛋白介导的内吞作用:指受小窝蛋白等膜蛋白调控的膜内陷(~200 nm),与病原、营养和感受器的内在化有关;(3)巨胞饮/吞噬:指摄入营养物质和抗原等大的内陷(>0.2 μm),是细菌和病毒进入细胞的主要机制[20]。纳米颗粒的直径<100 nm,可通过小窝/脂筏介导的内吞作用进入细胞,之后被转移至溶酶体、内涵体、自噬体等结构[20],引发细胞自噬等应激反应。本研究发现纳米钽颗粒促增殖的同时诱导了细胞自噬发生。基于以上研究现状,笔者推测:纳米钽可能通过诱导成骨细胞自噬而发挥促增殖作用。为了验证这一推测,笔者运用自噬诱导剂或抑制剂干扰纳米钽诱导的自噬。结果发现自噬诱导剂或抑制剂本身对细胞增殖无明显影响,这与 YANG[5,18]等学者的研究结果一致。自噬抑制剂则显著抑制20μg/mL纳米钽诱导的细胞增殖,提示纳米钽可能主要通过诱导细胞自噬发挥促增殖作用,一旦自噬被抑制,其促增殖作用则被抵消。mTOR是调节自噬信号途径的关键信号分子,研究发现蒲黄总黄酮可通过抑制Akt/mTOR信号通路诱导细胞的自噬活动[21-23],纳米钽诱导成骨细胞自噬的分子机制和信号通路将是笔者下一步研究的内容。微米钽由于粒径较大,成骨细胞难以将其内吞,其促增殖的机制可能经由其他非自噬途径,这也将是我们今后探索的方向。
[1]BALLA V K,BANERJEE S,BOSE S,et al.Direct laser processing of a tantalum coating on titanium for bone replacement structures[J].Acta Biomater,2010,6(6):2329-2334.
[2]TRAN P A,FOX K,TRAN N.Novel hierarchical tantalum oxide-PDMS hybrid coating for medical implants:One pot synthesis,characterization and modulation of fibroblast proliferation[J].J Colloid Interface Sci,2017,485:106-115.
[3]FRANDSEN C J,BRAMMER K S,NOH K,et al.Tantalum coating on TiO2 nanotubes induces superior rate of matrix mineralization and osteofunctionality in human osteoblasts[J].Mater Sci Eng C Mater Biol Appl,2014,37:332-341.
[4]WANG L,HU X,MA X,et al.Promotion of osteointegration under diabetic conditions by tantalum coating-based surface modification on 3-dimensional printed porous titanium implants[J].Colloids Surf B Biointerfaces,2016,148:440-452.
[5]YANG J Y,PARK M Y,PARK S Y,et al.Nitric oxide-induced autophagy in MC3T3-E1 cells is associated with cytoprotection via AMPK activation[J].Korean J Physiol Pharmacol,2015,19(6):507-514.
[6]WANG X,FENG Z,LI J,et al.High glucose induces autophagy of MC3T3-E1 cells via ROS-AKT-mTOR axis[J].Mol Cell Endocrinol,2016,429:62-72.
[7]CONTRERAS R G,VILCHIS J R,SAKAGAMI H,et al.Type of cell death induced by seven metals in cultured mouse osteoblastic cells[J].In Vivo,2010,24(4):507-512.
[8]SCHLEE M,VAN DER SCHOOR W P,VAN DER SCHOOR A R.Immediate loading of trabecular metal-enhanced titanium dental implants:interim results from an international proof-of-principle study[J].Clin Implant Dent Relat Res,2015,17(Suppl 1):e308-320.
[9]SCHLEE M,PRADIES G,MEHMKE W U,et al.Prospective,multicenter evaluation of trabecular metal-enhanced titanium dental implants placed in routine dental practices:1-year interim report from the development period(2010 to 2011)[J].Clin Implant Dent Relat Res,2015,17(6):1141-1153.
[10]ZHU Y,GU Y,QIAO S,et al.Bacterial and mammalian cells adhesion to tantalum-decorated micro-/nano-structured titanium[J].J Biomed Mater Res A,2017,105(3):871-888.
[11]BONUTTI P M,PIVEC R,ISSA K,et al.Delamination of tantalum porous coating from a TKA due to regional dissemination of debris[J].Orthopedics,2013,36(8):600-604.
[12]ZHANG D,WONG C S,WEN C,et al.Cellular responses of osteoblast-like cells to 17 elemental metals[J].J Biomed Mater Res A,2017,105(1):148-158.
[13]NINOMIYA J T,STRUVE J A,KROLIKOWSKI J,et al.Porous ongrowth surfaces alter osteoblast maturation and mineralization[J].J Biomed Mater Res A,2015,103(1):276-281.
[14]BALLA V K,BODHAK S,BOSE S,et al.Porous tantalum structures for bone implants:fabrication,mechanical and in vitro biological properties[J].Acta Biomater,2010,6(8):3349-3359.
[15]SAKAI T,TAKEDA S,NAKAMURA M.The effects of particulate metals on cell viability of osteoblast-like cells in vitro[J].Dent Mater J,2002,21(2):133-146.
[16]HUO W T,ZHAO L Z,YU S,et al.Significantly enhanced osteoblast response to nano-grained pure tantalum[J].Sci Rep,2017,7:40868.
[17]KALUDEROVIC M R,MOJIC M,SCHRECKENBACH J P,et al.A key role of autophagy in osteoblast differentiation on titanium-based dental implants[J].Cells Tissues Organs,2014,200(3-4):265-277.
[18]YANG L,MENG H,YANG M.Autophagy protects osteoblasts from advanced glycation end products-induced apoptosis through intracellular reactive oxygen species [J].J Mol Endocrinol,2016,56(4):291-300.
[19]PEYNSHAERT K,MANSHIAN B B,JORIS F,et al.Exploiting intrinsic nanoparticle toxicity:the pros and cons of nanoparticleinduced autophagy in biomedical research [J].Chem Rev,2014,114(15):7581-7609.
[20]HA S W,WEITZMANN M N,BECK G R J R.Bioactive silica nanoparticles promote osteoblast differentiation through stimulation of autophagy and direct association with LC3 and p62[J].ACS Nano,2014,8(6):5898-5910.
[21]卢金婧.多发性硬化患者颅内深部灰质核团MRI的T2信号的定量分析及其临床意义[J].实用药物与临床,2017,20(4):412-415.
[22]王丹,孙刚,王瑶.蒲黄总黄酮含药血清对巨噬细胞自体吞噬及Akt/mTOR信号通路的影响[J].实用医学杂志,2017,33(16):2653-2657.
[23]蒋晶晶,姚鹏,田悦,等.NRG1-ErbB2信号通路对骨癌痛大鼠脊髓胶质细胞及IL-1β的影响[J].实用药物与临床,2016,19(6):657-660.

