靶向多肽R8-HBAP抑制成人T细胞白血病细胞恶性增殖*
宋早文, 张裕丰, 方金勇, 郭一孚, 刘越丹, 徐玲玲, 赵铁军
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
成人T细胞白血病(ATL)是一种恶性淋巴系统增殖性疾病[1].人类T淋巴细胞白血病1型病毒(HTLV-1)的感染与ATL的发生密切相关[2-3].迄今为止,尚无有效的预防及治疗ATL的手段[4].近30年的研究表明,HTLV-1编码的病毒蛋白在促进病毒感染复制、进而诱发成人T细胞白血病的过程中扮演极为重要的角色[2-3,5-6].因此,探索直接以HTLV-1病毒蛋白为靶点的新型疗法成为攻克该疾病的关键.
HTLV-1病毒基因组除正向编码结构基因gag,pol,env外,位于3’LTR和env之间的pX区还编码一系列调节基因Tax,Rex,p12,p13,p30和HBZ等,其中HBZ蛋白由HTLV-1反义链编码[7-8].HBZ蛋白包含3个功能结构域:N末端激活结构域(AD domain),C末端碱性亮氨酸拉链结构域(bZIP domain),以及位于中间的中央结构域(CD domain)[9-10].研究证明,HBZ蛋白的致癌功能通过其亮氨酸拉链结构域参与调节多条细胞信号传导途径得以实现[11-16].综合以上信息,本研究人工合成能有效封闭HBZ bZIP功能的靶向多肽——HBAP(HBZ bZIP associate peptide),并通过多聚精氨酸穿膜肽R8将HBAP携带入白血病细胞,观察其对肿瘤细胞恶性增殖起关键作用信号通路的抑制作用,最后运用MTT实验及流式细胞术观察该靶向多肽对白血病细胞的杀伤作用.这一研究成果将为我们研发抗病毒的药物提供一个全新的思路与策略.
1 材料与方法
1.1 细胞株和靶向多肽
成人T细胞白血病细胞株ATL-T,ATL-2,急性T细胞白血病细胞株Jurkat及人胚肾细胞293FT细胞,皆由日本京都大学松岗雅雄教授惠赠.
靶向多肽R8-HBAP:购于百奇生物科技(苏州)有限公司.
1.2 主要试剂与仪器
细胞培养基DMEM,RPMI-1640,胰蛋白酶为Invitrogen公司产品;抗体购自于Santa Cruze公司;胎牛血清购自法国Biowest公司;二甲基四氮唑盐(MTT)为Sigma公司产品;细胞冻存液Cellbanker购自上海微科生物技术有限公司;双荧光素酶报告基因试剂盒及质粒大提试剂盒购买自Promega公司;BCA蛋白定量试剂盒购自碧云天生物技术公司;丙烯酰胺、甘氨酸、苯甲基磺酰氟(PMSF)、三羟甲基氨基甲烷(Tris)、考马斯亮蓝G-250和R-250、十二烷基硫酸钠(SDS)、TrionX-100、脱脂奶粉等均购于生工生物工程(上海)股份有限公司.
生物安全柜、3111型CO2培养箱:Thermo公司;1500型全自动酶联免疫检测仪:美国热电公司.
1.3 细胞培养和药物处理
白血病细胞株(Jurkat、ATL-T和ATL-2)及人胚肾细胞293FT细胞分别培养于含10%胎牛血清和双抗(青、链霉素,100 IU/mL)的RPMI-1640和DMEM完全培养基中.细胞于37 ℃,5%CO2培养箱及饱和水蒸气条件下常规培养及传代,使用对数生长期细胞进行实验.
1.4 MTT法检测细胞活力
对数生长期的白血病细胞制成细胞悬液后,按1×105个/mL的密度接种于96孔板,90 μL/孔,以10 μL/孔的量加入0.05 mg/mL的靶向多肽R8-HBAP溶液,置于细胞培养箱分别孵育0,24,48,72和96 h后,加入MTT溶液10 μL,培养4 h后,加入100 μL裂解液室温振荡处理15 min.在595 nm波长下检测OD值.
1.5 双荧光素酶报告基因实验
表达HBZ和c-Jun蛋白的质粒及AP-1报告基因质粒共转染Jurkat细胞,再经靶向多肽处理细胞48 h后,裂解细胞,提取总蛋白.应用双荧光素酶报告基因试剂盒检测报告基因数值.
1.6 免疫共沉淀技术分析蛋白结合情况
靶向多肽处理转染有HBZ和c-Jun蛋白的293FT细胞,48 h后提取细胞的总蛋白.20 μL Protein G预处理1 mg总蛋白样品30 min后,收集上清蛋白,加入FLAG抗体,4 ℃旋转混匀1 h,再加入20 μL Protein G,4 ℃旋转混匀1 h.结合有抗体及目的蛋白的Protein G经过洗涤缓冲液漂洗5次后,煮沸变性,Western blot检测目的蛋白的表达水平.
1.7 统计方法
采用Origin 8.5软件作图,SPSS 19.0统计软件进行显著性检验,“*”P<0.05表示统计学上有显著性差异;“**”P<0.01表示统计学上有极显著性差异.
2 结 果
2.1 HBZ bZIP卷曲螺旋结构域分析
HTLV-1编码的病毒蛋白HBZ,其N端含有与c-Fos相似的亮氨酸拉链结构域,这一结构域参与了HBZ与c-Jun等亮氨酸拉链相关蛋白(JunB, JunD等)的互作,并影响了HBZ致癌功能的发挥[11-13].针对这一结合特性,靶向设计并合成能阻遏HBZ与c-Jun相关蛋白结合的多肽,将为治疗ATL提供新的技术和有效的手段.
c-Jun和c-Fos形成的复合物对细胞生命活动具有重要作用,因此,该靶向多肽不能干扰细胞Fos-Jun蛋白复合物的形成(见图1)[17-18].然而,由于HBZ与Fos的亮氨酸拉链结构域具有较高的相似性,这给设计针对HBZ的抑制性多肽带来一定的困难.HBZ和c-Fos与c-Jun相关蛋白之间的结合主要有赖于亮氨酸拉链结构域中的卷曲螺旋二聚体的形成(见图2).在以亮氨酸拉链结构为基础的异质二聚体中,结构域中的e位点和g位点之间的静电互作起到关键性作用.e—g位点之间的结合特性也成为设计人工异质二聚体的基础[19-20].然而,HBZ和c-Fos蛋白在e位和g位中电荷分布极其相似,均为g位点上有4个谷氨酸(Glu),e位点上有2个谷氨酸和其他中性氨基酸(见图2).

图1 设计能抑制HBZ蛋白功能的靶向多肽HBAP

图2 HBZ,c-Jun及c-Fos的卷曲螺旋结构域分析
此外,对c-Jun-c-Fos复合体的X射线单晶衍射分析和对卷曲螺旋肽测算分析显示,a位点和g位点的互作也可能是一个比较重要的因素.因此,根据亮氨酸拉链结构域中的a—g位点互作,笔者成功设计了基于c-Jun序列的突变型的亮氨酸拉链片段HBAP.这一片段的显著特点在于它对HBZ亮氨酸拉链的亲和性明显高于对c-Fos亮氨酸拉链的亲和性.
2.2 设计并合成靶向多肽R8-HBAP
结合上述设计原则,并在上述热力学分析的基础上,根据CANDI-PCA理论设计了6个能与HBZ蛋白bZIP结构域形成二聚体的多肽序列,并在每个多肽的C末端添加8个精氨酸R8的细胞穿膜肽(见表1).多聚精氨酸是一类人工合成的短肽,它由8个精氨酸残基构成,蛋白转导活性极强,可作为一种有潜力的药物输送载体.为了避免多肽之间发生相互作用,维持蛋白的构象及其生物学活性,在HBAP和R8序列间引入一个可弯曲的间隔区Acp.

表1 靶向多肽R8-HBAP序列
2.3 靶向多肽R8-HBAP抑制HBZ与c-Jun蛋白互作
随后,笔者研究了R8-HBAP是否能有效地与HBZ蛋白结合,从而干扰HBZ蛋白与c-Jun蛋白的互作.表达HBZ和c-Jun蛋白的载体pcDNA3-mycHis-HBZ和pCMV-HA-c-Jun共转染至293FT细胞,6 h后分别加入不同序列的R8-HBAP.处理48 h后,裂解细胞,免疫共沉淀实验检测蛋白结合情况.实验结果如图3所示,HBZ蛋白能与c-Jun蛋白结合,然而处理R8-HBAP后,多数靶向多肽均未呈现抑制效果,1b,2b和2c片段能显著抑制HBZ-c-Jun蛋白复合物的形成.后续研究中,将使用1b,2b和2c号靶向多肽进一步分析其抑制功能.

图3 靶向多肽R8-HBAP抑制HBZ与c-Jun蛋白的结合

图4 靶向多肽R8-HBAP抑制HBZ对AP-1信号通路的调控作用
2.4 靶向多肽R8-HBAP抑制HBZ对AP-1信号通路的调控作用
为了进一步研究R8-HBAP对HBZ调控的AP-1信号通路的作用,笔者采用了双荧光素酶报告基因技术.将HBZ和c-Jun表达质粒分别转染到对应组别的Jurkat细胞中,转染6 h后处理R8-HBAP,48 h后收集细胞,运用报告基因检测仪检测荧光值,结果如图4所示,HBZ可显著抑制由c-Jun激活的AP-1信号通路.当加入R8-HBAP后,HBZ对AP-1信号通路的抑制作用明显被抵消.该结果进一步证明,R8-HBAP能通过与HBZ结合,从而干扰HBZ与其他亮氨酸拉链蛋白的结合,进而影响到下游的信号通路.
2.5 靶向多肽R8-HBAP抑制白血病细胞恶性增殖
运用MTT技术分析R8-HBAP是否可以通过抑制HBZ的功能,从而影响白血病细胞的恶性增殖.MTT检测细胞活力发现,感染有HTLV-1病毒的ATL-T和ATL-2细胞在检测的96 h内细胞生长旺盛,但R8-HBAP的加入可以显著抑制白血病细胞ATL-T和ATL-2的恶性增殖(见图5).该结果证明,R8-HBAP可以通过与HBZ互作影响HBZ下游调控信号通路,最终抑制白血病细胞的生长.
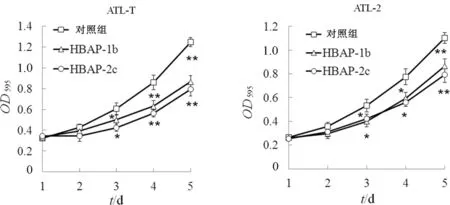
图5 HBAP抑制白血病细胞恶性增殖
2.6 R8-HBAP靶向多肽促进白血病细胞凋亡
为了进一步检测靶向多肽是否影响肿瘤细胞凋亡,笔者对多肽处理后的细胞进行Annexin V/7-AAD染色,流式细胞术检测发现,HBAP-1b多肽可诱导25.83%的ATL-T细胞发生凋亡.同样,HBAP-1b靶向多肽作用ATL-2细胞24 h后,流式细胞术检测发现,处理组细胞凋亡比率明显提高(见图6).

图6 HBAP诱导白血病细胞凋亡
综上所述,R8-HBAP可以通过抑制其蛋白结合能力,显著抑制白血病细胞恶性增殖,并促进细胞凋亡.
3 讨 论
20世纪70年代人们首次发现成人T细胞白血病(ATL),并证明人类T淋巴细胞白血病1型病毒(HTLV-1)与ATL的发生密不可分.至今的三十多年间,围绕ATL及HTLV-1开展的病毒学、免疫学和分子生物学上的研究取得了突破性的进展.然而在临床上,缺乏有效的治疗手段,预后效果不理想仍然是我们面临的最棘手问题.目前治疗ATL的方法主要包括化疗和干扰素治疗,但是疗效均不明显.其主要原因在于:1)在长期使用药物后,ATL细胞容易产生耐药性;2)ATL病人呈现免疫缺陷状态,易于遭受机会性感染[4].
HTLV-1和HIV同属于逆转录病毒家族.HTLV-1编码的病毒蛋白在促进感染细胞复制、诱发成人T细胞白血病的过程中起到举足轻重的作用.日本京都大学Matsuoka教授第一个深入研究了HBZ蛋白的功能,并阐明了它与ATL发病密切相关[21].研究发现HBZ是HTLV-1编码产物中唯一一个持续表达且不存在无义突变的基因.HBZ基因的缺失会显著抑制HTLV-1感染细胞的增殖能力.此外,HBZ蛋白参与调节多条细胞信号传导途经,进而促进T细胞分化,抑制宿主免疫反应,最终导致全身性炎症反应和T细胞淋巴瘤的发生[9-10].研究发现,HBZ蛋白通过其AD和bZIP结构域与NF-κB p65亚基结合,从而抑制经典NF-κB信号通路[16].此外,HBZ蛋白的AD和bZIP结构域可协同抑制C/EBPα,从而促进肿瘤细胞恶性增殖[14].另外有研究显示,HBZ蛋白通过其bZIP结构域与CREB,CREB2和p300/CBP形成蛋白复合物,负向调节Tax介导的病毒转录.此外,HBZ bZIP结构域可与c-Jun,JunB及JunD相互作用调节AP-1途径,从而帮助病毒逃避免疫攻击,抑制由病毒过度复制引起的宿主死亡[9-10].这些结果均表明,HBZ蛋白的持续表达在ATL发病机制中有着重要的意义.在这一系列过程中,HBZ bZIP结构域通过与多种转录因子结合的方式参与调控细胞内信号通路,进而导致白血病的发生.HBZ蛋白尤其是bZIP结构域在HTLV-1致癌过程的重要作用,为研究和开发ATL治疗措施提供了重要的靶点和线索.
因此,探索直接以HBZ蛋白作为靶点的新型治疗方法成为攻克该疾病的关键.这些病毒蛋白不仅成为区分感染细胞和正常细胞的重要标志,也成为肿瘤治疗药物的良好作用靶点.利用这一特点研制出一系列肿瘤靶向药物,如单克隆抗体、反义寡核苷酸等.但细胞膜具有选择渗透性,生物大分子药物无法通过细胞膜进入细胞内,而存在于细胞外的药物很难直接影响细胞内的生物反应,因此,促进药物穿透细胞膜的研究变得非常重要.
细胞穿膜肽(CPP)是一类具有细胞穿透功能的短肽的统称,一般少于30个氨基酸,它可以向细胞内运送各种自身不能穿越细胞膜的大分子生物活性物质,为生物治疗提供了一个崭新的有力工具.细胞穿膜肽在肿瘤治疗中的应用通常是将各种肿瘤特异性的治疗物质靶向运输到肿瘤组织及细胞内,从而起到抑制肿瘤细胞增生,促进肿瘤细胞凋亡的作用.CPP通过运送肿瘤特异性的治疗物质在一定程度上克服了肿瘤治疗缺乏靶向导入这一困难,提高了药物的利用效率,减少药物引起的毒副作用.目前已有许多关于应用CPP介导抗肿瘤药物显著抑制肿瘤细胞恶性表型,成功治疗肿瘤动物模型的报道[22].
通过本研究,首次以HTLV-1关键病毒蛋白HBZ为靶点研发治疗方法,找准了诱发ATL的关键因素,这一靶向治疗手段解决了传统的抗肿瘤药物对正常细胞的毒副作用.该研究为今后研究及设计抗HTLV-1和ATL的药物提供了一个全新的思路与策略.
参考文献:
[1]Takatsuki K.Discovery of adult T-cell leukemia[J].Retrovirology,2005,doi:10.1186/1742-4690-2-16.
[2]Uchiyama T,Yodoi J,Sagawa K,et al.Adult T-cell leukemia:Clinical and hematologic features of 16 cases[J].Blood,1977,50(3):481-492.
[3]Poiesz B J,Ruscetti F W,Gazdar A F,et al.Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma[J].Proc Natl Acad Sci USA,1980,77(12):7415-7419.
[4]Taylor G P,Matsuoka M.Natural history of adult T-cell leukemia/lymphoma and approaches to therapy[J].Oncogene,2005,24(39):6047-6057.
[5]Hinuma Y,Nagata K,Hanaoka M,et al.Adult T-cell leukemia:Antigen in an ATL cell line and detection of antibodies to the antigen in human sera[J].Proc Natl Acad Sci USA,1981,78(10):6476-6480.
[6]Yoshida M,Miyoshi I,Hinuma Y.Isolation and characterization of retrovirus from cell lines of human adult T-cell leukemia and its implication in the disease[J].Proc Natl Acad Sci USA,1982,79(6):2031-2035.
[7]Gaudray G,Gachon F,Basbous J,et al.The complementary strand of the human T-cell leukemia virus type 1 RNA genome encodes a bZIP transcription factor that down-regulates viral transcription[J].J Virol,2002,76(24):12813-12822.
[8]Nicot C,Harrod R L,Ciminale V,et al.Human T-cell leukemia/lymphoma virus type 1 nonstructural genes and their functions[J].Oncogene,2005,24(39):6026-6034.
[9]Zhao T,Matsuoka M.HBZ and its roles in HTLV-1 oncogenesis[J].Front Microbiol,2012,doi:10.3389/fmicb.2012.00247.
[10]Zhao T.The role of HBZ in HTLV-1-induced oncogenesis[J].Viruses,2016,doi:10.3390/v8020034.
[11]Basbous J,Arpin C,Gaudray G,et al.The HBZ factor of human T-cell leukemia virus type I dimerizes with transcription factors JunB and c-Jun and modulates their transcriptional activity[J].J Biol Chem,2003,278(44):43620-43627.
[12]Hivin P,Basbous J,Raymond F,et al.The HBZ-SP1 isoform of human T-cell leukemia virus type I represses JunB activity by sequestration into nuclear bodies[J].Retrovirology,2007,doi:10.1186/1742-4690-4-14.
[13]Matsumoto J,Ohshima T,Isono O,et al.HTLV-1 HBZ suppresses AP-1 activity by impairing both the DNA-binding ability and the stability of c-Jun protein[J].Oncogene,2005,24(6):1001-1010.
[14]Zhao T,Coutts A,Xu L,et al.HTLV-1 bZIP factor supports proliferation of adult T cell leukemia cells through suppression of C/EBPα signaling[J].Retrovirology,2013,doi:10.1186/1742-4690-10-159.
[15]Zhao T,Satou Y,Sugata K,et al.HTLV-1 bZIP factor enhances TGF-β signaling through p300 coactivator[J].Blood,2011,118(7):1865-1876.
[16]Zhao T,Yasunaga J,Satou Y,et al.Human T-cell leukemia virus type 1 bZIP factor selectively suppresses the classical pathway of NF-κB[J].Blood,2009,113(12):2755-2764.
[17]Wisdom R,Johnson R S,Moore C.c-Jun regulates cell cycle progression and apoptosis by distinct mechanisms[J].EMBO J,1999,18(1):188-197.
[18]Ameyar M,Wisniewska M,Weitzman J B.A role for AP-1 in apoptosis:The case for and against[J].Biochimie,2003,85(8):747-752.
[19]Mason J M,Arndt K M.Coiled coil domains:Stability,specificity,and biological implications[J].Chembiochem,2004,5(2):170-176.
[20]Litowski J R,Hodges R S.Designing heterodimeric two-stranded α-helical coiled-coils.Effects of hydrophobicity and α-helical propensity on protein folding,stability,and specificity[J].J Biol Chem,2002,277(40):37272-37279.
[21]Matsuoka M,Jeang K T.Human T-cell leukaemia virus type 1 (HTLV-1) infectivity and cellular transformation[J].Nat Rev Cancer,2007,7(4):270-280.
[22]Guidotti G,Brambilla L,Rossi D.Cell-penetrating peptides:From basic research to clinics[J].Trends Pharmacol Sci,2017,38(4):406-424.

