质子泵抑制剂对非甾体类抗炎药相关小肠黏膜损伤的影响
马文慧,赵 艳,和水祥
西安交通大学第一附属医院消化内科,陕西 西安 710061
非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)是一类有抗炎、镇痛、解热作用的药物,被广泛应用于治疗各种风湿性疾病、骨关节病及心脑血管疾病。研究[1]表明,NSAIDs可导致部分患者出现较严重的上消化道不良反应,包括消化道出血、消化性溃疡等。随着小肠镜、胶囊内镜等技术的出现,有研究显示,NSAIDs也可造成小肠黏膜损伤[2-3],文献[4-5]报道,质子泵抑制剂(proton pump inhibitors,PPI)可以降低NSAIDs相关上消化道黏膜损伤的风险,但其对小肠黏膜损伤的作用存在争议,有些观点认为,PPI因具有抗氧化、抗炎作用,对NSAIDs相关小肠黏膜损伤有保护作用,而另一些则认为PPI制剂对NSAIDs相关小肠黏膜损伤无作用,甚至有加重损伤的作用。
1 PPI对NSAIDs相关小肠黏膜损伤的保护作用
KURODA等[6]研究发现,在给大鼠皮下注射吲哚美辛及兰索拉唑后,与对照组相比,应用兰索拉唑的大鼠小肠黏膜硫代巴比妥酸反应物水平(thiobarbituric acid reactive substance,TRABS)、髓过氧化物酶(myeloperoxidase,MPO)活性及细胞因子诱导的中性粒细胞趋化因子1(cytokine-induced neutrophil chemoattractant-1,CINC-1)的蛋白及相关mRNA水平均明显下降,因此得出结论:因兰索拉唑有抗炎、抗氧化作用而对吲哚美辛诱导的小肠损伤有保护作用。在YODA等[7]的研究中,那些在服用吲哚美辛前预先服用兰索拉唑的大鼠,其小肠黏膜损伤的严重程度、小肠黏膜的MPO活性、诱导型一氧化氮合酶(inducible nitric oxide synthesis,iNOS)mRNA表达水平均明显降低,不仅如此,兰索拉唑组的大鼠小肠黏膜的血红素氧合酶-1(heme oxygenase-1,HO-1)明显增加,而预先注射了锡原卟啉(HO-1的抑制剂)的大鼠,小肠黏膜损伤明显加重;而腹腔注射一氧化碳释放因子的大鼠,小肠黏膜损伤的严重程度明显降低了,从而得出结论:兰索拉唑通过产生HO-1/CO对吲哚美辛诱导的小肠溃疡有保护作用;国内也有文献[8]报道,雷贝拉唑因为产生HO-1对吲哚美辛诱导的小肠损伤具有保护作用。
2 PPI对NSAIDs相关小肠黏膜损伤没有保护作用甚至加重其损伤
WALLACE等[9]研究认为,PPI会加重NSAIDs相关小肠损伤,他们分别给大鼠服用奥美拉唑(10 mg/kg,bid)、兰索拉唑(10 mg/kg,bid)共9 d,在后4 d两组均给予萘普生(10 mg/kg,bid),主要观察大鼠小肠出血性损伤的总长度及服药前后红细胞压积的变化。实验结果显示,与对照组相比,给正在服用PPI的大鼠服用萘普生时,小肠损伤明显加重,肠腔中出血性溃疡的数量明显增多,且红细胞压积显著下降,而单独服用萘普生或PPI则无这种影响;此外,用COX-2抑制剂塞来昔布代替萘普生重复上述实验时,得到了相似的结论:单独服用塞来昔布组小肠损伤的平均得分为(0.5±0.3)分;而奥美拉唑+塞来昔布组损伤加重,平均得分为(35.1±4.6)分(P<0.001)。
2.1PPI对NSAIDs相关小肠黏膜损伤发生率的影响WASHIO等[10]的前瞻性、双盲、随机对照试验得出结论:PPI加重NSAIDs相关小肠损伤。他们将57名健康志愿者随机分为试验组(雷贝拉唑20 mg,qd+塞来昔布200 mg,bid),对照组(塞来昔布200 mg,bid+安慰剂),上述药物服用时间为2周。通过对比服药前后的胶囊内镜结果,得到试验组小肠黏膜损伤(溃疡及糜烂)的发生率为44.4%(12/27),而对照组为16.7%(5/30)(P=0.04)。PPI明显增加了NSAIDs相关小肠黏膜损伤的风险(RR=2.67,95%CI:1.08~6.58)。KURAMOTO等[11]的随机对照试验研究认为,奥美拉唑没有降低小肠黏膜损伤的发生率,他们让健康志愿者服用奥美拉唑(10 mg,qd)及双氯芬酸(75 mg,qd)共2周后,小肠黏膜损伤发生率为81.3%(13/16),而对照组(伊索拉定40 mg,qd 2周)的发生率则为37.5%(6/16)(P=0.012)。但以上研究对象均为健康志愿者,且服药时间较短(2周)。WATANABE等[12]的横断面研究共纳入108例服用NSAIDs时间大于3个月的类风湿性关节炎患者,对同时服用PPI的患者进行分析后,认为PPI与NSAIDs相关小肠损伤发生率无相关性(OR=2.29,95%CI:0.95~5.55,P=0.07)。而ENDO等[13]的横断面研究则认为,应用PPI是使用小剂量阿司匹林(75~325 mg)患者发生小肠损伤的危险因素(OR=2.04,95%CI:1.05~3.97,P=0.04)。此外,ISHIHARA等[14]的病例对照研究认为,PPI与NSAIDs相关小肠损伤发生率无相关性(OR=1.59,95%CI:0.601~4.208,P=0.35)(见表1)。LICHTENBERGER等[15]的研究认为,PPI没有减少吲哚美辛相关的小肠损伤。对于非随机对照研究,虽然患者服药时间较长,且样本量相对较大,但不能完全排除存在其他可能引起消化道出血因素,因此,如要得出更可靠的结论,仍需大量的随机对照试验来验证。
2.2PPI对NSAIDs相关小肠黏膜损伤数目及严重程度的影响WASHIO等[10]的研究中小肠糜烂的数目在试验组(服用PPI)明显高于对照组(未服用PPI)(P=0.02),而小肠溃疡的数目无明显差异。此外,他们认为小肠黏膜损伤更多的发生在空肠,而不是回肠(26%vs0,P=0.003)。KURAMOTO等[11]的研究中,试验组(服用PPI)的小肠黏膜损伤数目明显增加,从(0.1±0.3增加到1.9±2.0,P<0.001)。在WATANABE等[12]的研究中,PPI与小肠黏膜损伤发生率无相关性,但服用PPI是重度小肠黏膜损伤的独立危险因素(OR=5.22,95%CI:1.28~12.25,P=0.02);而ENDO等[13]的研究认为,PPI是中度小肠黏膜损伤的独立危险因素(OR=5.81,95%CI:2.86~11.8,P<0.001)。
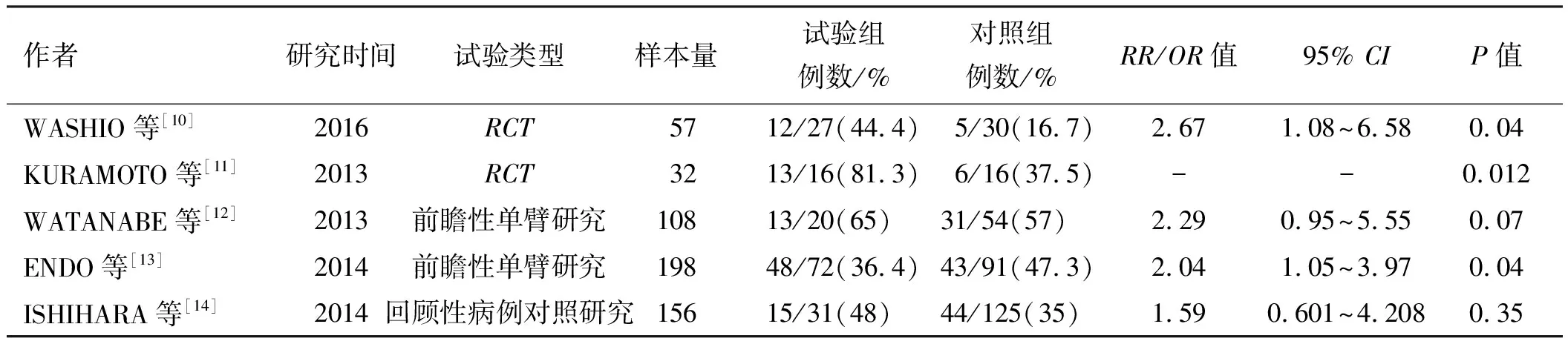
表1 PPI对NSAIDs相关小肠黏膜损伤作用的临床研究Tab 1 The clinical studies of the effects of PPI on NSAID-induced small intestinal injury
注:试验组:既口服PPI又口服NSAIDs的志愿者或患者,PPI包括奥美拉唑、雷贝拉唑等,NSAIDs包括塞来昔布、双氯芬酸、小剂量阿司匹林等。对照组:口服安慰剂或其他黏膜保护剂的志愿者或患者。
2.3PPI因导致小肠菌群失调而加重NSAIDs相关小肠黏膜损伤最近实验研究发现,肠道菌群,尤其是革兰氏阴性菌在NSAIDs相关小肠黏膜损伤的发生中起到关键性作用[15-16],胃酸可以杀死大多数细菌,PPI抑制胃酸导致小肠菌群的过度生长[17-18],因此PPI因导致菌群失调而加重小肠损伤。WALLACE等[9]的实验研究也证实,单独使用PPI不能加重小肠的炎症及损伤,但PPI的使用导致小肠的菌群失调,从而加重了小肠黏膜的损伤。
3 结语
综上所述,尽管前期的动物实验推测PPI制剂可能会对NSAIDs相关小肠损伤具有保护作用,但后期的一系列临床试验均表明,PPI制剂对NSAIDs相关小肠黏膜损伤没有保护作用,甚至会加重损伤,其发生的机制可能与PPI的使用导致小肠的菌群失调有关。此外,PPI制剂的种类、NSAIDs的种类不同是否会对NSAIDs相关小肠黏膜损伤产生不同的作用尚不明确。目前的试验还存在许多问题,如样本量较小、多开展在健康人群中、观察时间较短、随机对照试验较少等。因此,PPI对NSAIDs相关小肠损伤的影响及其发生机制还需大规模的随机对照试验来探索。
[1] 肖克臣, 邹江. 非甾体抗炎药相关上消化道出血危险因素分析[J]. 胃肠病学和肝病学杂志, 2017, 26(9): 1035-1039. DOI: 10.3969/j.issn.1006-5709.2017.09.019.
XIAO K C, ZOU J. Analysis of risk factors of upper gastrointestinal bleeding induced by non-steroidal anti-inflammatory drugs [J]. Chin J Gastroenterol Hepatol, 2017, 26(9): 1035-1039. DOI: 10.3969/j.issn.1006-5709.2017.09.019.
[2] OTA K, TAKEUCHI T, NOUDA S, et al. Determination of the adequate dosage of rebamipide, a gastric mucoprotective drug, to prevent low-dose aspirin-induced gastrointestinal mucosal injury [J]. J Clin Biochem Nutr, 2016, 59(3): 231-237. DOI: 10.3164/jcbn.16-49.
[3] UENO Y, NAKAMURA M, WATANABE O, et al. COX-2 inhibitory NSAID-induced multiple stenosis in the small intestine diagnosed by double-balloon endoscopy [J]. Nagoya J Med Sci, 2016, 78(3): 323-328.
[4] SAKAKI N, ASHIDA K, MIZOKAMI Y, et al. Endoscopic evaluation of low-dose aspirin-induced gastric and duodenal ulcer during prophylaxis with lansoprazole [J]. Hepatogastroenterology, 2013, 60(124): 762-767. DOI: 10.5754/hge12920.
[5] ABRAHAM N S, HLATKY M A, ANTMAN E M, et al. ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines: a focused update of the ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use [J]. Am J Gastroenterol, 2010, 105(12): 2533-2549. DOI: 10.1038/ajg.2010.445.
[6] KURODA M, YOSHIDA N, ICHIKAWA H, et al. Lansoprazole, a proton pump inhibitor, reduces the severity of indomethacin-induced rat enteritis [J]. Int J Mol Med, 2006, 17(1): 89-93.
[7] YODA Y, AMAGASE K, KATO S, et al. Prevention by lansoprazole, a proton pump inhibitor, of indomethacin-induced small intestinal ulceration in rats through induction of heme oxygenase-1 [J]. J Physiol Pharmacol, 2010, 61(3): 287-294.
[8] 袁宇红, 于涛, 钟娃, 等. 雷贝拉唑对非甾体抗炎药诱导小肠损伤的保护作用及可能机制研究[J]. 中国现代医学杂志, 2015, 25(20): 1-6. DOI: 1005-8982(2015)20-0001-06.
YUAN Y H, YU T, ZHONG W, et al. Protective effect of rabeprazole on indomethacin-induced small intestinal injury and its possible mechanism [J]. China Journal of Modern Medicine, 2015, 25(20): 1-6. DOI: 1005-8982(2015)20-0001-06.
[9] WALLACE J L, SYER S, DENOU E, et al. Proton pump inhibitors exacerbate NSAID-induced small intestinal injury by inducing dysbiosis [J]. Gastroenterology, 2011, 141(4): 1314-1322, e1-e5. DOI: 10.1053/j.gastro.2011.06.075.
[10] WASHIO E, ESAKI M, MAEHATA Y, et al. Proton pump inhibitors increase incidence of nonsteroidal anti-inflammatory drug-induced small bowel injury: a randomized, placebo-controlled trial [J]. Clin Gastroenterol Hepatol, 2016, 14(6): 809-815.e1. DOI: 10.1016/j.cgh.2015.10.022.
[11] KURAMOTO T, UMEGAKI E, NOUDA S, et al. Preventive effect of irsogladine or omeprazole on non-steroidal anti-inflammatory drug-induced esophagitis, peptic ulcers, and small intestinal lesions in humans, a prospective randomized controlled study [J]. BMC Gastroenterol, 2013, 13: 85. DOI: 10.1186/1471-230X-13-85.
[12] WATANABE T, TANIGAWA T, NADATANI Y, et al. Risk factors for severe nonsteroidal anti-inflammatory drug-induced small intestinal damage [J]. Dig Liver Dis, 2013, 45(5): 390-395. DOI: 10.1016/j.dld.2012.12.005.
[13] ENDO H, SAKAI E, TANIGUCHI L, et al. Risk factors for small-bowel mucosal breaks in chronic low-dose aspirin users: data from a prospective multicenter capsule endoscopy registry [J]. Gastrointest Endosc, 2014, 80(5): 826-834. DOI: 10.1016/j.gie.2014.03.024.
[14] ISHIHARA M, OHMIYA N, NAKAMURA M, et al. Risk factors of symptomatic NSAID-induced small intestinal injury and diaphragm disease [J]. Aliment Pharmacol Ther, 2014, 40(5): 538-547. DOI: 10.1111/apt.12858.
[15] LICHTENBERGER L M, BHATTARAI D, PHAN T M, et al. Suppression of contractile activity in the small intestine by indomethacin and omeprazole [J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308(9): G785-G793. DOI: 10.1152/ajpgi.00458.2014.
[16] WATANABE T, NISHIO H, TANIGAWA T, et al. Probiotic Lactobacillus casei strain Shirota prevents indomethacin-induced small intestinal injury: involvement of lactic acid [J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(3): G506-G513. DOI: 10.1152/ajpgi.90553.2008.
[17] LOMBARDO L, FOTI M, RUGGIA O, et al. Increased incidence of small intestinal bacterial overgrowth during proton pump inhibitor therapy [J]. Clin Gastroenterol Hepatol, 2010, 8(6): 504-508. DOI: 10.1016/j.cgh.2009.12.022.
[18] COMPARE D, PICA L, ROCCO A, et al. Effects of long-term PPI treatment on producing bowel symptoms and SIBO [J]. Eur J Clin Invest, 2011, 41(4): 380-386. DOI: 10.1111/j.1365-2362.2010.02419.x.

