星点设计-效应面法优化枳雀内果皮柠檬苦素提取工艺
孙小雯,彭 颖,何婉莺,李小燕,潘思轶
(华中农业大学食品科技学院 环境食品学教育部重点实验室,湖北武汉 430070)
枳雀是陕西省南部的一个天然品种,果皮较厚,有光滑和粗糙两种类型,果实近球形,中心柱充实果基微凹,果顶圆且有印圈[1],其抗寒性强,可做耐寒砧木[2],果实味苦,当地人常将小果风干后磨成粉末或晒干青果作药用。由于味苦,使枳雀成为苦味物质和功能成分研究中的重要材料[1-2]。
有研究表明,柑橘类产生苦味的主要原因之一是其含有类柠檬苦素质[3-4]。柠檬苦素具有抗癌、抗炎、抗疟疾、抗 HIV 活性等生理活性,具有降低胆固醇、清除肺部充血性粘膜等功能[5-11]。
目前,提取柠檬苦素类的方法主要有传统的有机溶剂提取法[4,12-15],特点是提取率高,操作简便,但也存在溶剂残留、污染环境等问题[14-15],常用有机溶剂有丙酮、甲醇、乙醇等。异丙苯磺酸钠具有特定的亲水-亲油双亲结构,可降低细胞膜与水溶液间的界面张力,增加细胞内外浓度差,提高细胞内部系统含水量,是可提高物质的溶解能力的表面活性剂[16-19]。有报道称,水溶助剂的助溶作用变化规律为:当水溶助剂浓度在最小助溶浓度之上时,其助溶作用几乎呈指数上升,但水溶助剂到达一定浓度之后,其助溶作用不会再升高,且当用水溶助剂溶液被稀释至其最小助溶浓度以下时,可回收析出的目标提取物[18-19]。刘君[17]、曾玉聪[20]等曾用水溶助剂法提取柑橘种子中的柠檬苦素,但用水溶助剂法提取枳雀中柠檬苦素的工艺研究却鲜有报道。
本文用异丙苯磺酸钠为水溶助剂,代替传统的有机溶剂,以异丙苯磺酸钠浓度、用量、浸提时间3个因素为响应因子,以柠檬苦素得率(mg/g)为响应值,优化枳雀内果皮中柠檬苦素的提取工艺参数。
1 材料与方法
1.1 材料与仪器
枳雀 产地陕西;柠檬苦素标准品 上海源叶生物科技有限公司;乙醇、异丙苯磺酸钠、醋酸、高氯酸 国药集团化学试剂有限公司;对二甲氨基苯甲醛 上海阿拉丁生化科技股份有限公司。
QE-100克高速万能粉碎机 浙江屹立工贸有限公司;LGJ-18S冷冻干燥机 北京松源华兴科技发展有限公司;AX124ZH电子天平 奥豪斯仪器有限公司;WE-1水浴恒温振荡器 天津市欧诺仪器仪表有限公司;TDL-5-A离心机 上海安亭科学仪器厂;752E紫外分光光度计 天津冠泽科技有限公司。
1.2 实验方法
1.2.1 标准曲线的绘制 指示剂的制备:按冰醋酸∶高氯酸(V∶V)为5∶4的比例制得酸母液备用,按每30 mL酸母液加入1.11 g对二甲氨基苯甲醛的比例制得指示剂,指示剂现用现配[17,20]。
准确吸取0.2 mg/mL的柠檬苦素对照品溶液0、0.5、1.0、1.5、2.0、2.5、3.0、4.0 mL,分别置于4 mL容量瓶中,用2 mol/L的异丙苯磺酸钠溶液定容至4.0 mL,在40 ℃静置6 h,分别取各浓度标准液2.0 mL,快速加入显色剂和酸母液各3.0 mL,摇匀,静置30 min,以第一试管做空白,在最大吸收波长470 nm处测定吸光度[17]。以吸光度(y)为纵坐标,柠檬苦素(x)浓度为横坐标,绘制标准曲线,标准曲线方程为y=1.809x+0.002,R2=0.9990。
1.2.2 样品中柠檬苦素含量测定 枳雀内果皮在-40 ℃,真空度4 Pa条件下冻干30 h并粉碎后,过40目筛,干燥保存,备用。精密称取2.0 g枳雀内果皮粉末,在不同条件下用水溶助剂溶液提取,所得提取液定容于100 mL容量瓶中,取2.0 mL按照1.2.1所示方法进行操作,将所测样品吸光度值带入上述标准曲线方程,求得提取液中的柠檬苦素浓度(mg/mL),进而计算出样品中柠檬苦素得率(mg/g)。
柠檬苦素得率(mg/g)=样品溶液中柠檬苦素浓度×样品溶液体积/样品质量
1.2.3 单因素实验 精密称取2.0 g枳雀内果皮粉末,固定温度为40 ℃,水溶助剂浓度2.0 mol/L,水溶助剂用量30 mL/g,提取时间6 h,分别考察不同水溶助剂浓度(0.5、1.0、1.5、2.0、2.5、3.0 mol/L)、水溶助剂用量(15、20、25、30、35 mL/g)、提取时间(3.0、4.5、6.0、7.5、9.0 h)对柠檬苦素提取量的影响,每组实验重复3次,以确定各因素的恰当范围。
1.2.4 星点实验 根据单因素实验结果,选取水溶助剂用量(X1)、水溶助剂浓度(X2)、提取时间(X3)3个因素做自变量,利用Design-Expert 8.0软件,按星点设计方法设定因素水平表[21],见表1,每组实验重复3次。

表1 星点设计因素与水平
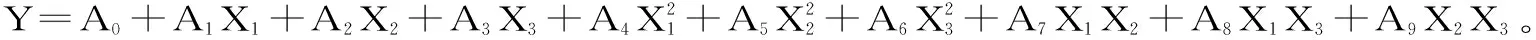
以效应值为纵坐标,固定3个自变量之一为中值,其他两个自变量为横坐标,利用Design-Expert 8.0软件绘制三维效应面图及等高线图。由图中的效应值选取最佳自变量值范围,分析得出回归模型最大值,并用效应面法得出的最佳工艺条件提取枳雀内果皮中柠檬苦素,经验证实验,最终得到优化的提取工艺条件。
1.3 数据统计分析
使用Excel软件对实验数据进行ANOVA方差分析。
2 结果与分析
2.1 单因素实验
2.1.1 水溶助剂用量对柠檬苦素得率的影响 由图1可知,随着水溶助剂用量增加,枳雀内果皮粉末与提取液的接触面的浓度变大,水溶助剂溶液用量的增加有助于柠檬苦素的浸出,但当溶剂用量到30 mL/g之后,柠檬苦素得率稳定,说明当水溶助剂用量为30 mL/g时,柠檬苦素已基本提取完全,此时继续增加溶剂用量,不仅会造成单位提取液中柠檬苦素含量降低,而且浪费溶剂和能源,也给后续的浓缩提纯工作带来困难[17,20],故30 mL/g为提取柠檬苦素的适宜用量。
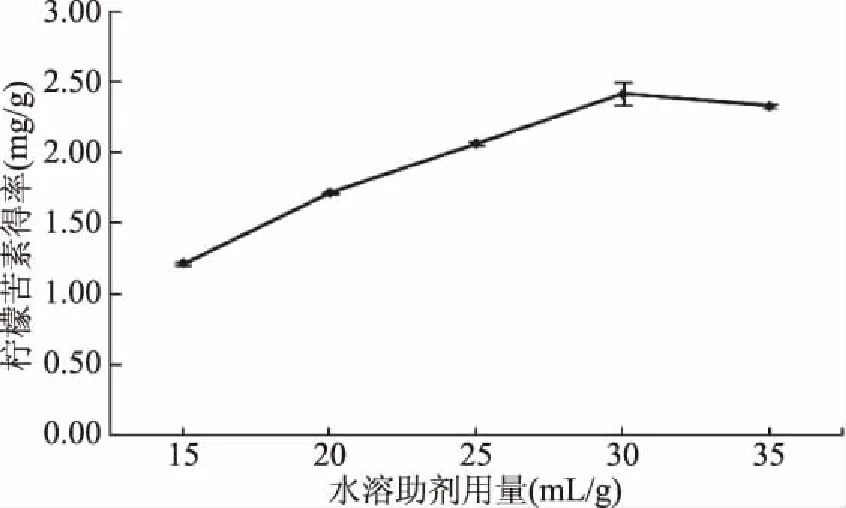
图1 水溶助剂用量对枳雀内果皮中檬苦素得率的影响
2.1.2 水溶助剂浓度对柠檬苦素得率的影响 由图2可知,随着水溶助剂浓度的增加,柠檬苦素得率先增加后略有减少,可能是水溶助剂浓度升高,提取物中非目标成分增加,可能会影响柠檬苦素纯度[17],因此选择水溶助剂2.0 mol/L为提取柠檬苦素的适宜用浓度。
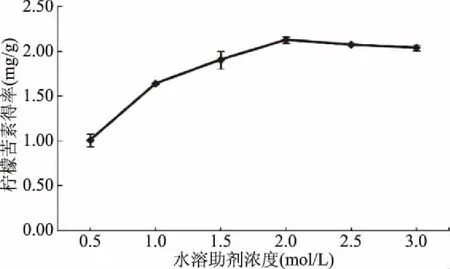
图2 水溶助剂浓度对枳雀内果皮中柠檬苦素得率的影响
2.1.3 提取时间对柠檬苦素得率的影响 由图3可知,随着提取时间增长,柠檬苦素提取量增加,但7.5 h以后柠檬苦素提取量稳定,提取时间延长不会引起柠檬苦素提取量的变化,故选择7.5 h为适宜提取时间。
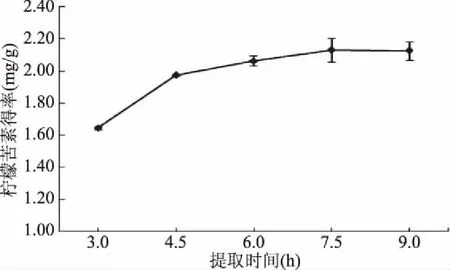
图3 提取时间对枳雀内果皮中柠檬苦素得率的影响
2.2 星点实验
2.2.1 星点设计实验结果 根据单因素实验结果,确定星点设计因素范围,星点设计实验结果如表2所示。
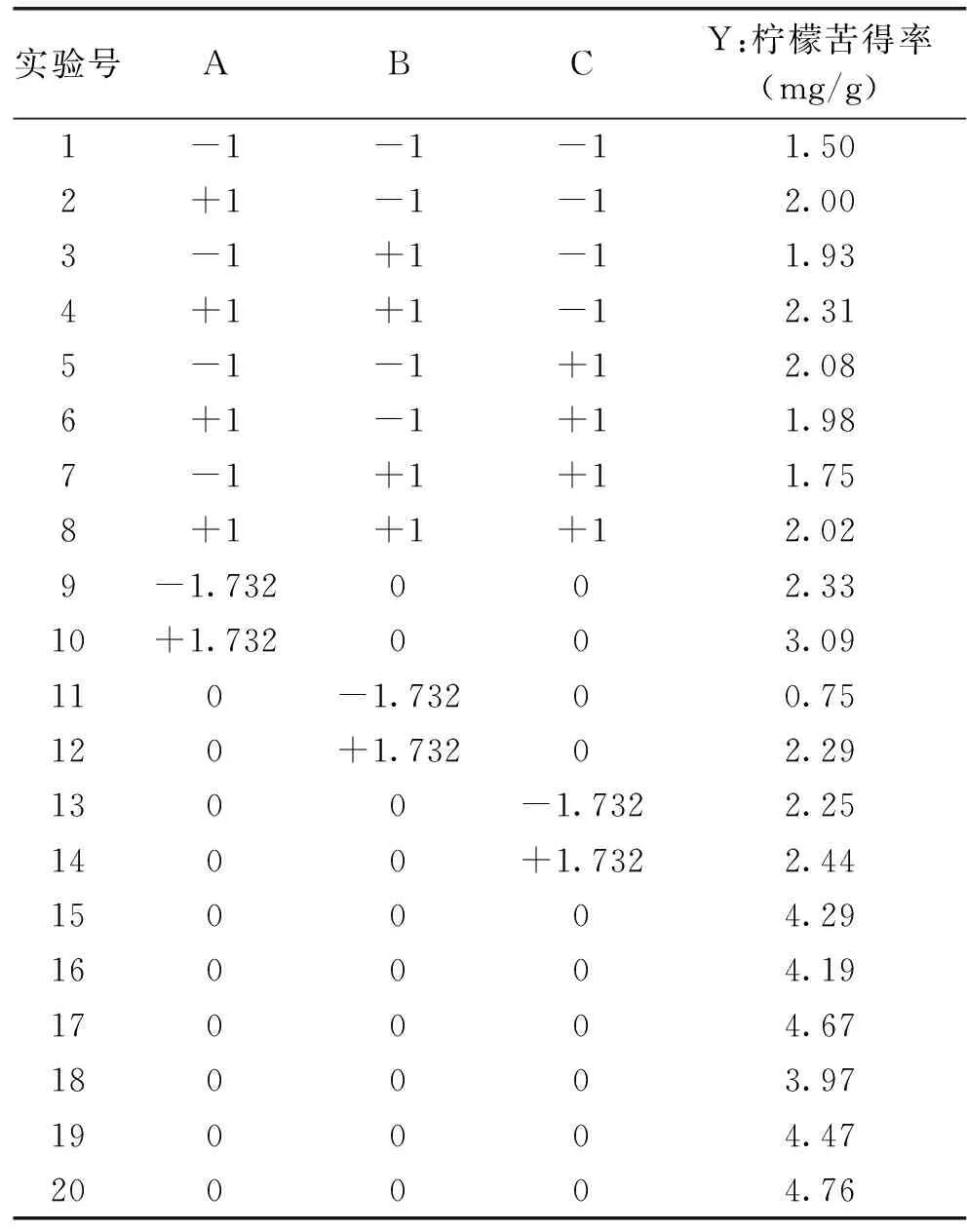
表2 星点实验设计及结果
2.2.2 回归模型的建立及显著性分析 以水溶助剂用量(X1)、水溶助剂浓度(X2)、提取时间(X3)为自变量,柠檬苦素得率(mg/g)为因变量,采用Design-Expert 8.0软件对结果进行多元线性回归和二项式拟合。
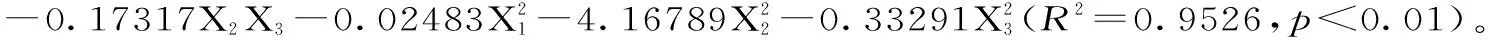
Design-Expert 8.0软件对表2的星点设计数据进行回归方差分析如表3所示。由表3可知:二项方程的R2=0.9526,且p<0.01,说明二项式模型的拟合度好,预测可靠性更佳。对上述二项式模型进行显著性检验(见表3),p值大小可判断各因素对柠檬苦素得率的影响,B对柠檬苦素的提取影响显著(p<0.05)。同时,A2、B2、C2对柠檬苦素得率的影响极显著(p<0.01),A、C一次项都不显著(p>0.05),说明具体实验因子对效应值得影响不是简单的线性关系。因此,宜采用二项式模型进行拟合。结果显示各因素对柠檬苦素得率的影响次序为:水溶助剂浓度>水溶助剂用量>提取时间。
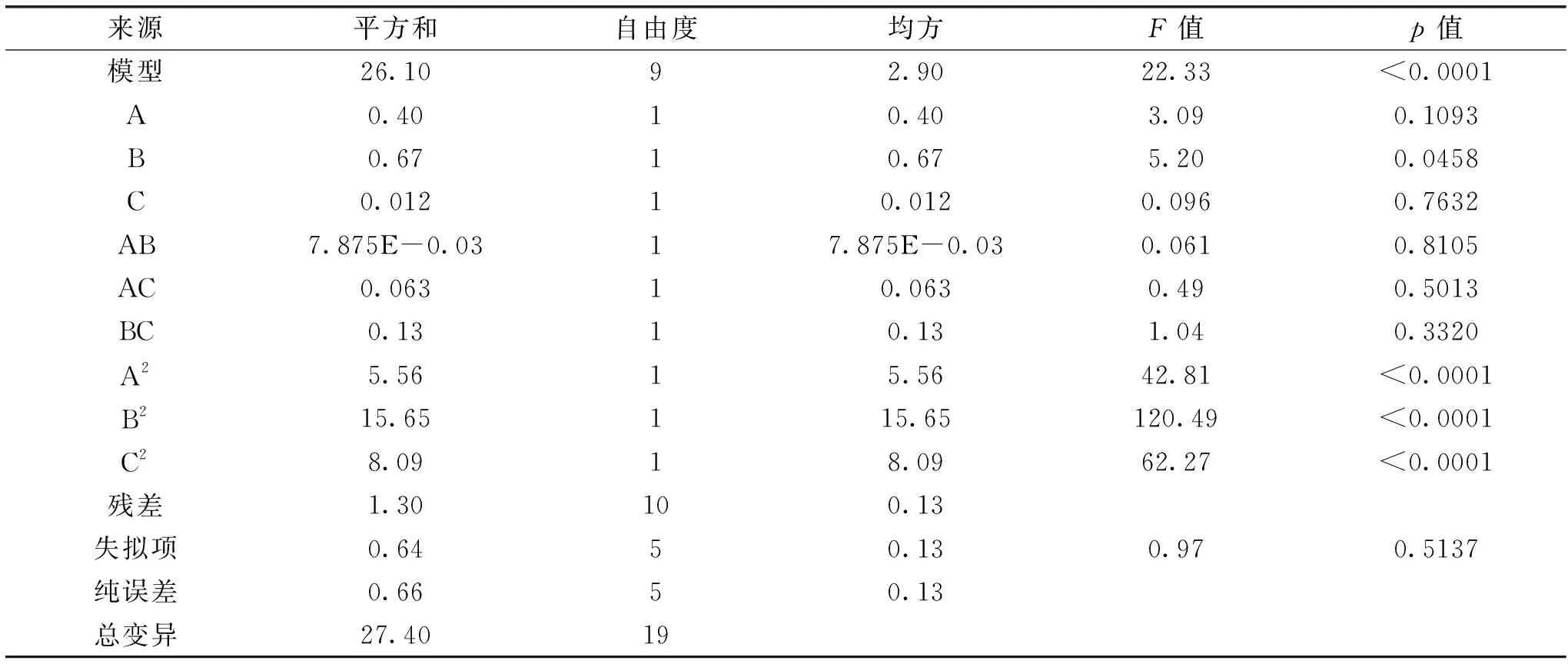
表3 拟合二项式方差分析结果
2.2.3 效应面分析 根据二项式方程,以效应值为纵坐标,固定3个自变量之一为中值,其他两个自变量为横坐标,应用Design-Expert 8.0软件绘制三维效应面图,结果见图4~图6。
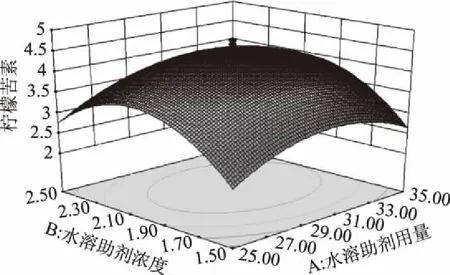
图4 水溶助剂用量与浓度对柠檬苦素得率影响的效应面图
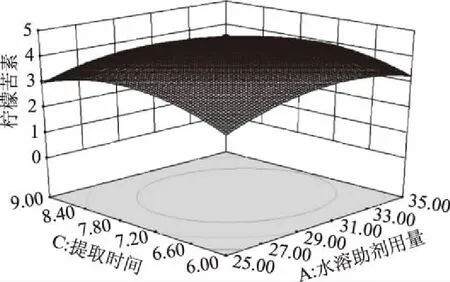
图5 水溶助剂用量与提取时间对柠檬苦素得率影响的效应面图
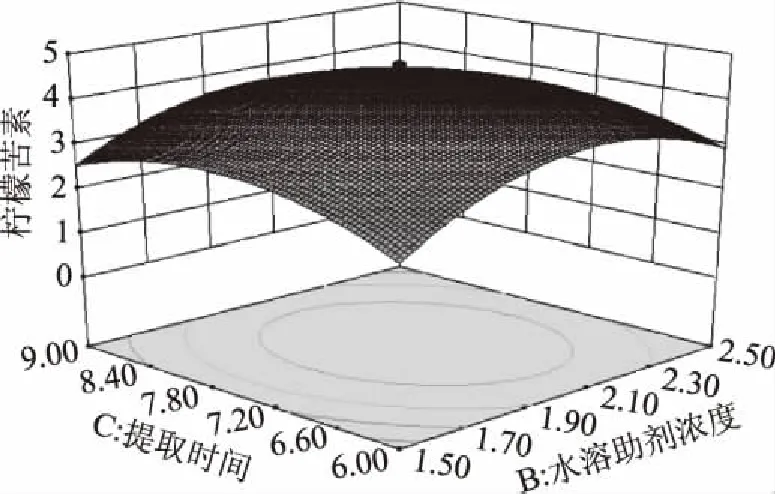
图6 水溶助剂浓度与提取时间对柠檬苦素得率影响的效应面图
由图4~图6可以直观的看出各因素交互作用对枳雀内果皮柠檬苦素提取量的影响,若曲线越陡峭,表明响应值对于操作条件的改变越敏感,此因素的交互作用对提取柠檬苦素的影响越大;反之曲面坡度越平缓,操作条件的改变对响应值的影响越小。AB、BC、AC的交互作用对枳雀内果皮柠檬苦素提取量不具有显著性影响。
通过软件分析,得出回归模型的最大值点,即枳雀内果皮柠檬苦素的最佳提取工艺条件为:异丙苯磺酸钠溶液浓度2.26 mol/L,用量27.72 mL/g,浸提7.2 h,枳雀内果皮柠檬苦素预测得率为4.37 mg/g。
2.2.4 最佳工艺条件的验证 但考虑到实际操作及工业生产的局限性,对最佳工艺条件做如下修正:在2.3 mol/L的异丙苯磺酸钠溶液,用量27.7 mL/g,浸提7.0 h。依此工艺条件进行五组重复验证实验。结果表明,枳雀内果皮中柠檬苦素平均提取量为4.32 mg/g,与拟合方程预测值4.37 mg/g偏差较小。说明用星点设计-效应面法优化得到的模型参数准确可靠,所选工艺条件重复性好,工艺优化条件可行。
依照孙崇德[22]提取方法提取了枳雀内果皮柠檬苦素,五次平行,在最佳工艺条件下,柠檬苦素平均提取量为2.54 mg/g。与之相比,本研究所得柠檬苦素提取量为4.32 mg/g,提取量大,无有机溶剂残留,水溶助剂没有发生化学反应可回收利用[21],此法更加适用于枳雀内果皮柠檬苦素的提取。
3 结论
本研究采用水溶助剂提取法从枳雀内果皮中提取柠檬苦素,应用星点设计—效应面法优化了枳雀内果皮中柠檬苦素的提取工艺。通过回归分析和验证,枳雀内果皮柠檬苦素的最佳提取条件为:水溶助剂异丙苯磺酸钠浓度2.3 mol/L,用量27.7 mL/g,提取时间7.0 h。在此条件下,枳雀内果皮柠檬苦素的实际提取量为4.32 mg/g与理论预测值4.37 mg/g较为接近,表明采用星点设计—效应面法优化枳雀内果皮柠檬苦素提取工艺的方法准确可行。整个工艺流程简单,操作方便,研究结果将为枳雀资源的进一步开发利用提供参考。
[1]李航. 宜昌橙及两个地方柑橘种的资源调查与评价[D]. 武汉:华中农业大学,2015.
[2]谭志友. 《中国果树志·柑橘卷》正式出版发行[J]. 中国南方果树,2010,39(3):11.
[3]朱春华,李菊湘,周先艳,等. 柑橘果实中柠檬苦素及类似物功能活性研究进展[J]. 保鲜与加工,2015,15(6):78-82.
[4]王菁,郑俊霞,蒲彪. 响应面法优化柑橘皮柠檬苦素提取工艺[J]. 食品研究与开发,2011,32(2):34-38.
[5]孟鹏. 金柑柠檬苦素类化合物的提取纯化、结构鉴定及生物活性研究[D]. 福州:福建农林大学,2013.
[6]蒋俊平,袁芳,吴宾,等. 柠檬苦素类似物的研究进展综述[J]. 中国酿造,2012,31(7):10-14.
[7]李彪,施蕊,熊智,等. 柚皮柠檬苦素的提取及其杀虫活性研究[J]. 中国农学通报,2012,28(1):284-288.
[8]刘亮,戚向阳,董绪燕. 枳实提取物清除·OH能力及抑菌活性初探[J]. 食品科学,2009,30(3):123-126.
[9]温靖,施英,徐玉娟,等. 柑桔果实中柠檬苦素抗炎镇痛作用的研究[J]. 食品科学,2007,(11):515-518.
[10]罗水忠,潘利华,何建军,等. 柑橘籽中柠檬苦素的提取与抑菌性研究[J]. 农产品加工·学刊,2006(10):105-107.
[11]Poulose SM,Harris ED. Citrus limonoids induce apoptosis in human neuroblastoma cells and have radical scavenging activity[J]. Nutrition,2005,135:870-877.
[12]张声源,邹浩元,杨宇辉,等. 响应面法优化金柚核中类柠檬苦素的提取工艺[J]. 食品研究与开发,2017,38(9):65-69.
[13]吴笑臣,王科军,钟金莲,等. 响应面法优化脐橙渣中类柠檬苦素的提取工艺[J]. 食品科学,2012,33(16):35-39.
[14]唐韵熙,邓放明. 椪柑核中柠檬苦素类似物提取条件优化[J]. 食品与机械,2013,29(6):162-165.
[15]汪建红,廖立敏,王碧,等. 超声波辅助双水相提取柠檬皮中的柠檬苦素[J]. 天然产物研究与开发,2015,27(6):1081-1085.
[16]罗星. 表面活性剂-超声法提取黄姜中薯蓣皂苷元的研究[D].衡阳:南华大学,2011.
[17]刘君. 柑桔种子中类柠檬苦素提取纯化工艺研究[D].重庆:西南大学,2008.
[18]曾宪彪,韦宝伟,韦桂宁. 应用水溶助长剂从酸藤果中提取摁贝素[J]. 实用药物与临床,2014,17(11):1439-1441.
[19]刘君.几种典型双子表面活性剂水溶液物化行为的NMR研究[D].武汉:中国科学院武汉物理与数学研究所,2014.
[20]曾育聪,朱新贵,陈洪璋,等. 陈皮柑橘籽中柠檬苦素类物质提取工艺的比较研究[J]. 食品工业科技,2012,33(21):265-268,272.
[21]陈立江,王永杰,刘宇,等. 星点设计-效应面法优选南瓜多糖提取工艺[J]. 食品科学,2013,34(8):107-112.
[22]孙崇德,陈昆松,陈青俊,等.柑桔果实中天然柠檬苦素和诺米林的提取、鉴别与检测[J]. 中国食品学报,2004(1):9-14.

