海参皂苷Echinoside A的酶解及其产物结构鉴定与溶血毒性
陈静兰,宋珊珊,孙树红,李学敏,刘炎俊,李兆杰,*,王玉明,薛长湖
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.青岛市中心医院,山东青岛 266042)
皂苷广泛存在于动植物中,是天然防御活性物质。其中,海参皂苷的分子结构已有700多种被阐明[1-4]。海参皂苷主要是为羊毛甾烷型三萜皂苷,绝大部分属于海参烷[4-5],其寡糖链一般含有2~6个单糖基,一般为喹诺糖、木糖、葡萄糖、鼠李糖、3-O-甲氧基葡萄糖及3-O-甲基木糖等单糖。其中海参皂苷Echinoside A(结构如图1),糖链序列Xyl-(-Sul)-β-(1-2)-Qui-β-(1-4)-Glu-β-(1-3)-MeGlu,[M-H]-m/z=1183.5[5-10,14]。海参皂苷具有抗真菌、抗病毒、抗肿瘤,细胞毒性等生理活性[11-13],但是由于其溶血毒性过强,极大地限制了其在食品及医药中的应用。因此研究降低海参皂苷溶血毒性具有重要现实意义。

图1 Echinoside A(EA)化学结构
目前降低皂苷溶血毒性的方法主要有化学降解法、酶降解法及微生物降解法。利用化学制备高生理活性的次级苷,仍然是目前主要方法。国内已有人利用醋酸和浓硫酸等酸法水解人参皂苷,制备出多种高活性次级人参皂苷,同时也有利用三氟乙酸和硫酸对海参皂苷Echinoside A进行水解制备一列的次级海参皂苷及苷元,但是酸法专一性差,反应条件剧烈,不易控制,极易破坏皂苷苷元结构,产物混杂,导致目标产物分离困难[15-16]。皂苷分子结构中的糖苷键在碱水溶液中降解较难进行,因此通常需要提高反应温度等加以实验[17]。而酶解法具有反应条件温和、专一性高、产率高、产物单一等特点。人参皂苷如Rb1、Rh2、Rg3等与河参皂苷结构类似,都属于三萜皂苷。国内外已有多人利用微生物菌体或利用微生物制备人参皂苷酶来将人参皂苷酶解成稀有人参皂苷C-K、C-Mx等[18-20],但是微生物降解法中微生物筛选及培养非常困难,成本较高,产物较复杂,不利于单体分离制备。目前,已有利用商品糖苷酶制备高活性的人参皂苷[21],但利用商品糖苷酶进行酶解未见报道。并且利用商品酶进行制备低溶血毒性的次级海参皂苷,比较经济实惠,同时有利于工业化利用。
本文选用5种商品糖苷酶对海参皂苷Echinoside A进行酶解,筛选出有酶解效果的商品糖苷酶,并分析产物结构,确定酶解产物,从而制备出次级海参皂苷,其溶血毒性明显降低,有利于海参皂苷作为药剂型商品开发。
1 材料和方法
1.1 材料与仪器
菲律宾刺参(Pearsonothuria graeffei) 青岛南山市场;乙腈(色谱纯)、碳酸氢铵(色谱纯) 美国Sigma Aldrich公司;二甲基亚砜(DMSO) 国药集团化学试剂有限公司;健康小白鼠(15~20 g,雌鼠,2只) 山东鲁抗制药有限公司;5种商品糖苷酶 见表5。
Aglient 1100型高效液相色谱仪、G6410型三重四级杆质谱仪 美国Aglient公司。

表1 5种商品糖苷酶
1.2 实验方法
1.2.1 EA的制备 称取菲律宾刺参1 kg在80 ℃烘箱烘干,然后粉碎成粉末,过200目筛;用60%乙醇在常温条件下浸泡3 d,取上清液,浸泡三次,将上清液减压浓缩,60 ℃水浴蒸干;经水饱和正丁醇萃取,大孔树脂柱层析除杂富集,正相硅胶析纯化得到的总皂苷,最后反相硅胶柱层析分离得到海参皂苷EA[22]。EA的纯度(%)=EA色谱图峰面积/总峰面积×100
1.2.2 商品糖苷酶筛选及酶解产物分离纯化 商品糖苷酶在pH5.0、40 ℃及100 U酶活力条件[21]下,酶解海参皂苷EA,每反应12 h取样一次,取5次样。反应60 h,利用TLC、HPLC以及质谱检测酶解产物。筛选出对海参皂苷EA有酶解效果的商品糖苷酶,并在此条件下酶解制备次级海参皂苷,利用制备液相分离纯化得次级海参皂苷单体。
1.2.3 TLC检测条件 展开剂:氯仿/甲醇/水(70∶30∶3,V/V/V),显色剂:10%硫酸乙醇。
1.2.4 HPLC-MS、ESI-MS/MS检测条件及制备液相条件 HPLC:流动相A相为乙腈,B相为0.1% NH4HCO3溶液,A相梯度随着时间变化而变化:0~5 min,30%~30%;5~30 min,30%~60%;30~35 min,60%~30%;Aglient Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5 μm);柱温30 ℃;流速:1 mL/min;检测波长:205 nm。
质谱条件:电喷雾离子源,负离子模式;毛细管电压3.0 kV;离子源温度300 ℃;干燥气温度350 ℃;雾化气(N2)流速10 L/min;压力276 kPa;质量扫描范围:m/z 100~2000。
ESI-MS/MS:质量扫描范围:m/z 100~1000;碰撞诱导解离(CID)能量:80 eV;碰撞气为高纯氮气。
制备液相:流动相:60%乙腈;流速:2 mL/min;色谱柱:AA12S05-2510WT ODS C18;柱温:30 ℃;检测波长:205 nm。
1.2.5 红细胞混悬液的制备 小白鼠麻醉后取腹腔主动脉血,取血红细胞,4 ℃保存;用时配制成2%的红细胞(将两只小鼠红细胞混合)悬浊液。
1.2.6 受试样品的配制 分别称取4 mg海参皂苷EA及其次级皂苷,并分别溶解于1 mL DMSO配制成储备液。用时利用生理盐水配制成相应浓度的溶液:0、1、1.5、2、3、5、10、20、40 μg/mL。
1.2.7 受试样品溶血当量的测定 精确吸取各样品0.5 mL,取0.5 mL蒸馏水作为阳性对照管,取0.5 mL生理盐水作为阴性对照管,每管设3个平行管。在上述各管中加入0.5 mL的2%红细胞悬浊液,混匀,37 ℃水浴保温2 h,取出立即冰浴终止反应,离心(3000 r/min,5 min),取上清液,570 nm波长处测其吸光度,并计算溶血率。溶血率计算公式:溶血率(%)=(A样- A阴)/(A阳- A阴)×100。以样品的溶血率对样品浓度作图得到各样品溶血曲线。
1.3 数据处理
采用SPSS Statistics 18.0软件进行相应数据处理和分析。
2 结果与分析
2.1 EA的制备
按1.2.1的制备方法制得海参皂苷EA,并利用HPLC检测,得到出峰时间为15.7 min,根据DAD色谱图峰面积计算,EA纯度为93.2%(如图2),可以用于后续实验。
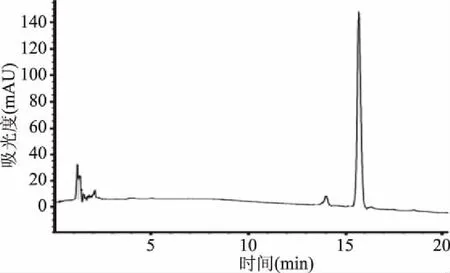
图2 EA的HPLC色谱图
2.2 商品糖苷酶筛选结果及产物制备
取60 h后的酶解液进行TLC检测,结果如图3。由图可知,1、2、3号酶对海参皂苷EA有明显的酶解效果,4、5号酶对样品进行酶解后,TLC图中未发现酶解产物。2、3号酶的TLC图中分别出现一条生成物检测条带,且Rf值皆为0.24,推测为同一种产物;而1号酶的TLC图中出现两条生成物检测条带,其中一种产物检测条带和2、3号酶的酶解产物的Rf值相同,推测与2、3号酶的酶解产物相同,另一种产物的Rf值为0.53较大,说明其极性相对于前一种产物更小,推测可能是其被水解掉的糖基较多所致。
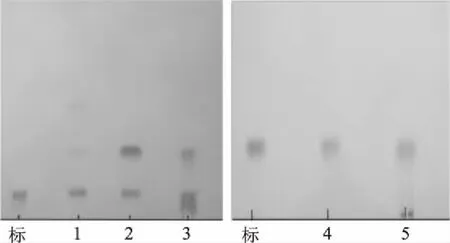
图3 酶解产物的TLC分析图
利用制备液相分离纯化酶解产物化合物1、化合物2、化合物3和化合物4,白色晶体状,不溶于水。
2.3 酶解产物结构鉴定
利用灵敏的HPLC-MS检测技术,对1、2、3号酶的酶解产物进行液质检测,得到其总离子流图(Total Ion Chromatogram,TIC),如图4(峰1为底物EA)。由图可知1号酶水解EA生成两种产物化合物1(峰2)和化合物2(峰3),其m/z分别为845.3[M-H]-和699.3[M-H]-,而2、3号酶分别得化合物3(峰4)和化合物4(峰5),其荷比均为m/z 845.3[M-H]-。由于化合物1,化合物3,化合物4具有相同的保留时间与质荷比,推测可能为相同物质。
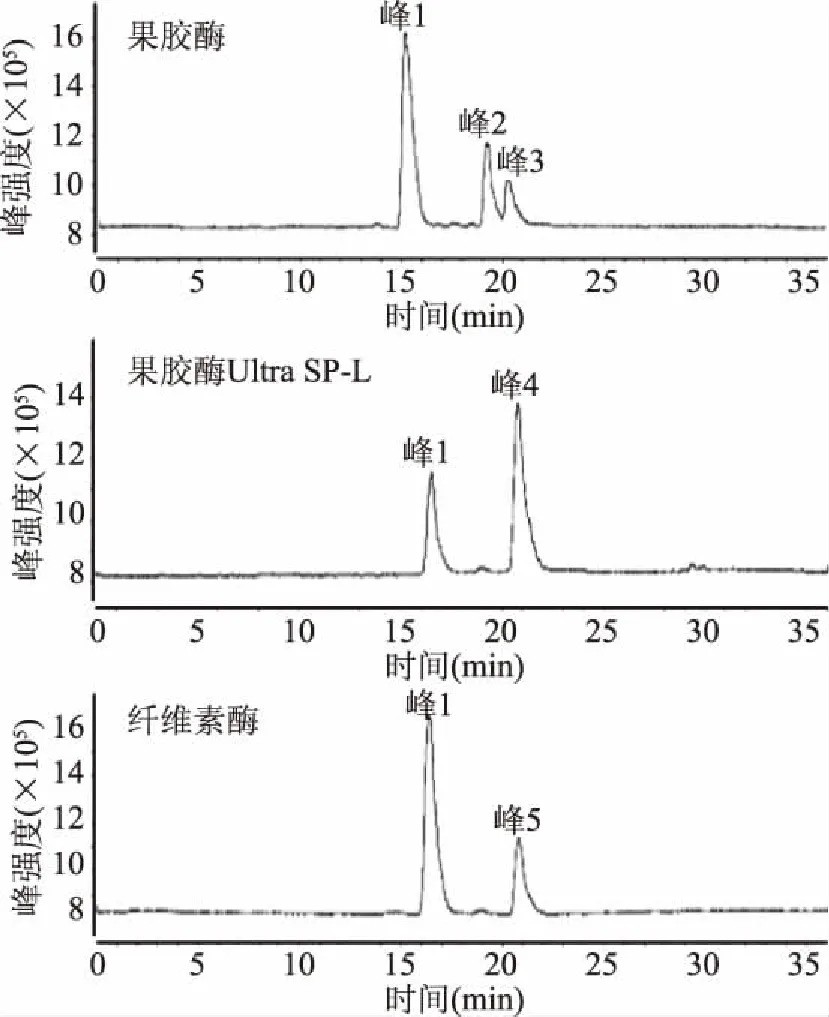
图4 TIC图和MS图
根据分子质量计算,推测1、2、3号酶对海参皂苷EA糖链中喹诺糖与葡萄糖之间的β-(1-4)糖苷键进行了水解(如图5),使皂苷EA脱去两个单糖基MeGlc(176)和Glc(162),因此产物化合物1、化合物3和化合物4应是相同物质;1号酶同时对皂苷EA糖链中木糖与喹诺糖之间的β-(1-2)糖苷键进行了水解,使皂苷EA脱去3个单糖基Qui(146)、MeGlc(176)和Glc(162),生成产物化合物2。

图5 商品糖苷酶水解EA的分子裂解模式图
为了进一步证明酶解产物结构,进行ESI-MS/MS检测。在负离子模式下,对酶解产物化合物1(m/z 845[M-H]-)和化合物2(m/z 699[M-H]-)母离子进行裂解后,生成形成m/z 827、m/z 615和m/z 681、m/z 469的碎片离子(如图8)。由于海参皂苷EA含有硫酸酯基的存在,其糖链没有发生断裂,而是先失去1个水分H2O(18 Da)形成m/z 1165[M-H]-的碎片离子,之后苷元上发生一系列的化学键断裂,形成了含有苯环结构的碎片离子,其m/z 953[M-H]-[23](如图6,图7)。根据计算得,两种酶解产物的母离子m/z 845[M-H]-和m/z 699[M-H]-先失去一个水分子H2O(18 Da)后形成m/z 827[M-H]-和m/z 681[M-H]-的碎片离子,然后苷元上发生一系列的化学键断裂,形成了含有苯环结构的碎片离子,m/z 615和m/z 469,其碎裂方式与海参皂苷EA碎裂方式相同,说明化合物1,2的苷元部分没有发生改变,仅有糖链发生断裂。由二级质谱检测化合物3和化合物4的断裂方式与化合物1相同(如图9)。由此可确定化合物1、化合物3和化合物4是同一种物质,是二糖基次级海参皂苷,化合物2是一糖基次级海参皂苷。

图6 Echinoside A在负离子模式下的二级质谱图
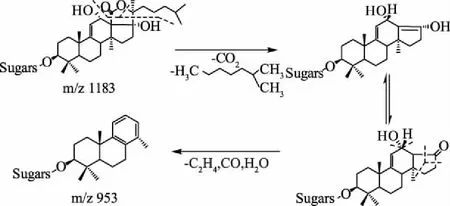
图7 Echinoside A负离子模式下的裂解模式图

图8 酶解产物在负离子模式下的ESI-MS/MS图

图9 化合物3、4在负离子模式下的ESI-MS/MS图
目前,利用化学方法来制备海参次级皂苷,但其苷元和糖链上的官能团都会遭到不同程度破坏,如宋伟等[16]利用稀硫酸水解海参皂苷EA得到10种产物,所有产物都失去了硫酸酯基,其中生成苷元、单糖苷、二糖苷、三糖苷和四糖苷五类次级海参皂苷,然而每一类次级海参皂苷依据苷元结构又分两种海参次级苷—三醇型和二醇型;三氟乙酸水解产物单一,仅生成一个二醇苷元,但苷元上发生了脱水和双键转移。由于酶具有专一性,不同性质的酶作用于不同构型、不同组成的糖苷键,从而达到定向水解的目的。并且商品糖苷酶介导的生物转化法条件相对温和、选择性高、转化率高、副产物少、污染少[21]。相较于化学法水解,酶反应条件温和,专一性强,较好的保护了苷元和硫酸酯基的结构完整,产物单一,宜于产物纯化分离。另外,利用商品酶进行制备低溶血毒性的次级海参皂苷,比较经济实惠,且有利于工业化制备。
2.5 溶血实验结果
2.5.1 溶剂的溶血作用 DMSO是对血红细胞相对温和的有机试剂,由表2可以看出当DMSO高达5%和10%浓度时,其溶血率却仅有0.9%、1.87%,肉眼可以直接观察到离心后的两者上清液均无红色现象,这说明DMSO溶血毒性浓度在低于5%时,溶剂DMSO对溶血影响非常小。
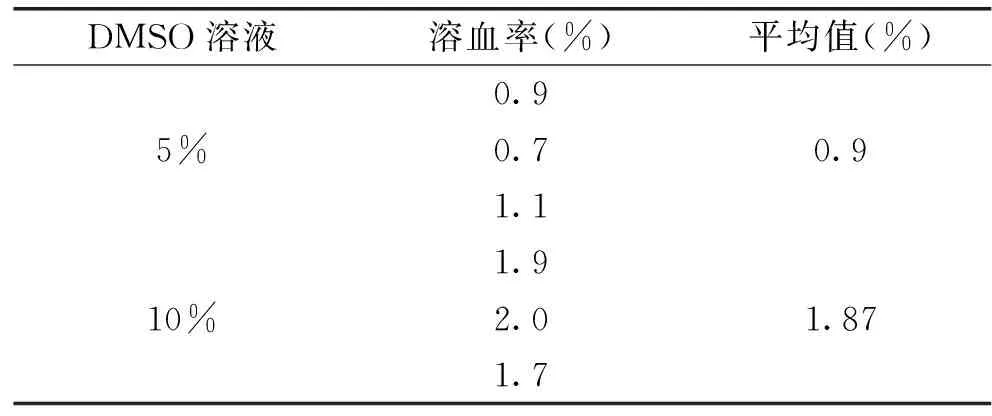
表2 DMSO溶血率
2.5.2 海参皂苷EA及酶解产物的溶血作用 由图10可知,海参皂苷EA及酶解产物均具有溶血作用。在0~5 μg/mL浓度范围内,EA的溶血率增长极快,且在小于5 μg/mL时其溶血率已达到60%;当溶度在5~20μg/mL范围内,其溶血率缓慢增加到100%;在浓度20~40μg/mL范围内,其溶血率基本保持不变。而化合物1在0~5 μg/mL浓度范围内溶血率增速明显放缓,而且在5~40 μg/mL浓度范围内溶血率保持在60%左右,相对于EA的溶血率有明显下降。化合物2的溶血率在0~20 μg/mL浓度范围内小于10%,当浓度达40 μg/mL(仅含DMSO1%,可以忽略其对溶血的影响)时溶血率也小于30%。在相同浓度时,其溶血率:化合物2<化合物1<海参皂苷EA。由此说明海参皂苷的溶血率与皂苷糖链和皂苷浓度有密切关系,其中皂苷糖链愈短溶血率愈低;在较低浓度范围内,海参皂苷EA和化合物1的溶血率增长较快,而化合物2在浓度较大时,溶血率才有明显增长。

图10 海参皂苷EA及酶解产物的溶血率曲线图
海参皂苷溶血毒性与其皂苷结构有密切关系,尤其是对其糖链的修饰,但是目前主要利用化学水解法降低皂苷的溶血毒性,而化学法都对苷元和糖链上的官能团有严重破坏作用,并未详细阐明硫酸酯基以及保持完整苷元结构的次级海参皂苷与其溶血毒性的关系。本文有效地保护了硫酸酯基以及苷元上的其他官能团,进一步证明了海参皂苷的溶血率与糖链有密切关系,糖链愈短其溶血率愈低,为研究次级海参皂苷化合物的抗肿瘤、抗衰老等其他生理活性,以及硫酸基团对其生理活性的影响研究提供基础。
3 结论
本文从五种商品糖苷酶筛选出三种对海参皂苷EA有专一性酶解作用的商品糖苷酶有果胶酶、果胶酶Ultra SP-L和纤维素酶。其中果胶酶Ultra SP-L和纤维素酶只断裂寡糖链喹诺糖和葡萄糖之间的β-(1-4)糖苷键得到二糖基次级海参皂苷化合物1,即EA→化合物1。果胶酶主要断裂糖链喹诺糖与葡萄糖之间的β-(1-4)糖苷键,同时将木糖与喹诺糖之间的β-(1-2)糖苷键断裂得到一糖基次级海参皂苷化合物2,即EA→化合物1,EA→化合物2。海参皂苷的溶血率与糖链有密切关系,糖链愈短其溶血率愈低。
[1]Isao K,Tatsuya I,Masoko F,et al. Structure of Echinoside A and B,two antifungal Oligoglycosides form the sea cucumberActinopygaechinites(Jaeger)[J]. Chemical & Pharmaceutical Bulletin,1980,28(5):1651-1653.
[2]Avilov S A,Kalinin V I,Makarieve T N,et al. Structure of cucumarioside G2,a novel nonholostane glycoside from the sea cucumberEupentactafraudatrix[J]. Journal of Natural Products,1994,57(8):1166-1171.
[3]Kalinin V I,Silchenko A S,Avilov S A,et al.Sea cucumbers triterpenoid glycosides,the recent progress in structural elucidation and chemotaxonomy[J]. Phytochem,2005,11(4):221-236.
[4]Bahromi Y,Zhan W,Franco C,et al. Discovery of novel saponins from the viscera of the sea cucumber Holothuria lesson[J]. Mar Drugs 2014,12(10):2633-2667.
[5]Yadollah B,Christopher M M. Structure elucidation of new acetylated saponins,lessoniosides A,B,C,D,and E,and non-scetylated saponins,lessoniosides F and G,from the viscera of the sea cucumber holothuria lesson[J]. Mar Drugs,2015,13(1):597-617.
[6]Tomofumi M,Kenichi T,Ryuichi H,et al. Six newly identified biologically active triterpenoid glycoside sulfates from the sea cucumber cucurnaria echinata constituents of holothuroidea,II[J].Chemical,1990,11(2):453-460.
[7]Alexandr S,Antonov,Sergey A,et al. Triterpene glycosides from antarctic sea cucumbers. 1.structure of liouvillosides A1,A2,A3,B1,and B2from the sea cucumber staurocucumis liou W illei:New procedure for separation of highly polar glycoside fractions and taxonomic revision[J]. J Nat Prod,2008,10(71):1677-1685.
[8]Kalinin V I,Silchenko A S,Avilov S A. Taxonomic significance and ecological role of triterpene glycosides from holothurians[J]. Biology Bulletin,2016,43(6):532-540.
[9]Song S S,Cong P X,Wang Y M,et al. Absorption and pharmacokinetic study of two sulphated triterpenoid saponins in rat after oral and intravenous administration of saponin extracts of Pearsonothuria graeffei by HPLC-MS[J]. Journal of Functional Foods. 2016,25(1):62-69.
[10]Yu S R,Ye X W,Huang H C,et al. Bioactive sulfated saponins from sea cucumber holothuria moebii[J]. Planta Med,2015,81(1):152-159.
[11]Dmitry L A,Ekaterina S M,Menchinskaya A P,et al. Anticancer activity of sea cucumber triterpene glycosides[J]. Marine Drugs. 2015,13(1):602-1223.
[12]Javad B,Elaheh A,Najme N,et al. The cytotoxicity of dacarbazine potentiated by sea cucumber saponin in resistant B16F10 melanoma cells through apoptosis induction[J]. Avicenna Journal of Medical Biotechnology,2016,6,8(3):112-119.
[13]Yu S,Ye X W,Chen L,et al. Cytotoxic and anti-colorectal tumor effects of sulfated saponins from sea cucumberHolothuriamoebii[J]. Phytomedicine,2015,22(1):1112-1119.
[14]董平. 革皮氏海参(Pearsonothriagraeffei)皂苷化合物的分离鉴定、结构修饰及活性研究[D]. 青岛:中国海洋大学,2008.
[15]杨崇仁,倪凤仪,周俊,等. 三七中达马烷型皂贰的热不稳定性及酸水解产物[J]. 云南植物研究所,1986,8(1):87-92.
[16]宋伟,董平,薛长湖,等. 酸水解制备海参皂苷 Echinoside A 的次级苷及苷元的方法研究[J]. 中国科技论文在线,2013,12(26):45-67.
[17]陈业高,吕瑜平,桂世鸿,等. 三七叶甙制备原人参二醇及其差向异构体[J]. 精细化工,2003,7,20(7):425-426.
[18]Menchinskaya U,Min J K,Young H K,et al. Enzymatic formation of compound-K from ginsenoside Rb1 by enzyme preparation from cultured mycelia ofArmillariamellea[J]. J Ginseng Res,2016,40(1):105-112.
[19]Liu C Y,Zuo K Z,Yu H S,et al. Preparation of minor ginsenosides C-Mx and C-K from notoginseng leaf ginsenosides by a special ginsenosidase type-I[J]. Process Biochemistry,2015,50(1):2158-2167.
[20]Liu C Y,Zhou R X,Sun C K,et al. Preparation of minor ginsenosides C-Mc,C-Y,F2,and C-K from American ginseng PPD-ginsenoside using special ginsenosidase type-I fromAspergillusnigerg.848[J].J Ginseng Res 2015,39(1):221-229.
[21]高娟. 糖苷酶转化人参皂苷的研究[D]. 长春:东北师范大学,2012.
[22]李海新. 菲律宾刺参主要皂苷单体的制备及减肥活性研究[D]. 青岛:中国海洋大学,2012.
[23]于林芳. 八种海参中主要海参皂苷的结构特性研究[D]. 青岛:中国海洋大学,2011.

