Shh基因在NIPBL+/-胎鼠肢芽内的表达*
王 莉,潘金勇,嵇继宇,张惠荣(石河子大学医学院第一附属医院儿科,新疆石河子832000)
Cornelia de Lange综合征(CdLS)是一种罕见的先天性疾病,患病率为1/100 000~1/10 000[1]。临床表现主要为严重的生长发育迟缓、智力障碍、畸形等[2]。CdLS的患者约60%是NIPBL基因发生了病理性变化[3]。有研究表明,NIPBL基因水平的高低与CdLS的严重程度密切相关[4]。Shh基因是由ZRS增强子调控参与肢芽的发育[5],Shh基因在由ZRS增强子调控的胚胎极化活性区(ZPA)进行肢芽的表达[6]。然而,在小鼠胚胎发育阶段的肢芽中,NIPBL基因对位于ZPA区域的Shh基因具有调控作用,会影响Shh基因的表达。但2个基因之间
的具体交互作用及规律鲜见文献报道。本研究采用NIPBL-Loxp小鼠与Cre小鼠杂交,建造NIPBL+/-小鼠模型,探讨NIPBL对Shh基因表达的影响,为CdLS的诊断和干预提供新的策略。
1 材料与方法
1.1 材料
1.1.1 动物 NIPBL-Loxp小鼠与Cre小鼠的背景品系小鼠是C57BL/6J,SPF级,购于浙江大学,全部小鼠饲养于石河子大学药学院实验动物中心。实验过程遵照石河子大学《动物实验伦理委员会管理条例》。挑选NIPBL+/-小鼠雄性体重35 g左右,雌性体重30 g左右,晚上20:00将雌雄小鼠按2∶1合笼,次日早晨8:00检查雌鼠的阴栓,阴栓阳性者将次日12:00作为其胚胎E0.5天。
1.1.2 仪器与试剂 逆转录试剂盒Prime Script RT reagent Kit购于Thermo公司;总RNA提取剂Trizol Reagent购于Life公司;逆转录试剂盒RevertAid First Strand cDNA Synthesis Kit购于Thermo公司;荧光定量试剂盒SYBR Green PCR Kit购于Thermo公司;普通聚合酶链反应(PCR)仪器购于TaKaRa公司;荧光定量聚合酶链反应(qRT-PCR)仪器购于Life公司。
1.2 方法
1.2.1 动物模型的建立和实验分组 采用NIPBL-Loxp小鼠与Cre小鼠建造NIPBL+/-小鼠模型,NIPBL+/-小鼠与NIPBL+/-小鼠按照雌、雄2∶1合笼进行杂交,分别在孕鼠的E10、E11、E12天取出孕鼠放在超净台内,以颈部脱臼法处死孕鼠,在严格无菌操作条件下,分别在孕鼠的E10、E11、E12天用逆转录聚合酶链反应(RT-PCR)逆转录试剂盒鉴定得到6只NIPBL+/-胎鼠的肢芽作为实验组,另选取6只NIPBL+/+胎鼠的肢芽作为对照组,引物设计见表1;最后分离胎鼠双侧四肢,放入液氮15~20 min,再放入-80℃冰箱,以备后期实验。

表1 NIPBL-Loxp小鼠与Cre小鼠引物信息
1.2.2 采用qRT-PCR检测Shh基因的表达情况 Shh基因引物的设计见表2。

表2 Shh基因和β-actin的引物信息
1.2.3 实验组和对照组RNA的提取 按照RNA提取试剂盒说明书提取总RNA。
1.2.4 实验组和对照组cDNA的合成 按照逆转录试剂盒说明书对上述提取的总RNA进行逆转录。
1.2.5 qRT-PCR检测实验组和对照组Shh基因的表达情况 以上述cDNA为模板,按照荧光定量试剂盒说明书检测实验组和对照组Shh基因的表达量。
1.3 统计学处理 采用SPSS17.0统计软件进行数据处理。符合正态分布的计量资料以±s表示,对数据进行方差齐性检验,方差不齐计量资料的多组间比较采用非参数检验,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 NIPBL基因敲除小鼠模型的验证 NIPBL基因敲除打靶载体构建策略图,见图1。

图1 野生型及突变型等位基因示意图
2.2 NIPBL-Loxp和Cre小鼠的引物鉴定结果 NIPBLLoxp和Cre小鼠建造的NIPBL+/-小鼠模型亲代鼠,经RT-PCR技术鉴定出在孕鼠E10、E11、E12天的NIPBL+/-和NIPBL+/+胎鼠,经鉴定出来的引物凝胶电泳结果见图 2~4。

图2 NIPBL-Loxp-F/NIPBL-Loxp-R凝胶电泳结果
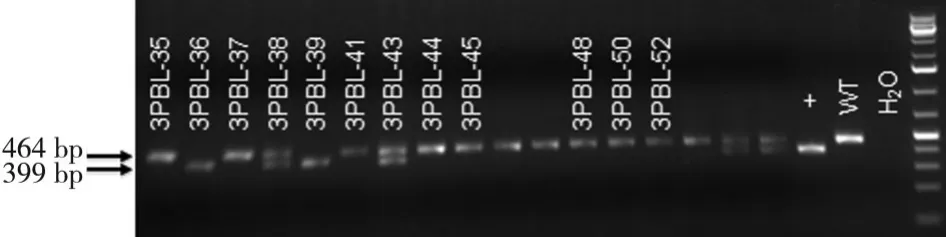
图3 Cre-WT-F/Cre-WT-R凝胶电泳结果
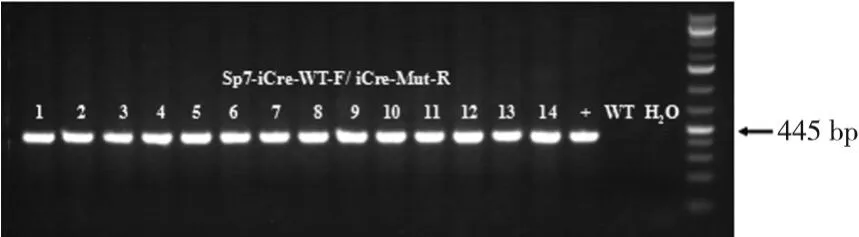
图4 Cre-WT-F/Cre-Mut-R凝胶电泳结果
2.3 qRT-PCR验证结果 实验组和对照组胎鼠肢芽内的Shh基因在E10、11、12天均有表达,实验组和对照组胎鼠肢芽内Shh基因的ΔCt值由大到小依次为E10、E12、E11 天,表明在不同的孕期(E10、E11、E12天)时,实验组和对照组胎鼠肢芽内Shh基因表达趋势均为先升后降,即表示实验组与对照组胎鼠肢芽的Shh基因表达量在E10天时有表达,E11天时达顶峰,E12天时表达量下降,但仍高于E10天表达量。实验组在E10、E11、E12天Shh基因的表达量比较,差异有统计学意义(P<0.01)。与对照组比较,在相同的孕期(E10、E11、E12天)内,实验组Shh基因的ΔCt值大于对照组,表明实验组胎鼠肢芽内Shh基因的表达水平低于对照组,差异有统计学意义(P<0.01),见表3。
表3 实验组与对照组Shh基因ΔCt值的比较(±s)
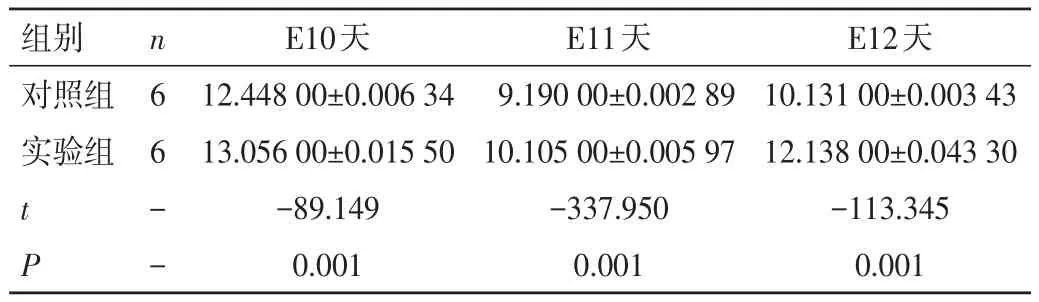
表3 实验组与对照组Shh基因ΔCt值的比较(±s)
注:-表示无此项
组别对照组实验组t P n6 6- -E10天12.448 00±0.006 34 13.056 00±0.015 50-89.149 0.001 E11天9.190 00±0.002 89 10.105 00±0.005 97-337.950 0.001 E12天10.131 00±0.003 43 12.138 00±0.043 30-113.345 0.001
3 讨 论
CdLS是一种多系统发育障碍性的常染色体显性遗传疾病[7]。生长发育迟缓、面部畸形和智力障碍等是CdLS的表型特征,其中生长发育迟缓是CdLS的重要表现[8]。有关研究报道,CdLS受多种基因及信号通路的调控,一旦这些基因及信号通路发生改变,都可能导致CdLS的发生。其中,NIPBL基因缺陷是导致CdLS最常见的原因,研究人员利用分子遗传工具创建了NIPBL基因敲除小鼠,试图了解CdLS的病因学[9]。有关研究报道,Hedgehog信号通路抑制剂限制了骨骼的发育成熟,其包括 Sonic hedgehog(Shh)、Desert hedgehog(Dhh)及Indian hedgehog(Ihh)3 个配体,其中最常见的是 Shh[10]。Shh基因编码一种信号蛋白,在小鼠胚胎肢芽的发育过程中起不可或缺的作用[11]。Shh基因编码的Shh蛋白是与ZPA极化功能有关的一种形态发生素,由ZPA中细胞产生,ZPA区域传递肢芽早期的发育信号,启动Shh基因的表达[12]。有研究表明,小鼠胚胎肢芽中Shh蛋白的变化存在于肢体发育前10 h,且Shh蛋白量的改变会影响肢体缺陷的程度[13]。相关研究显示,NIPBL在ZPA区域和肢芽的间充质细胞对Shh基因进行调控,一旦NIPBL基因缺陷,会引起Shh基因表达的信号通路受到抑制,造成Shh基因的表达缺失,引起ZPA区域染色体位点异常,从而形成了CdLS的特征性改变[14]。因此,本研究通过建立NIPBL基因敲除模型,进一步研究NIPBL和Shh2个基因之间的相互作用机制。
有研究报道,Shh基因通常在正常胎鼠肢芽的E9.5~E11.5天进行表达,且在孕鼠的E10天左右表达量逐渐增多,在E11天大量表达,在E12天左右表达量逐渐减少[15]。本实验观察到胎鼠在E9.5天时仍是个椭球形,很难分辨出胚胎的器官,Shh基因也几乎检测不出表达;E12.5天时,胎鼠的肢芽也几乎检测不到Shh基因的表达。因此,本实验选取胎鼠的E10、E11、E12天作为实验分组。本实验结果表明,在孕鼠的E10、E11、E12天,实验组和对照组的胎鼠肢芽内均有Shh基因的表达,但是实验组胎鼠肢芽内Shh基因的ΔCt值大于对照组,表明实验组胎鼠肢芽内Shh基因的表达水平低于对照组(ΔCt值越高,Shh基因的表达水平越低),说明NIPBL基因缺陷影响胎鼠肢芽内Shh基因表达的正常信号通路,抑制了Shh基因的表达。实验组和对照组胎鼠肢芽内Shh基因ΔCt值大小依次为E10、E12、E11天,表明在不同的孕期(E10、E11、E12天)内,实验组和对照组胎鼠肢芽内Shh基因的表达趋势是E10天时有表达,但表达量较少,随后表达量逐渐增多,在E11天时达到顶峰,随后表达量逐渐减少,E12天表达量较E11天减少,但比E10天表达量增多,差异有统计学意义(P<0.01)。
综上所述,NIPBL+/-基因敲除抑制胎鼠肢芽内Shh基因的表达,而Shh基因在体内正常的软骨发育中起重要调控作用,由此推断NIPBL+/-基因敲除胎鼠可能会抑制软骨的发育成熟,进一步导致CdLS。本研究有助于人们进一步了解NIPBL基因在CdLS发病中的机制和意义,并为CdLS疾病的诊断和干预提供新的策略,帮助研究人员深入了解CdLS疾病,以便探索更好的治疗方法。
[1]MASKOEN AM,LAKSONO B,HAJJAH R,et al.Cornelia de lange syndrome with thyroid agenesis of an indonesian patient[J].Cell Mol Biol,2017,63(8):93-94.
[2]INFANTE E,ALKORTA-ARANBURU G,EL-GHARBAWY A,et al.Rare form of autosomal dominant familial Cornelia de Lange syndrome due to a novel duplication in SMC3[J].Clin Case Rep,2017,5(8):1277-1283.
[3]PUISAC B,TERESA-RODRIGO M,BAQUERO-MONTOYA C,et al.mRNA quantification of NIPBL isoforms a and B in adult and fet al human tissues,and a potentially pathological variant affecting only isoform a in two patients with cornelia de lange syndrome[J].Int J Mol Sci,2017,18(3):481.
[4]KAUR M,MEHTA D,NOON SE,et al.NIPBL expression levels in CdLS probands as a predictor of mutation type and phenotypic severity[J].Am J Med Genet C Semin Med Genet,2016,172(2):163-170.
[5]LETTICE LA,DEVENNEY P,DE ANGELIS C,et al.The conserved sonic hedgehog limb enhancer consists of discrete functional elements that regulate precise spatial expression[J].Cell Rep,2017,20(6):1396-1408.
[6]PELUSO S,DOUGLAS A,HILL A,et al.Fibroblast growth factors(FGFs)prime the limb specific shh enhancer for chromatin changes that balance histone acetylation mediated by E26 transformation-specific(ETS)factors[J].Elife,2017,6(1):28590.
[7]NEWKIRK DA,CHEN YY,CHIEN R,et al.The effect of Nipped-B-like(Nipbl)haploinsufficiency on genome-wide cohesin binding and target gene expression:modeling Cornelia de Lange syndrome[J].Clin Epigenetics,2017,9(1):89.
[8]PARENTI I,TERESA-RODRIGO ME,POZOJEVIC JA,et al.Mutations in chromatin regulators functionally Link Cornelia de Lange syndrome and clinically overlapping phenotypes[J].Hum Genet,2017,136(3):307-320.
[9]KAWAUCHI S,SANTOS R,MUTO AA,et al.Using mouse and zebrafish models to understand the etiology of developmental defects in cornelia de lange syndrome[J].Am J Med Genet C Semin Med Genet,2016,172(2):138-145.
[10]ROBINSON GW,KASTE SC,CHEMAITILLY W,et al.Irreversible growth plate fusions in children with medulloblastoma treated with a targeted hedgehog pathway inhibitor[J].Oncotarget,2017,8(41):69295-69302.
[11]AMANO T,SAGAI T,SEKI R,et al.Two types of etiological mutation in the Limb-Specific enhancer of shh[J].G3,2017,7(9):2991-2998.
[12]MATSUBARA H,SAITO D,ABE G,et al.Upstream regulation for initiation of restricted Shh expression in the chick limb bud[J].Dev Dynam,2017,246(5):417-430.
[13]ZHANG R,LEE C,LAWSON LY,et al.SHH protein variance in the limb bud is constrained by feedback regulation and correlates with altered digit patterning[J].G3,2017,7(3):851-858.
[14]MUTO A,IKEDA S,LOPEZ-BURKS ME,et al.Nipbl and mediator cooperatively regulate gene expression to control limb development[J].PLoS Genet,2014,10(9):1004671.
[15]YOKOYAMA S,FURUKAWA S,KITADA S,et al.Analysis of transcription factors expressed at the anterior mouse limb bud[J].PLoS One,2017,12(5):0175673.

