ACS合并T2DM患者外周血淋巴细胞中PPAR-γ、MMP-9、eNOS的表达变化及其与冠脉病变程度的相关性
段淑香,徐庆国,周国,张洪强,孟海燕
(1山东省立第三医院,济南250031;2济南军区总医院)
急性冠脉综合征(ACS)患者病死率高、预后差,是心血管疾病的重中之重,2型糖尿病(T2DM)的患者中ACS的发病率是非糖尿病患者的2~3倍[1,2]。过氧化物酶体增殖物激活受体γ(PPAR-γ)是一类核转录因子,由配体或激活物激活,有研究证明PPAR-γ在冠状动脉粥样硬化斑块(AS)中高表达。PPAR-γ与T2DM密切相关,通过多种途径改善糖脂代谢[3]。PPAR-γ通过激活内皮型一氧化氮合酶(eNOS),产生NO,降低氧化应激,增强NO的生物利用度,抑制黏附级联和血管炎症,可有效防止ACS的发生、发展。基质金属蛋白酶9(MMP-9),是一种以锌离子为辅助因子,降解细胞外基质的蛋白酶,通过崩解纤维帽成分参与AS纤维帽破裂的过程,已经证实在AS破裂处高度表达[4]。本课题旨在观察ACS合并T2DM的患者与单纯ACS患者外周血淋巴细胞中PPAR-γ、MMP-9、eNOS蛋白和mRNA表达水平的不同,分析其与冠脉病变程度的相关性。
1 资料与方法
1.1 临床资料 选取2016年1~10月于山东省立第三医院确诊为ACS并经冠状动脉造影术明确冠状动脉粥样硬化病变的患者82例,男67例、女45例,年龄(62.59±8.4)岁,其中合并T2DM患者42例(ACSDM组),男26例、女16例,年龄(63.91±8.7)岁;不合并T2DM患者40例(ACS组),男25例、女15例,年龄(61.72±8.3)岁。入选标准:ACS和T2DM的诊断标准参见文献[5,6]。排除标准:心功能不全经评定为NYHA Ⅲ~Ⅳ级的患者;左室射血分数<40%;有严重的肝、肾、肺功能损害;心肌炎、心肌病、感染性心内膜炎等心脏疾病;妊娠;低血压、高血压危象、酮症酸中毒、高血糖高渗状态;恶性肿瘤;严重感染、免疫性疾病、近期服用TZDs、贝特类等药物;依从性差的患者。另选取同期健康体检者30例(对照组),男16例、女14例,年龄(62.15±8.1)岁。三组入试者性别、年龄差异无统计学意义(P均>0.05)。所有入试者均已签署知情同意书。
1.2 外周血淋巴细胞PPAR-γ、MMP-9、eNOS mRNA表达检测 采用RT-PCR法。所有入选者在胸痛发作24 h内(对照组于入院后)抽取静脉血3 mL,分离外周血淋巴细胞,提取外周血淋巴细胞总RNA,严格按照操作说明进行,RNA的逆转录反应;利用PPAR-γ、MMP-9、eNOS特异性引物序列扩增合成cDNA,在PCR仪上进行定量检测,结合扩增曲线及溶解曲线分析,将符合要求的样本基因定量PCR原始数据取3次重复的平均值,经β-actin校正,用Light Cycler自带分析软件进行数据处理,用2-ΔΔCt法分析数据。
1.3 外周血淋巴细胞PPAR-γ、MMP-9、eNOS蛋白表达检测 采用Western blotting法。首先使用裂解液提取淋巴细胞总蛋白,配制浓缩胶和分离胶,上样量30 μg,浓缩胶为80 V,分离胶120 V进行电泳,电泳结束后,取出凝胶,进行转膜, 200 mA恒流转膜约1~2 h,电压在80~95 V;5%脱脂奶粉封闭非特异性蛋白,37 ℃摇床中振动约2 h;分别加入抗β-actin(稀释度1∶1 000)、抗PPAR-γ(稀释度1∶1 000)、抗MMP-9(稀释度1∶1 000)、抗eNOS(稀释度1∶1 000)一抗4 ℃孵育过夜约18 h;TBST漂洗15 min×3次;加入辣根过氧化物酶标记羊抗兔或抗小鼠IgG二抗(1∶10 000用封闭液配制),37 ℃摇床中摇动约1 h;TBST漂洗后 ECL发光液进行发光,凝胶扫描成像系统进行扫描,显示条带,软件分析灰度值,进行比较。
1.4 冠状动脉造影术后冠脉病变程度评估 入院后第7天,行冠状动脉造影术,采集6个不同体位图像,定性分析病变特点。Gensini系统评分方法评估冠脉病变狭窄水平: 1%~25%狭窄记1分;26%~50%记2分;51%~75%记4分;76%~90%记8分;91%~99%记16分;100%(全闭)记32分;LM病变记5分;LAD或LCX近段记2.5分;LAD中段记2.5分;LAD远段、LCX中远段、RCA记1分;小分支病变记0.5分。每处病变狭窄程度分值乘以病变部位分值为一处病变的积分值,每位患者最后Gensini积分为所有病变积分总和。
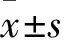
2 结果
2.1 三组外周血淋巴细胞PPAR-γ、MMP-9、eNOS蛋白表达比较 ACS组、ACSDM组外周血淋巴细胞PPAR-γ 、eNOS蛋白表达均低于对照组(P均<0.05),ACSDM组PPAR-γ、eNOS蛋白表达均低于ACS组(P均<0.05),ACS组、ACSDM组MMP-9蛋白表达均高于对照组(P均<0.05),ACSDM组MMP-9蛋白表达高于ACS组(P<0.05)。见表1。
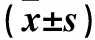
表1 三组PPAR-γ、eNOS、MMP-9蛋白表达比较
注:与对照组比较,aP<0.05;与ACS组比较,bP<0.05。
2.2 三组外周血淋巴细胞PPAR-γ、MMP-9、eNOS mRNA表达比较 ACS组、ACSDM组外周血淋巴细胞PPAR-γ 、eNOS mRNA表达均低于对照组(P均<0.05),ACSDM组PPAR-γ、eNOS mRNA表达均低于ACS组(P均<0.05),ACS组、ACSDM组MMP-9 mRNA表达均高于对照组(P均<0.05),ACSDM组MMP-9 mRNA表达高于ACS组(P<0.05)。见表2。
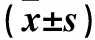
表2 三组外周血淋巴细胞PPAR-γ、eNOS、MMP-9 mRNA表达比较
注:与对照组比较,aP<0.05;与ACS组比较,bP<0.05。
2.3 ACS组及ACSDM组Gensini积分比较 ACSDM组Gensini积分高于ACS组(42.49±5.02 vs 27.93±7.11,P<0.05)。
2.4 PPAR-γ、eNOS、MMP-9蛋白表达水平与Gensini积分的相关性 Gensini积分与PPAR-γ、eNOS蛋白表达均呈负相关(r分别为-0.803、-0.873,P均<0.05),与MMP-9蛋白表达呈正相关(r=0.965,P<0.05);PPAR-γ蛋白表达与eNOS蛋白表达呈正相关(r=0.95,P<0.05),PPAR-γ蛋白表达及eNOS蛋白表达与MMP-9蛋白表达均呈负相关(r分别为-0.816、-0.865,P均<0.05)。
3 讨论
ACS包括急性心肌梗死、不稳定型心绞痛和心源性猝死,它们均有共同的病理生理机制,即AS破裂,继而出血和血栓形成,引起冠状动脉完全或不完全闭塞导致的一系列临床症候群[7]。糖尿病是心血管疾病主要的危险因素之一。糖尿病患者动脉硬化及其动脉并发症进行性增加,50%以上的糖尿病患者死亡的主要原因是动脉并发症[8]。内皮功能障碍是糖尿病主要的病理生理改变,是引发血管并发症的基础。有研究发现,在高血糖状况下,大约7 d左右心脏瓣膜即可出现动脉粥样硬化改变[9]。 国内学者分析了1 419名冠状动脉造影患者的血管狭窄程度,在比较了冠状动脉病变血管数量、完全闭塞血管比例和Gensini评分后,发现冠脉血管病变严重程度随着空腹血糖水平增加而增加[10]。
PPAR-γ是核转录因子超家族成员之一,除了在脂肪组织中表达丰富外,在血管平滑肌细胞、内皮细胞、巨噬细胞和心肌细胞中均有表达。PPARs作为转录调节激活物,是调节糖、脂质代谢的重要因子,参与机体的炎症反应、脂质代谢、细胞凋亡、基质的重构、平滑肌迁移、分化和AS等病理过程。研究者认为PPAR-γ是心血管疾病的预警指标,是负性调节因子,具有抗炎和抗AS的作用。PPAR-γ能通过多种途径抑制炎症介质的表达,延缓AS形成的进展。PPAR-γ有两种配体,分为天然配体和人工合成配体。天然配体包括花生四烯酸系列产物如15-脱氧前列腺素J2(15d-PGJ2),多不饱和脂肪酸,二十六碳六烯酸等,其中15d-PGJ2是目前使用最广泛的PPAR-γ配体。
研究显示,PPAR-γ激动剂具有促进eNOS 产生更多的内皮源性NO(EDNO),提高内皮祖细胞迁移活性的作用。有研究表明,EDNO不仅可以诱导内皮细胞的增殖、迁移,还参与干细胞或祖细胞的动员、招募作用,因此可介导血管生长因子的血管新生作用,但外源性 NO 可能不具有此作用。近来有学者提出,PPARs是通过内皮细胞的NO和磷脂肌醇信号途径来抑制内皮素的产生。利用脑微血管内皮细胞实验证明,PPARs可以激活磷脂肌醇信号途径来提高NO水平。本实验研究证实,ACS组和ACSDM组PPAR-γ、eNOS蛋白和mRNA表达均低于对照组,其中ACSDM组降低更甚,冠脉病变程度与PPAR-γ、eNOS表达呈负相关,PPAR-γ表达与eNOS表达呈正相关。说明PPAR-γ、eNOS 在保护内皮细胞功能中发挥重要作用,PPAR-γ可能通过上调eNOS的表达发挥内皮保护作用。
PPAR-γ可通过调节核因子-κB、激活蛋白-1、信号转导与转录激活子信号转导通路抑制炎症因子如MMP-9等表达,抑制炎症反应,从而预防和减缓AS的发生和发展。PPAR-γ可通过抑制MMP-9的表达,抑制血管平滑肌细胞的增殖和迁移,影响斑块稳定性。PPAR-γ配体可通过抑制MMP-9的表达,抑制单核细胞的游走现象。Nikolaus等研究发现配体激活的PPAR-γ能够通过抑制血小板源性生长因子诱导的血管平滑肌细胞MMP-9表达和降低明胶酶的分解活性,抑制平滑肌细胞迁移,延缓动脉粥样硬化进程。本实验结果显示,冠脉病变程度与与MMP-9表达呈正相关,PPAR-γ与MMP-9表达呈负相关,PPAR-γ在ACS合并T2DM患者中表达明显下降,而MMP-9在ACS合并T2DM患者中表达高于对照组和ACS组,提示糖尿病患者出现易损斑块并发生急性冠脉综合征与MMP-9水平升高有关,而MMP-9已经证实是斑块不稳定因素之一,则PPAR-γ可通过抑制MMP-9的表达,影响斑块稳定性,防止ACS等恶性心血管事件的发生,降低心血管疾病的病死率。
参考文献:
[1] Kiu Weber CI, Duchateau-Nguyen G, Solier C, et al. Cardiovascular risk markersassociated with arterial calcification in patients with chronickidneydisease Stages 3 and 4[J]. Clin Kidney, 2014,7(2):167-173.
[2] Basu A, Sukumar N, Ryder RE. Young Asian men with diabetes have the highest risk for acute coronary events: retrospective cohort analyses[J]. JRSM Open, 2018,9(1):2054270417732699.
[3] Han L, Shen WJ, Bittner S, et al. PPARs: regulators of metabolism and as therapeutic targets in cardiovascular disease. Part II: PPAR-β/δand PPAR-γ[J]. Future Cardiol, 2017,13(3):279-296.
[4] Gómez-Hernández A, Martín-Ventura JL, Sánchez-Galán E, et al. Overexpression of COX-2,Prostaglandin E synthase-1 and prostaglandin E receptors in blood mononuclear cellsand plaque of patients with carotid atherosclerosis: regulation by nuclear factor-kappaB[J]. Atherosclerosis, 2006, 187(1):139-149.
[5] 陆再英,钟南山.内科学[M] .第7版,北京:人民卫生出版社, 2008:274.
[6] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南[J].中华心血管病杂志,2010,38(8):675-690.
[7] Chandrasekhar J, Baber U, Sartori S, et al. Associations between complex PCI and prasugrel or clopidogrel use in patients with acute coronary syndrome who undergo PCI: from the PROMETHEUS study[J]. Can J Cardiol, 2018,34(3):319-329.
[8] Ayumu H, Ken K, Aki HS, et al. Qualitative score of systemic arteriosclerosis by vascular ultrasonography as a predictor of coronary artery disease in type 2 diabetes[J]. Atherosclerosis, 2011,219(2):623-629.
[9] Ohira M , Endo K, Oyama T, et al. Improvement of postprandial hyperglycemia and arterial stiffness upon switching from premixed human insulin 30/70 to biphasic insulin aspart 30/70[J]. Metabolism, 2011,60(1):78-85.
[10] Gui MH, Li X, Lu ZQ, et al. Fasting plasma glucose correlates with angiographic coronary artery disease prevalence and severity in Chinese patients without known diabetes[J]. Acta Diabetol, 2013,50(3): 33-34.

