内皮型一氧化氮合酶脱偶联分子机制
王妍琦 王其新
病理条件(如高血压,高血脂和糖尿病等)引起内皮细胞合成和分泌血管活性物质[如一氧化碳(NO)、前列环素]功能受损,导致血管舒缩异常、血管紧张度增加、血小板聚集、白细胞黏附和血管壁受损等现象。一氧化氮合酶(NOS)合成的NO是促进血管舒张的重要细胞因子,包括内皮细胞型(eNOS)、神经型(nNOS)、诱导型(iNOS)三种类型,iNOS在细胞受损后诱导生成,nNOS多位于神经元细胞; eNOS在血管内皮细胞中合成NO,调节血管功能。引起内皮细胞最首先暴露于外源性损伤因子中的组织,eNOS脱偶联,NO生物利用度降低,内皮细胞功能障碍或受损,是许多心血管疾病的始动事件。因此,深入了解eNOS脱偶联机制,对靶向性防治心血管疾病具有重要意义。
1 eNOS分子结构
位于内皮细胞的eNOS包含多个结构区域,包括氧化域和还原域。四氢生物蝶呤(BH4)、血红素和L-精氨酸的结合位点在N-端的氧化域[1]。锌指结构是由两个亚基上的半胱氨酸残基和锌离子(Zn2+)构成的,是连接两个结构域之间的桥梁[2]。钙调蛋白(CaM)、烟酰胺腺嘌呤二核苷酸(NADPH)和黄素的结合位点在C-端的还原域。NO合成过程中, NADPH 氧化产生的电子从还原域的黄素传递到氧化域的血红素,使血红素铁与O2结合催化L-精氨酸逐步合成NO。eNOS的活性受钙离子浓度和CaM结合的影响,也受翻译后水平(如棕榈酰化、磷酸化、S-谷胱甘肽化、S-亚硝基化)的调节[1]。
翻译后,内皮细胞中eNOS与质膜小窝上的小
[作者单位]1青岛大学医学部,青岛266071;2青岛大学附属医院,青岛266000
本文2017-12-10收到,2018-03-14修回
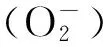
2 eNOS脱偶联机制
eNOS主要表达于血管内皮细胞中,在形成二聚体结构后发挥生物学作用,与 L-精氨酸结合生成NO,构成防御血管损伤的主要屏障。病理条件下,各种刺激因素导致eNOS结构发生改变,由二聚体变为单体,eNOS功能障碍,NO生成减少及生物利用度降低,导致血管内皮功能受损,这种变化为eNOS脱偶联。
2.1 BH4缺乏
BH4是eNOS的辅助因子,其作用是维持血红素结合位点结构稳定,增强 eNOS与L-精氨酸的结合能力[3],生理条件下,BH4具有较强还原性,可还原活性氧(ROS)和过氧化亚硝基阴离子(ONOO-)。 NADPH被氧化成NADP+, eNOS将其产生的电子转运给L-精氨酸而使其氧化成L-胍氨酸,生成NO[4]。病理条件下,氮氧化合物(NOx)的激活会增加ROS的生成,氧化BH4使BH4缺乏。BH4可促进eNOS单体组装成为一个活跃的二聚体,而在BH4缺乏的情况下,则不能将电子转移到eNOS的N端氧化酶域。ONOO-导致eNOS的活性降低,破坏eNOS的二聚体,损伤内皮细胞。BH4对许多类型ROS氧化敏感,ONOO-被认为是使BH4氧化为二氢生物蝶呤(BH2)的最主要的物质。氧化型BH2可以与BH4相互竞争eNOS,分享相同的N-端氧化区结合位点。然而,BH2无法支持eNOS的辅因子活性,所以该位移导致eNOS脱偶联。研究证明,降低BH4或升高BH2均会降低NO生物利用度,并导致eNOS功能障碍[5]。降低BH4生物利用度,会使eNOS脱偶联,增加超氧阴离子的生成,使NO/cGMP信号受损[6]。因此,在氧化应激条件下,BH4补救合成途径将变得尤为重要。二氢生物蝶呤还原酶 (DHPR)和二氢叶酸还原酶 (DHFR)是补救合成途径的关键,DHPR 可以还原醌式 BH2为 BH4,DHFR可以激活叶酸为 5-甲基四氢叶酸并还原BH2为BH4[7]。
2.2 L-精氨酸缺乏
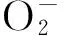
2.3 锌指结构破坏
锌指结构位于 eNOS 的氧化域,由两个半胱氨酸残基和一个 Zn2+组成,其主要作用是维持每个亚基上血红素之间的距离相等,从而保证BH4 结合位点结构的稳定。锌指结构突变会导致Zn2+、BH4、L-精氨酸不能结合,使eNOS 失活,即锌指结构对稳定eNOS的结构和活化非常重要。实验证明,锌指转录因子 ZFP580 可以通过增强eNOS的表达,提高NO生物利用度,促进内皮祖细胞向内皮细胞分化和血管形成。ONOO-可以在eNOS二聚体上氧化锌指结构,造成Zn2+的释放和eNOS二聚体结构不稳定[12]。
2.4 谷胱甘肽化
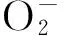
2.5 乙酰化
eNOS乙酰化可导致eNOS功能障碍。沉默信息调节因子1(SIRT1)是一种去乙酰化酶,参与代谢,调节细胞存活、分化,寿命,通过脱乙酰基和eNOS的激活使血管舒张[14]。生理条件下,SIRT1可以通过调节NAD+/NADH比值控制eNOS乙酰化,而氧化应激可下调SIRT1,使eNOS乙酰化,NO生成减少[15]。此外,eNOS也可以被组蛋白去乙酰化酶3(HDAC3)乙酰化,通过抑制eNOS与CaM结合降低NO的生成[5]。
2.6 蛋白质-蛋白质相互作用
蛋白质相互作用是一个重要的eNOS翻译后机制调节。在生理和病理过程中,eNOS已被证实与多种调节蛋白和结构蛋白相互作用,它们可精细调节eNOS活性,并参与eNOS与细胞膜和细胞器膜的结合和运输。增强eNOS活性的蛋白,钙调素、HSP90、高密度脂蛋白(HDL)、发动蛋白-2,β-肌动蛋白、外膜蛋白、微管蛋白和载脂蛋白AI(ApoAI)。负相互作用的蛋白包括小窝蛋白、G蛋白偶联受体(GPCR)、一氧化氮合酶相互作用蛋白(NOSIP)、一氧化氮合酶运输诱导剂(NOSTRIN)。其中发动蛋白-2、NOSIP、NOSTRIN和细胞骨架也参与了eNOS在内皮细胞中的运输。此外,阳离子氨基酸转运蛋白1(CAT-1)、精氨琥珀酸合成酶(ASS)、精氨琥珀酸裂解酶(ASL)、和可溶性鸟苷酸环化酶(SGC)促进底物(L-精氨酸)向eNOS定向输送,促进NO生成与靶向作用[16]。
2.7 Nox4与内质网应激
3 结语
eNOS 脱偶联机制包括BH4的缺乏、L-精氨酸的缺乏、锌指结构的破坏、谷胱甘肽化、乙酰化等。eNOS脱偶联是许多心血管疾病的始动事件,因此针对 eNOS 脱偶联机制的对策如阻断ROS的产生[20],BH4补救合成,补充L-精氨酸,去谷胱甘肽化、去乙酰化,等可能是预防和治疗心血管疾病的有效手段。
◀
本文作者简介:
王妍琦(1992—),女,汉族,硕士研究生,研究方向:急诊内科(心血管方向)
参考文献
1 Siragusa M, Fleming I. The eNOS signalosome and its link to endothelial dysfunction[J]. Pflugers Arch,2016, 468(7):1-13.
2 赵艳霞,格日力. 内皮型一氧化氮合酶脱偶联在心血管疾病中的致病作用[J]. 中国循环杂志,2014,29(4):315-318.
3 Chen DD, Chen LY, Xie JB, et al. Tetrahydrobiopterin regulation of eNOS redox function[J]. Current Pharmaceutical Design, 2014, 20(22):3 554-3 562.
4 Chalupsky K, Kracun D, Kanchev I, et al. Folic acid promotes recycling of tetrahydrobiopterin and protects against hypoxia-induced pulmonary vascular hypertension by recoupling endothelial nitric oxide synthase[J]. Antioxidants & Redox Signaling, 2015, 23(14):1 076.
5 Li Q, Youn JY, Cai H. Mechanisms and consequences of endothelial nitric oxide synthase dysfunction in hypertension[J]. Journal of Hypertension, 2015, 33(6):1 128.
6 Santhanam AVR, D’Uscio LV, He T, et al. Uncoupling of endothelial nitric oxide synthase in cerebral vasculature of Tg2576 mice[J]. Journal of Neurochemistry, 2015, 134(6):1129-1 138.
7 Xie L, Talukder MA, Sun J, et al. Liposomal tetrahydrobiopterin preserves eNOS coupling in the Post-ischemic heart conferring in vivo cardioprotection[J]. Journal of Molecular & Cellular Cardiology, 2015, 86(9):14-22.
8 Nguyen MC, Park JT, Jeon YG, et al. Arginase inhibition restores peroxynitrite-induced endothelial dysfunction via L-Arginine-dependent endothelial nitric oxide synthase phosphorylation[J]. Yonsei Medical Journal, 2016, 57(6):1 329.
9 Xia N, Horke S, Habermeier A, et al. Uncoupling of endothelial nitric oxide synthase in perivascular adipose tissue of diet-induced obese mice[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2015, 36(1):78.
10 Badran M, Abuyassin B, Golbidi S, et al. Uncoupling of vascular nitric oxide synthase caused by intermittent hypoxia[J]. Oxidative Medicine & Cellular Longevity, 2016, 2016(1):1-9.
11 Xuan C, Lun LM, Zhao JX, et al. L-citrulline for protection of endothelial function from ADMA-induced injury in porcine coronary artery[J]. Scientific Reports, 2015, 5(6):10 987.
12 Wei S, Huang J, Li Y, et al. Novel zinc finger transcription factor ZFP580 promotes differentiation of bone marrow-derived endothelial progenitor cells into endothelial cells via eNOS/NO pathway[J]. Journal of Molecular & Cellular Cardiology, 2015, 87(1):17.
13 Galougahi KK, Liu CC, Gentile C, et al.Glutathionylation mediates angiotensin II-induced eNOS uncoupling, amplifying NADPH oxidase-dependent endothelial dysfunction[J]. Journal of the American Heart Association,2014, 3(2):e000731.
14 Kim YH, Hwang JH, Kim KS, et al. NAD(P)H:quinone oxidoreductase 1 activation reduces blood pressure through regulation of endothelial nitric oxide synthase, acetylation in spontaneously hypertensive rats[J]. American Journal of Hypertension, 2015, 28(1):50-57.
15 Ding M, Lei J, Han H, et al. SIRT1 protects against myocardial ischemia-reperfusion injury via activating eNOS in diabetic rats[J]. Cardiovascular Diabetology,2015, 14(10):143.
16 Su Y. Regulation of endothelial nitric oxide synthase activity by protein-protein interaction[J]. Current Pharmaceutical Design,2014, 20(22):3 514-3 520.
17 Lee DY, Wauquier F, Eid AA, et al. Nox4 NADPH oxidase mediates peroxynitrite-dependent uncoupling of endothelial nitric-oxide synthase and fibronectin expression in response to angiotensin II: role of mitochondrial reactive oxygen species[J]. The Journal of Biological Chemistry,2013, 288(40):28 668-28 686.
18 Lee HY, Zeeshan HMA, Kim HR, et al. Nox4 regulates the eNOS uncoupling process in aging endothelial cells[J]. Free Radical Biology & Medicine,2017, 113(11):26-35.
19 Li P, Zhang L, Zhang M, et al. Uric acid enhances PKCdependent eNOS phosphorylation and mediates cellular ER stress: A mechanism for uric acid-induced endothelial dysfunction[J]. International Journal of Molecular Medicine,2016, 37(4):989-997.
20 Godo S, Shimokawa H. Divergent roles of endothelial nitric oxide synthases system in maintaining cardiovascular homeostasis[J]. Free Radical Biology & Medicine,2017, 109(8):4-10.