尾矿土中解磷细菌的筛选及对镉的耐受研究
(.四川省自然资源科学研究院,四川 成都 6004;.四川农业大学,四川 成都 630)
矿产资源是国民经济的重要支柱,但矿产资源的开采会造成矿区土壤的严重破坏。据报道,我国采矿业形成的矿山、排土场、尾矿库等导致约400万hm2的土地受到破坏,并且以每年4万hm2左右的速度增加[1]。近年来,尽管我国矿山治理取得了较大的进展,废弃地复垦系数已达到12%,但与发达国家100%的复垦率相比,仍存在着很大的差距,我国的矿山废弃地复垦任重道远[2]。在矿区土壤复垦中,面临较严重的问题是矿区土壤十分贫瘠。通过对矿区具有促进植物生长的细菌筛选,筛选出具有解磷、解钾等作用的细菌,且从矿区土壤中分离出的土著细菌具有抗重金属胁迫的能力。通过该类细菌对高浓度重金属耐受程度的测定,可进一步筛选出既具有促生作用又能耐受矿区高含量重金属的细菌菌株,为矿区污染土壤修复提供宝贵的微生物资源,也为增加土壤肥力的微生物菌种开发提供必要的条件。
攀枝花位于四川省西南部,是我国重要的钒钛钢铁基地。攀枝花地区矿产资源丰富,已发现76种矿产,潜在储量在300亿t以上,其中钒钛磁铁矿储量96.6亿t,钛储量占世界钛总量的35.2%,为世界之最[3]。经过几十年的开采,攀枝花形成的废矿区面积高达2724.93hm2,造成土地质量和土壤承载能力大大降低,土壤酸化,重金属污染,有机质和氮、磷含量较低,持水能力差,土壤生态系统受到严重破坏[4]。当地政府积极采取措施治理工矿废弃地,开始对废弃矿地进行退建复耕或还林还草,取得了一定的成效,2012年攀枝花成为我国工矿废弃地复垦利用试点城市[5]。总体看,攀枝花废弃矿区环境污染和生态破坏的局面未得到根本改观[6]。尾矿是矿石经选别出精矿后剩余的固体废料,尾矿量大,侵占了大量土地资源,严重破坏了当地的生态环境[7]。尾矿中各种残留成分对环境造成了严重破坏,部分筛选药剂也有可能对生态环境造成不可逆的损害。如铁矿、磷矿等尾矿中含有大量重金属,随着这些重金属排放到土壤和河湖水体,将会严重破坏人类赖以生存的环境,同时重金属会进入人们的食物链,对人体造成严重的影响[8,9]。因此,为了减小矿业开采对生态环境的破坏,应加强尾矿库土地复垦和矿区土壤修复,这是矿业持续发展有待解决的主要问题之一[10]。
目前,攀枝花矿区土壤复垦面临的难题是复垦区的土壤贫瘠问题。由于尾矿区土壤营养成分缺乏,很多复耕植物生长差,急需提高土壤肥力以促进复耕植物生长。磷元素是植物生长必需的三大主要元素之一,是生物体内核酸和磷脂的重要组分,也是生物膜、原生质和细胞核的组成成分之一[11]。我国大部分地区土壤中的含磷量平均仅为0.12%,土壤溶液中的浓度一般在0.005—1.0mg/kg,总磷含量虽然丰富但有效磷匮乏是磷元素的主要特征,可溶性磷含量较低不易被植物吸收利用,施入土壤的磷肥利用率仅为5%—25%[12]。土壤中磷元素含量较高,但大多是以难溶于水的复杂化合物,植物吸收这些大分子含磷化合物较困难。大分子含磷化合物在微生物尤其是在细菌的作用下,将不溶于水的含磷化合物分解为可溶性化合物,是解决土壤缺磷的主要途径。微生物代谢产生的植酸酶、核酸酶和磷酸酶等可加速含磷有机化合物分解,极大地改善了植物的磷素营养状况,可在不增加化学磷肥的状况下提高土壤磷元素含量[12-15]。通过筛选开发具有溶磷效应的微生物菌剂,改善矿区尾矿复耕区的有效磷含量是提高尾矿复耕率的重要措施之一[16]。在实际应用中,特别是在尾矿修复中,尾矿中的重金属含量和其他有害药剂超标,很多具有促进解磷溶磷效果的菌剂很难在重金属含量较高的尾矿库土壤中生长,溶磷作用受到严重抑制。本研究以尾矿库土壤为研究对象,从中筛选出兼具溶磷效果和抗重金属胁迫的细菌菌种。由于该细菌对生长环境的自然选择,本身具有很好的抗重金属能力,可结合两种功效,促进尾矿区复耕。
目前,对微生物参与难溶态磷素利用的研究多在芽孢杆菌,其次主要在真菌和放线菌等方面[17,18]。溶磷细菌主要包含以下类别:芽胞杆菌(Bacillus)、欧文氏菌(Erwinia)、假单胞杆菌(Pseudomonas)、土壤杆菌(Agrobacterium)、沙雷氏菌(Serratia)、黄杆菌(Flarobacterium)、肠细菌(Enterbacter)、微球菌(Micricoccus)、固氮菌(Azotobacter)、根瘤菌(Rhizobium)、沙门氏菌(Salmonella)、色杆菌(Chromobacterium)、产碱菌(Alcaligenes)、节细菌(Arthrobacter)、硫杆菌(Thiobacillus)、埃希氏菌(Escherichia)[19];解磷真菌在数量上远低于解磷细菌,主要分布在曲霉(Spergillus)、青霉(Penicillium)、镰刀菌(Fusarium)、小丝核菌(Sclerotium)等属种。在解磷微生物种中,不同种类的微生物不但解磷能力差异大,且解磷机理也不尽相同[20]。多数研究认为,解磷菌的解磷作用是微生物的次生代谢产物导致含磷化合物的可溶性改变,微生物产生的有机酸对含磷化合物的可溶性提高起到了关键作用,微生物改变了土壤中的pH,最终导致磷酸盐的可溶性变化[18,21,22]。
本研究从攀枝花钒钛磁铁尾矿土中分离筛选到具有较好溶磷效果的细菌菌株,运用分子方法鉴定出细菌的种属,并在室内条件下初步研究了溶磷能力和菌株生长量[20]。然后在重金属胁迫下测定解磷菌株,分析对重金属的耐受性和在重金属胁迫下解磷菌的溶磷效果,得出重金属镉对解磷菌株的抑制浓度和致死浓度。最后筛选和构建高效解磷菌株,为利用解磷菌提高尾矿磷素利用效率提供理论依据,也为尾矿土壤的生物修复和尾矿堆积物的复垦提供可利用的解磷菌株资源。
1 材料与方法
1.1 材料
解磷细菌:本研究的土壤细菌主要来源于攀枝花朱家包包矿区的废矿土壤。
培养基与试剂:①(PKO)无机磷固体培养基。葡萄糖10g、磷酸钙5g、(NH4)2SO40.5 g、NaCl 0.2g、MgSO40.03g、MnSO40.03g、FeSO40.003g、琼脂18g、KCl 0.2g、去离子水1L、pH6.8—7.0。②PKO液体培养基。葡萄糖10g、磷酸钙5g、(NH4)2SO40.5g、NaCl0.2g、MgSO40.03g、MnSO40.03g、FeSO40.003g、KCl 0.2g、去离子水1L、pH7.2[23]。③TY培养基。葡萄糖10.0g、NaC l5.0g、蛋白胨2.0g、酵母膏5.0g、pH7.2。④钼锑抗试剂。称取酒石酸锑钾(KSbOC4H4O6)0.9g,缓慢溶于100mL水中,制成5%的溶液。称取钼酸铵20g溶于双蒸水450mL,缓慢加入208.3mL(质量分数98.3%)浓硫酸,同时用玻棒搅动散热,再将0.5%的酒石酸锑钾100mL加入到钼酸铵液中,定容至1L,充分摇匀,贮于棕色瓶中避光保存[24]。
1.2 方法
矿土样采集:将攀枝花朱家包包废矿区作为具体测试点,随机选择三个采样区域(废矿区Ⅰ、废矿区Ⅱ、废矿区Ⅲ),每个区域间距根据废矿区具体情况而定(间距相同),包括废矿新区、老区和尾矿区,做好登记;每个采矿区域选取5点(梅花型布点),两点之间至少相距5m(图1),采集0—30cm土层样品,混合后四分法分取并装入无菌聚乙烯塑料袋中,运回学校实验室做下一步实验。

图1 废矿区采集样点分布
尾矿土壤细菌的分离与纯化:尾矿土壤细菌的分离主要采用稀释平板涂布法。实验前准备装有9mL无菌水的试管24支、灭菌移液管7支、牛肉膏蛋白胨培养基平板12个、无菌培养皿9个、尾矿土壤土样5.0g;将土样加入5mL无菌水的三角瓶,摇30min混均匀,再用移液枪吸取1mL加入9mL无菌水的试管,逐一稀释,细菌分别稀释到10-6、10-5、10-4;另吸取150μL不同浓度的稀释液用涂布棒在牛肉膏培养基上涂布均匀,每个做3个重复,置于28℃的培养箱中培养2天,挑选出不同形态的单菌落进行划线纯化,做革兰氏染色后镜检,菌株形态单一的视为获得纯化菌株,然后在牛肉膏斜面(4℃)和甘油管(-80℃)中保种。
解磷细菌定性分析:采用PKO平板培养法,每个平板采用点接法,每株菌株接3个平板,28℃培养7天。同时,观察并测量菌落直径大小以及其周围透明圈的大小,根据透明圈评判该菌株是否具有溶磷作用。
解磷细菌定量分析:将30mL液体PKO置入50mL的三角瓶中,121℃灭菌30 min,按1%接种量在30mL液体PKO培养基中接入各供试菌株种子液,每株菌3个重复,并在同样的PKO液体培养基中接入等量无菌水作为对照。在28℃、150r/min振荡培养7天后,取出培养液8000 r/min离心10min,稀释上清液后用钼锑抗比色法测定培养液中的有效磷。
解磷菌株的产量确定分析:配制1L的PKO液体培养基,每支试管分装5mL,灭菌后冷却至室温,按照1%的接种量接种,每株菌株3个重复。对照CK为相同的PKO液体培养基中接种入等量无菌水。接种完成后置入温度28℃、转速150r/min恒温摇床中培养,分别培养1天、2天、3天、4天、5天、6天、7天,再分别在1天、2天、3天、4天、5天、6天、7天取出培养液,在转速8000r/min离心机中离心5min,取上清液,用钼锑抗比色法在波长660nm下比色,测定培养液的磷含量,最后确定解磷细菌解磷产量最高的一天,并筛选出磷含量最高的菌株进行下一步研究。
基因组DNA的提取:将筛选出解磷效果较好的菌株进行DNA提取,采用GUTC法(异硫氰酸胍),操作步骤见图2。
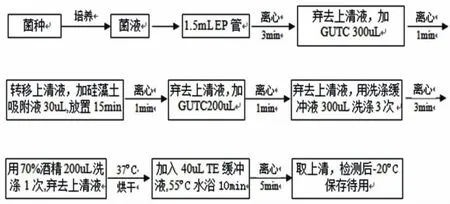
图2 GUTC法提取细菌总DNA流程
解磷菌株16S rRNA扩增与测序:以总DNA为模板,选用引物27F和1492R扩增16S rRNA[25],引物序列为:

图3扩增程序
反应体系(25μL):2×PCR Mix 12.5μL;27F(10pmol)0.15μL;1492R(10pmol)0.15μL;模板DNA(50ng/ml)1μL;双蒸水补足至25μL,石蜡油1滴覆盖。扩增程序见图3。
16S rRNA扩增产物用1%的琼脂糖凝胶电泳检测,扩增片段长度为1.5Kb,检测后送上海生工基因公司测序。然后,将16S rRNA序列在GeneBank中进行Blast分析以确定其同源性,并将16S rRNA序列与标准菌株一起构建系统发育树以分析尾矿土壤中解磷菌株的多样性。
解磷细菌对重金属镉的耐受性分析:将浓度为5×10-5mol/L的Cd2+按照一定的含量梯度加入优势菌株的TY溶液中,每株菌株3个重复。以接种到不含重金属TY液体培养基作为CK。在28℃、150r/min振荡培养1天后取出,取一定量的菌液用分光光度计(波长660nm)测定,进行OD值与空白对照比较,确定重金属镉抑制浓度和致死浓度。
重金属镉对解磷细菌的影响分析:每支试管装入5mLPKO液体培养基,121℃灭菌30min,冷却至室温,在无菌工作台上进行接种,分别接入浓度为5×10-5mol/L的Cd2+,接入量依次为0、2.5μL、5.0μL、7.5μL、10μL、12.5μL、15μL、17.5μL、20μL、22.5μL、25μL,将筛选出优势细菌分别接入试管内;按1%接种量置入5mLTY液体培养基中,再置入各供试菌株种子液,每株菌3个重复,以同样在TY液体培养基中接入等量无菌水作为CK。接种完成后放入28℃、150 r/min的恒温摇床振荡培养3天后,取培养液在转速8000r/min离心机里离心5min,然后取上清液用钼锑抗比色法在分光光度计(波长660nm)下比色,测定磷含量。
2 结果与分析
2.1 尾矿土壤细菌分离结果
本实验采用稀释平板涂布法从攀枝花朱家包包废矿土壤中分离出纯化细菌,在挑选单菌落时主要根据菌落形态的大小、颜色、形状等挑选不同菌落特征的菌株136个。在纯化过程中利用显微镜观察菌体形态,其中大部分细菌为革兰氏阳性细菌,菌体形态为杆状。

表1 解磷细菌定性筛选结果
2.2 解磷细菌的筛选结果
解磷细菌的初筛结果:对136株尾矿土壤细菌菌株进行初筛后得到4株菌株具有解磷效果,其溶磷圈直径见表1。从表1可见,分别为WDGJ-20、WDN-5、KX-2、BDGJ-15菌株。
解磷细菌定量时间测试分析:将筛选出的4株优势解磷菌株进行解磷定量测试,通过7个不同时间点取样测试,评估得到不同时间点的解磷效果:4株优势细菌在第5天时的解磷效果最明显,其中WDN-5比其他3株菌的溶磷量高(图4)。
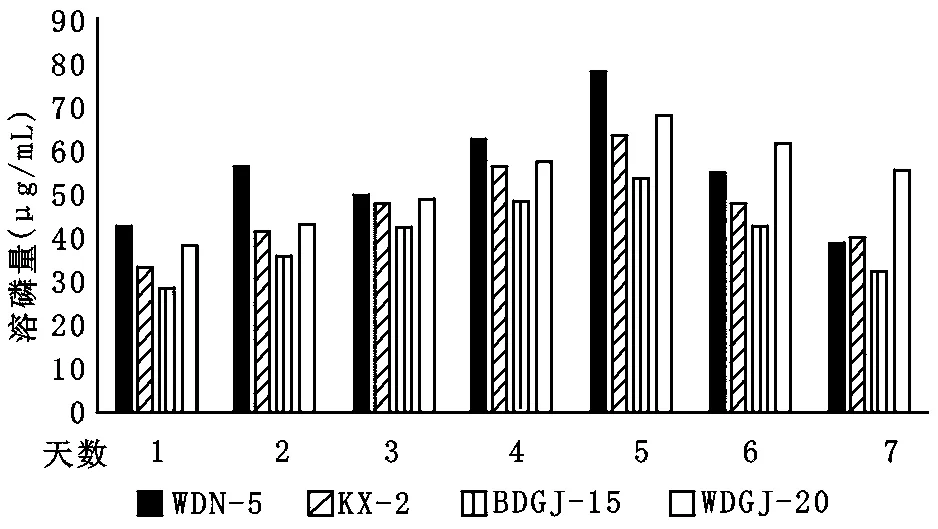
图4 不同培养时间下解磷菌的溶磷量
2.3 解磷细菌分子鉴定
我们将筛选出的4株解磷菌株进行16S rRNA的PCR扩增,产物经琼脂糖凝胶电泳检测,扩增条带约1400bp,PCR产物送交测序公司进行测序。对4株解磷菌株的16S rRNA基因序列在GenBank数据库进行BLAST比对,分析溶磷效果较好的4株解磷菌株的同源性与种属均属于Bacillus属(表2)。其中,WDN-5为效果最好的1株解磷菌,将WDN-5 16S rRNA基因序列构建系统发育树(图5)。结果显示,与标准菌株Bacillus subtillis GU086413在同一个分支上,且相似度为99%,说明属于Bacillus subtillis。

表2 解磷菌株16sRNA基因测序及同源性分析
2.4 重金属镉胁迫下解磷细菌解磷能力测定
解磷细菌对重金属镉的耐受性分析:通过在解磷菌优势菌株WDN-5培养液中加入不同含量的重金属镉,以不加重金属镉的优势菌株WDN-5培养液为对照CK,在28℃、150 r/min摇床振荡培养1d后取出,取约2mL的培养液经过分光光度计测定,测定出空白对照CK的OD值为0.307。从图6可知,致死浓度为300mg/L,所以选取0—300 mg/L作为培养浓度进行重金属镉胁迫试验。
重金属镉胁迫下的解磷菌解磷能力测定:根据解磷细菌对镉的耐受性分析,耐受性选取0—300mg/L作为培养含量进行重金属镉胁迫试验。通过设计镉的不同含量梯度重金属胁迫实验,用钼锑抗比色法测定磷含量。WDN-5菌株在重金属镉0—300 mg/L浓度之间随着浓度逐渐增加对其解磷能力逐渐减少(图7)。

图5 WDN-5的16S rRNA系统发育树

图6 镉对WDN-5抑制浓度和致死浓度

图7 镉胁迫下WDN-5的解磷作用
3 结论与讨论
本研究将具有解磷作用的菌株接种到含有难溶性磷酸盐的固体培养基上,在适宜的温度条件下培养,通过测定菌落周围产生的透明圈的直径大小来判定该微生物溶磷能力。
本研究通过从尾矿土中分离筛选微生物,经过在PKO平板上28℃培养7天后,初步筛选出的4株细菌透明圈直径均超过了2cm,这些透明圈表明该细菌具有很好的解磷溶磷作用。溶磷晕圈直径的大小可定性地反映细菌的溶磷磷能力,而要定量评价菌株的解磷能力,则需要通过溶磷时间分析实验确定。通过溶磷定量时间分析,本研究筛选出溶磷效果最好的WDN-5菌株在培养后第5天的效磷含量为77.14μg/mL,在上清液中的溶磷量达到71.92μg/mL。本研究分离得到的WDN-5为芽孢杆菌,培养第5天后的溶磷作用达到77.14μg/mL,具有较好的溶磷效果。此外,本研究是从矿土分离得到细菌,其生活的环境决定了自身具有很好的抗逆性和抗重金属胁迫性。通过后续的研究表明,WDN-5在较高重金属镉的胁迫下具有解磷效应,可更好地应用到重金属超标的尾矿库中和较高重金属含量的农田中,应用前景广阔。
高浓度的重金属是矿区土壤生物修复过程中最重要的限制性因素,Cu、Cd、Pb、Cr对芽孢杆菌有明显的抑制作用,其中以大芽孢杆菌更为敏感。因此,需要筛选一些具有较强的能够的优势菌株作为菌剂使用,为尾矿土壤的生物修复和尾矿堆积库的复垦提供可利用的解磷菌株资源。本研究从钒钛磁铁矿区表层土壤中所筛选到的解磷细菌WDN-5,除了具有很强的解磷能力外,对镉的耐受性也很好,虽然它不能直接富集重金属,但可作为尾矿库的植物修复提供必要的条件。
通过测定在含有重金属镉的培养基中解磷细菌WDN-5解磷能力的变化情况,表明该细菌的溶磷作用会随着重金属浓度的增高而降低,WND-5对镉的致死浓度为300 mg/L;在50—300 mg/L的镉胁迫下,随着镉浓度的增加,WDN-5的溶磷量逐渐降低。本研究开发的细菌可用于含有重金属镉的尾矿库中,通过溶磷细菌的溶磷作用,增加尾矿库土壤的养分含量,为尾矿库的植物修复提供了土壤条件。本研究主要对耐受重金属镉的解磷细菌开展菌株筛选和耐受性研究,对细菌耐受重金属的机理未进行深入研究,这是下一步的研究工作,以期为重金属污染的土壤开展植物修复提供更多的微生物菌群。
:
[1]满正闯,苏春江,徐云,等.攀枝花市国土资源可持续利用研究[J].国土与自然资源研究,2006,(4)∶12-13.
[2]谭晓娟.攀枝花钒钛矿区植物对钛的富集特性研究[J].四川环境,2012,31(2)∶46-51.
[3]滕彦国,倪师军,张成江.攀枝花矿业基地矿区环境现状与环境恢复的途径[J].矿业安全与环保,2001,28(3)∶28-30.
[4]庹先国,徐争启,滕彦国,等.攀枝花钒钛磁铁矿区土壤重金属地球化学特征及污染评价[J].矿物岩石地球化学通报,2007,26(2)∶127-131.
[5]魏远,顾红波,薛亮,等.矿山废弃地土地复垦与生态恢复研究进展[J].中国水土保持科学,2012,10(2)∶107-114.
[6]徐翔.建设攀枝花地区矿业生态工业园的可行性分析[J].矿产保护与利用,2010,(4)∶15-17.
[7]张溪,周爱国,甘义群,等.金属矿山土壤重金属污染生物修复研究进展[J].环境科学与技术,2010,33(3)∶106-112.
[8]姜丽新,徐秀茹.尾矿库对周边环境的影响及废弃地再利用[J].辽宁工程技术大学学报,2011,30(s1)∶8-10.
[9]刘惠欣,李富平.矿区尾矿土壤生物修复技术[J].环境科技,2008,21(a01)∶139-141.
[10]康贻军,程洁,梅丽娟,等.植物根际促生菌作用机制研究进展[J].应用生态学报,2010,21(1)∶232-238.
[11]周德超.氮、磷、钾在植物体中的主要生理作用及植物对养分的吸收[J].生物学通报,1983,(5)∶9-10.
[12]李剑峰,张淑卿,师尚礼,等.解磷根瘤菌液体培养基类型、浓度及透气条件的比较[J].草原与草坪,2010,30(1)∶28-32.
[13]张宝贵,李贵桐.土壤生物在土壤磷有效化中的作用[J].土壤学报,1998,(1)∶102-111.
[14]Brookes P C,Powlson D S,Jenkinson D S.Phosphorus in the Soil Microbial Biomass[J].Soil Biology & Biochemistry,1984,16(2)∶169-175.
[15]韩文星,姚拓,梁启鹏,等.PGPR菌肥对燕麦根系性状影响的研究[J].草原与草坪,2008,(4)∶1-4.
[16]田江.尾矿废弃地土壤中解磷菌的筛选、鉴定和特性研究[D].北京:北京林业大学硕士学位论文,2014.
[17]陈廷伟.解磷巨大芽胞杆菌分类名称、形态特征及解磷性能述评[J].中国土壤与肥料,2005,(1)∶7-9.
[18]Reddy M S,Kumar S,Babita K,etal.Biosolubilization of Poorly Soluble Rock Phosphates by Aspergillus Tubingensis and Aspergillus Niger[J].Bioresource Technology,2002,84(2)∶187-189.
[19]李显刚,姚拓,王小利,等.一株分离自葛藤根际高效溶磷细菌特性研究及菌株鉴定[J].中国土壤与肥料,2012,(2)∶87-91.
[20]贺梦醒,高毅,胡正雪,等.解磷菌株B25的筛选、鉴定及其解磷能力[J].应用生态学报,2012,23(1)∶235-239.
[21]Pea A,Rmn K,Jwb S.Inorganic Phosphate Solubilization by Two Penicillium Species in Solution Culture and Soil[J]. Soil Biology & Biochemistry,1988,20(4)∶459-464.
[22]Illmer P,Schinner F.Solubilization of Inorganic Calcium Phosphates—solubilization Mechanisms[J].Soil Biology & Biochemistry,1995,27(3)∶257-263.
[23]李剑峰,师尚礼,张淑卿.不同Ca3(PO4)2含量及菌种保存温度下SL01菌株的解磷及生长能力[J].中国生态农业学报,2010,18(1)∶94-97.
[24]钟宇舟.四川盆地大豆根瘤内生细菌分离鉴定及促生效果研究[D].雅安:四川农业大学硕士学位论文,2016.
[25]亢涵,藏春月,焦洋,等.高效除磷菌P7的生长特征及除磷性能研究[J].沈阳建筑大学学报(自然科学版),2017,(5)∶ 945-952.

