1株野生鼠诺如病毒的全基因组序列测定及分析
刘蒙蒙 李利利 林琳 王笑峰 段招军
266021 山东,青岛大学基础医学院病原生物学系(刘蒙蒙、王笑峰);100052 北京,中国疾病预防控制中心病毒病预防控制所腹泻室(李利利、段招军);250014 济南,山东省疾病预防控制中心 山东大学预防医学研究院 山东省传染病预防控制重点实验室(林琳)
诺如病毒(noroviruses,NVs)又称诺瓦克病毒,属于杯状病毒科诺如病毒属,是全世界引发非细菌性胃肠炎暴发和散发的重要病原[1-2]。诺如病毒属成员分为5个基因群,其中感染人的主要为GⅠ、GⅡ和GIV,感染牛的为GⅢ,感染马和猪的主要为GⅡ,而GV主要感染小鼠[3- 4]。2003年Karst从实验室小鼠中首次发现并分离了鼠诺如病毒-1(murine Norovirus-1,MNV-1)[5]。除了实验室小鼠,通过血清学或分子检测也在野生啮齿动物中发现了MNV[6-7]。
鼠诺如病毒(MNV)为单股正连RNA病毒,具有杯状病毒的典型特征,基因组全长7.3 kb左右,RNA的3’末端为poly(A)结构,5’末端无帽结构,而与一个小分子量的蛋白(VPg)共价相连[6]。诺如病毒基因组主要包括3个开放阅读框(open reading frame, ORFs):RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)包含在此区域;ORF2编码结构蛋白VP1,包括内部的核心区S区和向外突出的P区,P区分为P1和P2,P2区位于衣壳蛋白的最外层较易发生突变;ORF3编码小结构蛋白VP2,该蛋白可增强衣壳蛋白的表达和病毒的稳定性[8]。此外,研究还发现所有MNV都有第四个ORF(ORF4),与ORF2重叠,编码的蛋白参与固有免疫应答[9]因为MNV能在细胞和动物中复制,使得小鼠成为研究诺如病毒生物学和致病机理的模式动物,这有助于研究人员进一步探索人诺如病毒预防和治疗感染的途径。本研究通过对来自山东省不同区域的野生鼠MNV开展相关研究,为更全面的了解国内MNV病毒的分子遗传特征提供依据和参考。
1 材料与方法
1.1标本2016年11月份在山东省济宁市嘉祥县、青岛市黄岛区、淄博市淄川区捕鼠210只,鼠种包括褐家鼠、黑线姬鼠、大仓鼠、小家鼠、黄胸鼠和鼩鼱。解剖取其肠内容物和肝脏样本,运输至中国疾病预防控制中心,置于液氮中保存。本研究实验方案通过动物实验伦理审查,编号为20160715023。
1.2酶与试剂
1.2.1 核酸提取: QIAamp MinElute Virus Spin Kit,购自德国Qiagen公司,核酸置于-80 ℃备用。
1.2.2 核酸酶消化:DNaseI 消化酶,购自美国Thermo Scientific 公司。
1.2.3 逆转录: SuperScript Ⅲ逆转录试剂盒购自美国Invitrogen公司,RNA酶抑制剂(RRI)、dNTP购自日本TakaRa公司。
1.2.4 全基因组扩增: RT-PCR试剂盒,LA-Taq酶,Premix Ex Taq试剂, rapid amplification of cDNA Ends (RACE)试剂盒,DH5α感受态细胞,均购自日本TakaRa公司,T4 DNA连接酶购自美国NEB公司,PGEM T-easy载体购自美国Promega公司。
1.3标本的处理及病毒核酸提取在二级生物安全柜中取绿豆大小的老鼠肝脏和粪便标本分别加入1 ml minimum essential medium (MEM)进行匀浆,匀浆频率60 Hz,时间60 s。匀浆后的混合液用4 ℃离心机6 868×g离心20 min,取上清备用。将20~30只鼠的肝组织和粪便标本匀浆液分别混合,肝组织标本和粪便标本各建立10个混合样本库。分别从每个混合样本库中取200 μl匀浆液经DNaseI处理后进行RNA的提取,洗脱液为50 μl,提取的核酸送到华大基因进行高通量测序。
1.4病毒RNA逆转录将提取的核酸用SuperScript Ⅲ试剂盒进行逆转录,得到cDNA,反应体系为20 μl,条件如下: 随机引物1 μl,dNTP(10 mmol/L) 1 μl,病毒核酸10 μl,65 ℃ 5 min 预处理;5×Buffer 4 μl,0.1 mmol/L DTT 2 μl,RRI 0.5 μl,SSⅢ 0.5 μl, DNA free H2O 1 μl,25℃10 min,42 ℃ 50 min,72℃15 min,cDNA置于-20 ℃储存。
1.5病毒基因组扩增根据高通量测序拼接获得的MNV序列设计引物,引物设计使用软件Primer 5.0(加拿大Premier公司),采用SeqMan软件拼接序列。用PCR方法填补已知序列之间的未知序列。5′和3’末端序列采用rapid amplification of cDNA ends(RACE)方法进行扩增,利用1.5%琼脂糖凝胶电泳对上述PCR产物进行鉴定,对于RACE扩增获得的条带进行切胶回收,克隆测序获得目的序列,经拼接后获得该株MNV的全基因组序列。PCR产物序列测定在北京天一辉远生物公司进行。
1.6小鼠诺如病毒阳性标本的筛查根据获得的全基因组序列设计引物扩增, VP1区(F1 5’-GGGTTGGCACCGTCTCATT-3’, F2 5’-TAACCTTGAGCTTGGCCC-3’, R 5’-TAGTCGGGCAACTCATCC-3’)和RdRp区(F1 5’-AGATTGGACTGGGACGTGCTT-3’, R1 5’-GCCCATACCAACCGAACTGAT-3’,F2 5’-ATACTGATGCTGACTTCTCCCG-3’,R2 5’-AGAGACAACCTCGTCATCACCA-3’),扩增长度分别为120 bp和307 bp。210份标本进行筛查。PCR反应体系(25 μl):Premix Ex Taq 12.5 μl,DNA free H2O 9.5 μl,cDNA模板1 μl,上下游引物各1 μl,(引物一轮RdRP F1/R1,VP1 F1/R;二轮RdRP F2/R2,VP2 F2/R),反应条件为94℃30 s,55℃30 s,72℃30 s,30个循环,对获得的目的条带进行测序。
1.7统计学方法利用MEGA5.0软件进行多序列比对,同时利用MEGA5.0软件采用邻接法构建系统发育树,bootstrap值为1,000。
2 结果
2.1MNV基因组结构特征本研究获得的MNV变异株基因组全长为7 382 bp(命名为SDHD46)。3′端包含75 bp非编码区和pol(A) 结构,5’端无帽结构而与小分子量的蛋白(VPg)共价相连。编码区包括四个开放阅读框(ORFs),ORF1长5 061 bp (6~5 066 nt),编码1 686个氨基酸,与大多数MNVs相比少3个核苷酸;ORF2长1 629 bp(5 053~6 681 nt)编码衣壳蛋白VP1(542个氨基酸),比已知的大部分MNVs的ORF2区(1 626 bp)多三个核苷酸序列,相应的多编码一个氨基酸。其中ORF1 和ORF2之间有14个核苷酸的重叠区。ORF3长627 bp (6 681~7 307 nt),编码小结构蛋白VP2(208个氨基酸);ORF4 (5 066~5 707)包含在ORF2中,编码213个氨基酸。 MNV SDHD46的基因组序列上传至GenBank,序列号为MF973199。
2.2MNV在野生鼠中的检出分别用VP1区的半巢式及和RdRp区的巢式引物对210份鼠肠道标本中的MNV进行筛查,结果显示2份标本为MNV阳性,阳性率为0.95%。2份标本均来自青岛市黄岛区的黑线姬鼠。山东济宁市和淄博市采集的啮齿动物标本中并未检测到该病毒,说明MNV感染可能与野鼠的地理分布有关。
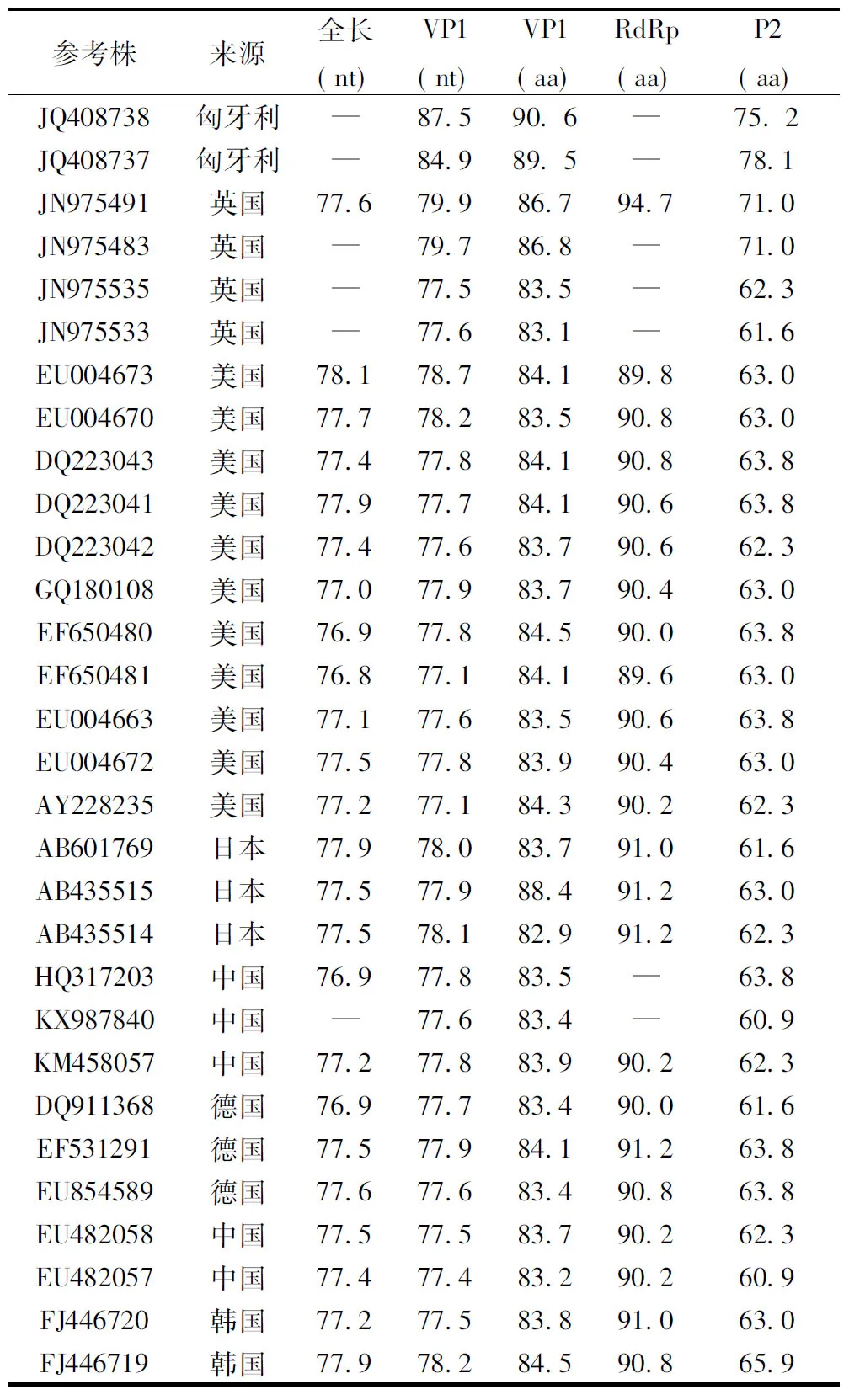
2.3MNV同源性分析本次实验分离出的MNV与选取的30株MNV参考株的全基因组核苷酸序列相似度为76.8%~78.1%,其中衣壳蛋白区VP1核苷酸序列相似度为77.1%~88.5%,编码的氨基酸相似度为82.0%~90.6%,RdRp区编码的氨基酸相似度为89.8%~94.7%。但是VP1高可变区域P2(278~415aa)区氨基酸序列相似度较低,为60.9%~78.1%,表明诺如病毒易于变异的特点。获得的MNV与参考株的相似度分析参见表1。
表1 MNV SDHD46与来自不同地域的30株参考株序列的相似度分析
Tab.1Identity of the nucleotide and amino acid sequences between MNV SDHD46 and 30 reference strains.
2.4SDHD46VP1区氨基酸变异分析进行了氨基酸序列比对分析,发现与30株参考毒株序列比较,SDHD46VP1区多了一个氨基酸,其中 SDHD46 与匈牙利的两株(JQ408737和JQ408738)比较,363位多一个甘氨酸 (Glycine, G);与其他的28株MNVs VP1序列比较301位多一个脯氨酸(Proline, P)。进一步分析SDHD46 VP1不同功能区氨基酸位点突变情况,发现S区只出现一个突变位点,P2区出现11个突变位点, P1区有4个突变位点。氨基酸突变位点见表2。
2.5MNV系统进化分析为了明确MNV衣壳蛋白VP1的系统进化特征,我们构建了基于核苷酸序列的进化树,如图1所示,SDHD46与来自匈牙利的毒株TF7WM(JQ408738)亲缘关系最近,并与来自匈牙利的毒株TF7WM 和TF5WM(JQ408737和JQ408738)以及来自英国的毒株Apo496和Apo455(JN975483和JN975491)聚集在一起形成另一进化分支。虽然本研究MNV毒株分离自中国,但其在进化分枝上与来自中国北京和广州(KM458057和 KX987840)的两株亲缘关系较远。基于RdRp氨基酸序列的进化树分析表明(见图2),SDHD46与来自英国的毒株Apo455亲缘关系最近,并聚集在一起形成独立进化支。在VP1进化分析中与本研究MNV亲缘关系较近的匈牙利毒株TF7WM 和TF5WM和另一英国毒株Apo496无对应的RdRp基因序列,无法明确其在RdRp区的进化关系是否与VP1一致。
表2 SDHD46与30株参考株VP1区氨基酸序列的突变位点
Tab.2The mutation of amino acid sequences in VP1 region of SDHD46 and 30 reference strains
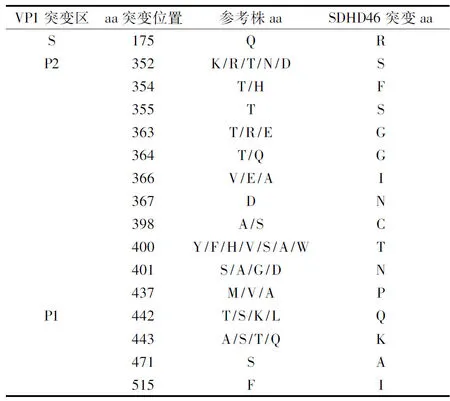
注:30株参考毒株GenBank号; Notes. Gene Bank numbers of the 30 reference strains(JQ408738、JQ408737、JN975491、JN975483、JN975535、JN975533、EU004673、EU004670、DQ223043、DQ223041、DQ223042、GQ180108、EF650480、EF650481、EU004663、EU004672、AY228235、AB601769、AB435515、AB435514、HQ317203、KX987840、KM458057、DQ911368、EF531291、EU854589、EU482058、EU482057、FJ446720、FJ446719)
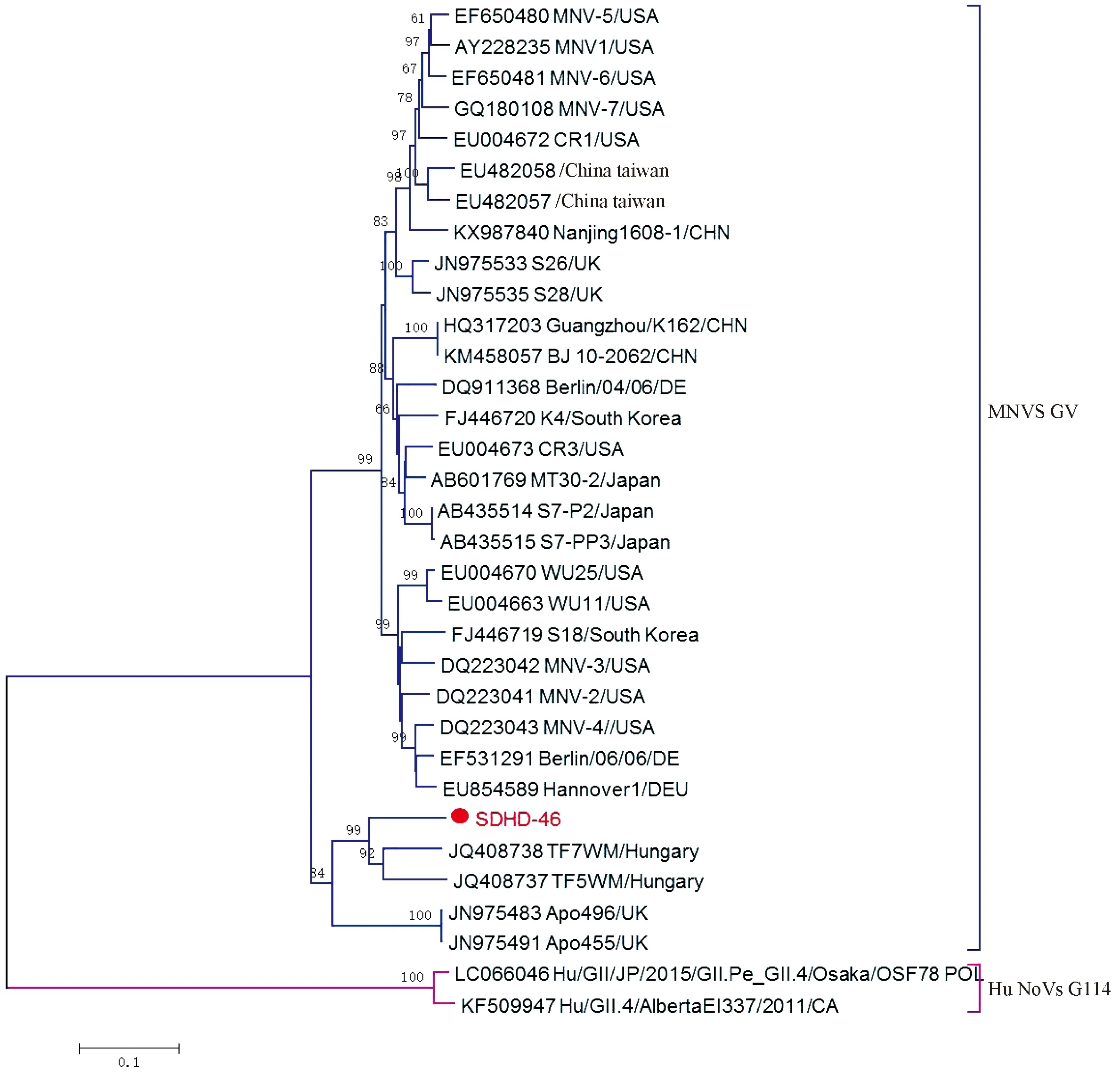
注:红色圆圈代表本实验在野生鼠中的分离株
图1鼠诺如病毒VP1区核苷酸系统进化树
Note:The red circle represents the isolates of SDHD46
Fig.1 Phylogenetic analysis based on the sequences of VP1 gene of MNV
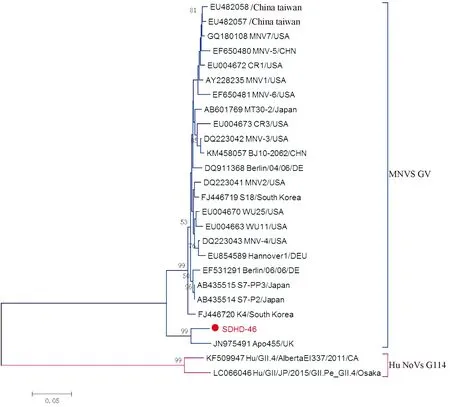
注:红色圆圈代表本实验在野生鼠中的分离株
图2鼠诺如病毒RdRP区氨基酸序列系统进化树
Note:The red circle represents the isolates of SDHD46
Fig.2 Phylogenetic analysis based on the amino acid of RdRP gene of MNVs
3 讨论
自MNV首次被报道以来,国际上已经分离获得多株病毒。MNV是目前已知的小鼠病毒中流行率最高,感染率高,流行范围广的动物病毒[10]。2005年,美国和加拿大的实验室用血清学方法检测实验室MNV的感染率约为22.1%,其感染率约为细小病毒(感染率为2.5%)的9倍[11]。2011年袁文等[12]报道我国广东省实验小鼠携带有MNV,用RT-PCR的方法检测到206份小鼠盲肠内容物,其中MNV阳性为77份,阳性率为37.38%,而且各品系小鼠易感性无显著差异。 MNV在日本的感染率为13.1%[13],在韩国的感染率为15.03%[14]。
本研究分离出的SDHD46是国内分离出的首株野生鼠诺如病毒,SDHD46与已经报道的野生鼠和实验室MNVs的全基因组同源性差异明显(>21.9% nt),其中与野生鼠VP1区同源性差异为(>12.5% nt, >9.4% aa),这表明野生鼠MNV比实验鼠MNV之间存在较高的遗传变异率。同时结合我们分析的SDHD46 P2区的变异位点也说明了野生鼠具有较高的遗传变异性。 Smith报道了MNV在黑线姬鼠中具有较高的感染率和遗传变异率,并且说明了MNV具有久远的感染起源,其感染与种属特异性相关,本研究在收集的6种(褐家鼠、黑线姬鼠、大仓鼠、小家鼠、黄胸鼠和鼩鼱)不同种类的小鼠中,只在黑线姬鼠中检测出两个阳性标本,这与Smith等[6]报道一致。与人类诺如病毒相似,MNV的P2区极易变异且含有特异性抗原决定簇和受体结合位点。有报道称,VP1区氨基酸的突变可能影响其与受体结合的特异性和亲和力,导致MNV毒力的改变[15]。此外,有研究表明,P2亚结构域在病毒产生致死作用中发挥重要作用[16]。如图2所示,SDHD46的氨基酸变异位点主要集中在P2区(278~415aa),而且突变频率高,变异率大,可能影响MNV的相关生物学功能,由基因突变导致的功能变化尚需进一步研究。
人NoVs存在多种传播途径,重组变异率高,而且缺乏持续的免疫力,因此NoVs感染极易形成暴发性肠胃炎,产生严重的公共安全问题。但是由于人NoVs缺少合适的小动物模型和体外细胞培养系统,所以MNV的发现为其研究提供了依据。MNV能够在体外进行生长增值,在骨髓来源的巨噬细胞和树突状细胞上生长并产生细胞病变(CPE),也可以在传达细胞小鼠巨噬细胞系RAW264.7上生长并产生细胞病变[13]。MNV的可复制特点使其成为研究NoVs 复制机制、感染机理、免疫机制和抗感染等方面最理想的病毒模型,研究人员从MNV着手研究NoVs病毒结构蛋白、复制机制等方面都取得了重大进展。本研究中分离出的野生鼠MNV变异株与已知的MNVs具有一定程度的差异,丰富了国内MNV的基因库,通过对该株MNV的基因结构、变异特点和进化来源进行比较分析,为了解国内MNV病毒的分子遗传特征,流行特点和进化来源研究提供了参考依据。
利益冲突:无
参考文献
[1] Schreier E, Döring FKünkel U. Molecular epidemiology of outbreaks of gastroenteritis associated with small round structured viruses in Germany in 1997/98[J]. Arch Virol, 2000,145(3):443-453.
[2] Inouye S, Yamashita K, Yamadera S, et al. Surveillance of viral gastroenteritis in Japan: pediatric cases and outbreak incidents[J]. J Infect Dis, 2000, 181(Supplement2):S270-S274. DOI: 10.1086/315593.
[3] van Der Poel W, Vinjé J, Van der Heide R, et al. Norwalk-like calicivirus genes in farm animals[J]. Emerg Infect Dis, 2000,6(1):36. DOI: 10.3201/ei0601.000106.
[4] Scipioni A, Mauroy A, Vinje J, et al. Animal noroviruses[J]. Veter J, 2008. 178(1):32-45.
[5] Karst SM, Wobus CE, Lay M, et al. STAT1-dependent innate immunity to a Norwalk-like virus[J]. Science, 2003,299(5612):1575-1578.DOI: 10.1126/science.1077905.
[6] Smith DB, McFadden N, Blundell RJ, et al. Diversity of murine norovirus in wild-rodent populations: species-specific associations suggest an ancient divergence[J]. J Gen Virol, 2012,93(Pt 2):259-266. DOI:10.1099/vir.0.036392-0.
[7] Farkas T, Fey B, Keller G, et al. Molecular detection of murine noroviruses in laboratory and wild mice[J]. Vet Microbiol, 2012,160(3-4):463-467. DOI:10.1016/j.vetmic.2012.06.002.
[8] Prasad B, Rothnagel R, Jiang X, et al. Three-dimensional structure of baculovirus-expressed Norwalk virus capsids[J]. J Virol, 1994, 68(8):5117-5125.
[9] Thackray LB, Wobus CE, Chachu KA, et al. Murine noroviruses comprising a single genogroup exhibit biological diversity despite limited sequence divergence[J]. J Virol, 2007,81(19):10460-10473.DOI: 10.1128/JVI.00783-07.
[10] Henderson KS. Murine norovirus, a recently discovered and highly prevalent viral agent of mice[J]. Lab Animal, 2008,37(7):314. DOI: 10.1038/laban708-314.
[11] Gonzalez-Hernandez MJ, Pal A, Gyan KE, et al. Chemical derivatives of a small molecule deubiquitinase inhibitor have antiviral activity against several RNA viruses[J]. PLoS One, 2014,9(4):e94491. DOI: 10.1371/journal.pone.0094491.
[12] 袁文, 张钰, 刘忠华, 等. 广东省实验小鼠自然感染鼠诺如病毒的调查[J]. 中国比较医学杂志, 2010,20(2):78-82.
[13] Goto K, Hayashimoto N, Yasuda M, et al. Molecular detection of murine norovirus from experimentally and spontaneously infected mice[J]. Exp Animals, 2009,58(2):135-140.
[14] Kim M, Lee H, Chang KO, et al. Molecular characterization of murine norovirus isolates from South Korea[J]. Virus Res, 2010,147(1):1-6. DOI: 10.1016/j.virusres.2009.08.013.
[15] Bailey D, Thackray L BGoodfellow IG. A single amino acid substitution in the murine norovirus capsid protein is sufficient for attenuation in vivo[J]. J Virol, 2008,82(15):7725-7728.DOI:10.1128/JVI.00237-08.
[16] Strong DW, Thackray LB, Smith TJ, et al. Protruding domain of capsid protein is necessary and sufficient to determine murine norovirus replication and pathogenesis in vivo[J]. J Virol, 2012,86(6):2950-2958. DOI:10.1128/ JVI.07038-11.

