葡萄WUSCHEL-related homeobox(WOX)家族基因鉴定与分析
王鹏飞,吴新颖,杨立英,王显苏,张倩倩,陈迎春,王珊,慕茜,陈万钧*,王咏梅*(山东省葡萄研究院,山东济南 250100)
与其它果树一样,葡萄有一定的生长发育规律。葡萄的年周期发育包括生长期与休眠期,而这种年周期发育与气候密切相关。在这种周期发育中,葡萄进行萌芽、生长、开花、结果等一系列的生命活动。这些生命活动涉及复杂的生物学过程。例如,葡萄冬芽发生花芽分化,新梢茎顶端分生组织分化出芽、叶片、卷须和花等器官,新梢的伸长,卷须与花的相互转化等,而这些生物学过程都与顶端分生组织相关[1-2]。
WUSCHEL related homeobox(WOX)家族基因是一类含有homeobox结构域,与植物分生组织干细胞维持相关的基因。目前已有很多关于不同植物WOX家族基因鉴定与分析的报道。例如在拟南芥中,研究者发现了WUSCHEL(WUS)基因和WOX1-15基因[3-7]。WOX家族基因的功能涉及分生组织干细胞维持,胚尖-基底极性模式和侧生器官,以及侧生器官的发育[3-7]。此外,一些研究显示,部分WOX基因家族成员可能涉及植物器官的演变。例如川苔草科植物(Podostemaceae)中新梢-叶混合器官的演变[8]。
基于系统发育分析以及在不同植物中的分布,WOX家族基因可以被分为三大组。第一组是现代分支(主要存在在种子植物中),该分支包括WUS、WOX1、WOX2、NS/WOX3、WOX4、WOX5、WOX6以及WOX7类基因;第二组是中间分支(在维管植物中可以被发现,例如石松类植物),包括WOX8、WOX9、WOX11、WOX12以及WOX15类基因;第三组是祖先/基本分支(在维管植物和非维管植物中都可以被发现,例如苔藓和绿藻),包括WOX10、WOX13以及WOX14类基因[8-11]。拟南芥WUS(AtWUS)基因涉及茎尖分生组织的干细胞维持[12]。WOX3类基因涉及叶缘分生组织的干细胞维持[13-14]以及侧生萼片、托叶的发育[4,15-16]。WOX4类基因涉及维管束(形成层分生组织)的干细胞维持[8,17-18]。WOX5类基因在根尖分生组织的干细胞维持中发挥着重要作用[19]。WOX8和WOX9类基因在调控合子发育与胚胎轴形成的过程中功能是冗余的。而有的研究报道,拟南芥WOX9类基因还与茎尖分生组织的调控相关[19]。WOX13类基因被证实涉及植物假隔膜的发育,侧根的形成和花的生长转变[20-21]。
WOX家族基因被报道具有一定的时空特异性表达模式,而这种时空特异性表达被认为与各自的特殊功能相关联[8]。拟南芥WUS(AtWUS)基因特异表达在一个特殊的区域,该区域位于茎尖分生组织的干细胞中心。拟南芥WUS在一个通过CLV3介导的反馈机制维持干细胞的过程中发挥着重要作用,CLV3是一种能够限制茎尖分生组织大小的能与亮氨酸富集重复受体激酶互作的多肽[7,22]。拟南芥WOX4(AtWOX4)在形成层分生组织强烈表达,并在维管束干细胞维持中起到重要作用[17,23]。拟南芥WOX5(AtWOX5)只在根静止中心表达,而根静止中心是被干细胞所包围的一种区域[7,24]。研究表明,拟南芥WOX5对于根尖分生组织的干细胞维持十分关键,其在一个通过CLE40介导的反馈机制维持干细胞的过程中具有重要作用[7,25]。而拟南芥WOX13(AtWOX13)主要在分生组织中表达[21]。因此,WOX家族基因在特定器官和细胞类型中的表达暗示其可能在这些特定器官和细胞中发挥重要作用[26]。
之前的研究报道了葡萄WOX4基因在转化烟草后显著增加了烟草茎原始体结构的数量,暗示其可能有调控干细胞的功能[27]。之前的研究也有对该家族其他成员功能的分析,例如WOX2、WOX3、WOX9、WOX11在体细胞胚发生中的功能[28]。然而对葡萄WOX家族成员的表达模式、蛋白结构、启动子以及进化分析的研究较少。本研究利用葡萄最新版本的基因组数据,从全基因范围鉴定葡萄WOX家族基因并对其表达模式、蛋白结构、启动子、进化中受到的选择压力及密码子使用偏好性进行分析。
1 材料与方法
1.1 序列筛选
葡萄的蛋白、CDs及启动子数据从最新版本葡萄基因组数据库(V2.0)中获得(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/),用于基因组测序的葡萄品种为黑比诺(Vitis vinifera L. CV. Pinot Noir)。我们用拟南芥全部WOX家族基因的编码蛋白进行本地BLASTP(E<0.001),搜索葡萄中全部的WOX蛋白,从而鉴定葡萄WOX家族基因。利用在线软件SMART(http://smart.embl-heidelberg.de/)来确定这些搜索到的蛋白是否具有完整的homeobox结构域,如不含有完整的homeobox结构域则筛除。
1.2 多重序列比对与进化树分析
我们利用Clustal Omega在线软件(http://www.ebi.ac.uk/Tools/msa/clustalo)进行蛋白多重序列比对分析。MEGA6.0软件被用于构建系统发育树,方法为邻接法(Neighbor-Joining tree)。
1.3 保守基序(motif)分析
Multiple Em for Motif Elicitation (MEME) suite 4.11.1(http://meme.nbcr.net/meme/)在线软件被用于分析葡萄WOX蛋白的保守基序(motif)。
1.4 基因表达分析
葡萄WOX家族基因在各个组织中的表达数据来源于前人研究的芯片表达谱。数据收集自Plant Expression Database(http://www.plexdb.org/)数据库以及GEO数据库(http://www.ncbi.nlm.nih.gov/geo/query/)。芯片表达谱结果的RMA-normalized signal intensity value作为标准化的基因表达量。
1.5 启动子分析
PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线软件被用于分析葡萄WOX家族基因启动子的顺式调控元件。
1.6 密码子使用偏好性分析
CodonW1.4软件被用于计算葡萄WOX家族基因的密码子使用偏好性指数。
1.7 选择压力分析
Codeml program under PAML (version 4.7 software)[29]被用于分析葡萄WOX基因家族在进化过程中受到的选择压力。该软件分析包括6个位点模型分析:M0(one ratio)、M1a(neutral)、M2a(positive selection)、M3(discrete)、M7(beta)以及M8(beta and ω)模型[30]。
2 结果与分析
2.1 葡萄WOX家族基因的鉴定与进化树分析
基于葡萄基因组数据库(版本为V2.0)中的蛋白数据库建库,我们利用之前研究报道的拟南芥中发现的16个WOX家族基因编码蛋白序列进行BlastP搜索。又通过SMART软件进一步分析搜索到的蛋白序列是否含有完整的Homeobox结构域,从而筛除假阳性蛋白序列。总共在葡萄中鉴定出11种蛋白。参考拟南芥中同源的WOX蛋白进行命名,分别命名为VvWUS1,VvWOX1,VvWOX2,VvWOX3,VvWOX4,VvWOX5/7,VvWOX8/9,VvWOX10/14,VvWOX11/12,VvWOX13以及VvWOX15(表1)。其中VvWOX8/9和VvWOX15蛋白来源于同一个基因VIT_210s0003g00560。VvWOX8/9由转录本VIT_210s0003g00560.1编码,与拟南芥AtWOX8和AtWOX9的同源性最高,VvWOX15由转录本VIT_210s0003g00560.2编码,与拟南芥AtWOX15的同源性最高。因此,实际上在葡萄中鉴定出10种WOX家族基因。将这10种葡萄WOX家族基因编码的11种蛋白序列与拟南芥中的16种WOX家族基因编码的16个蛋白序列构建系统发育树。结果显示,每个拟南芥中WOX家族基因都与葡萄中同源性最高的基因关系更近,同源性最高的葡萄和拟南芥WOX基因编码的蛋白序列会分到一个小枝中,其编码基因可推测互为直系同源基因。而全部的WOX蛋白序列可以按照系统发育关系分为3个大组。根据拟南芥中的WOX蛋白编码基因名称,发现这3个组完全对应植物WOX家族的现代分支、中间分支以及祖先/基本分支(图1)。
2.2 葡萄WOX家族基因编码蛋白保守基序(motif)的分析
利用MEME软件分析了所有葡萄和拟南芥的WOX蛋白序列。20个保守基序被鉴定(表2)。我们发现,所有葡萄和拟南芥的WOX蛋白序列都含有motif1和motif2。经过进一步分析发现,Motif1和motif2两个结构域的序列包含WOX蛋白的homeobox结构域的序列。除了拟南芥AtWOX15和葡萄VvWOX15,所有中间分支的基因编码的蛋白都含有motif20。而与VvWOX15同一个基因来源的VvWOX8/9序列含有motif20。葡萄VvWOX15和VvWOX8/9含有2个特有的motif——motif8和motif18。所有祖先/基本分支都含有motif10。除了拟南芥AtWOX5,AtWOX7以及葡萄VvWOX5/7外,其他现代分支的WOX蛋白都含有motif7。而葡萄VvWUS1和拟南芥AtWUS1蛋白所含有的motif并不完全一致,这两个蛋白都含有motif1,motif2和motif13,然而拟南芥AtWUS1含有3个motif13,葡萄VvWUS1却只含有1个motif13。
2.3 葡萄WOX家族基因在不同组织中的表达

图1 利用葡萄和拟南芥WOX蛋白构建的系统发育树Figure 1 Phylogenetic tree based on grape and Arabidopsis WOX proteins

表2 葡萄和拟南芥WOX蛋白的最保守基序序列Table 2 Conserved motif sequences of grape and Arabidopsis WOX proteins
利用前人研究的芯片表达谱数据分析葡萄WOX家族基因在各个组织中的表达模式。结果显示,VvWOX3在衰老的叶中表达量最高。VvWUS1在未开的花和花粉中表达,在花粉中表达量最高。在其他组织都不表达。VvWOX13在休眠的冬芽,木质部以及根中表达量较高。VvWOX8/9和VvWOX15的基因在未开的花中表达量最高,在种子、衰老的叶中表达量也较高。VvWOX1在幼叶和雌蕊中表达量较高。VvWOX5/7在成熟的果肉、果皮和衰老的叶中表达量较高。VvWOX4在新梢和卷须中表达量较高。VvWOX10/14在新梢和卷须表达量较高。VvWOX11/12在中度成熟的果皮果肉中表达量最高(图2)。而VvWOX2在各个组织中都不表达。
2.4 葡萄WOX家族基因启动子的顺式作用元件
在线软件P L A N T C A R E I(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)被用于分析葡萄WOX家族基因的启动子序列(起始密码子上游2000bp)。结果显示,VvWOX3启动子含有GCN4_motif(胚乳表达元件),MRE,MBS(MYB转录因子结合元件),RY-element(种子表达元件),Skn-1_motif(胚乳表达元件),TGA-element(生长素诱导元件)。VvWUS1启动子含有GARE-motif(赤霉素诱导元件),GCN4_motif,O2-site(玉米素诱导元件),Skn-1_motif。VvWOX13启动子含有ABRE元件(脱落酸诱导元件),GARE-motif(赤霉素诱导元件),P-box(赤霉素诱导元件),Skn-1_motif。VvWOX8/9和VvWOX15启动子含有ERE(乙烯诱导元件),GCN4_motif,Skn-1_motif,TATC-box(赤霉素诱导元件)。TGA-element。VvWOX1启动子含有ABRE,CAT-box(分生组织表达元件),MRE,MBS,TGA-element。VvWOX5/7含有ERE,GCN4_motif,MBS,Skn-1_motif。VvWOX4含有Skn-1_motif。VvWOX10/14含有AACA_motif (胚乳特异性负调控表达元件),ABRE,ERE,GARE-motif,Skn-1_motif。VvWOX11/12含有AuxRR-core(生长素诱导元件),MBS,Skn-1_motif,TATC-box(赤霉素诱导元件), TGA-element 和P-box(表3)。

图2 葡萄WOX家族基因在不同组织中的表达热图Figure 2 The expression of grape WOX family genes in different tissues
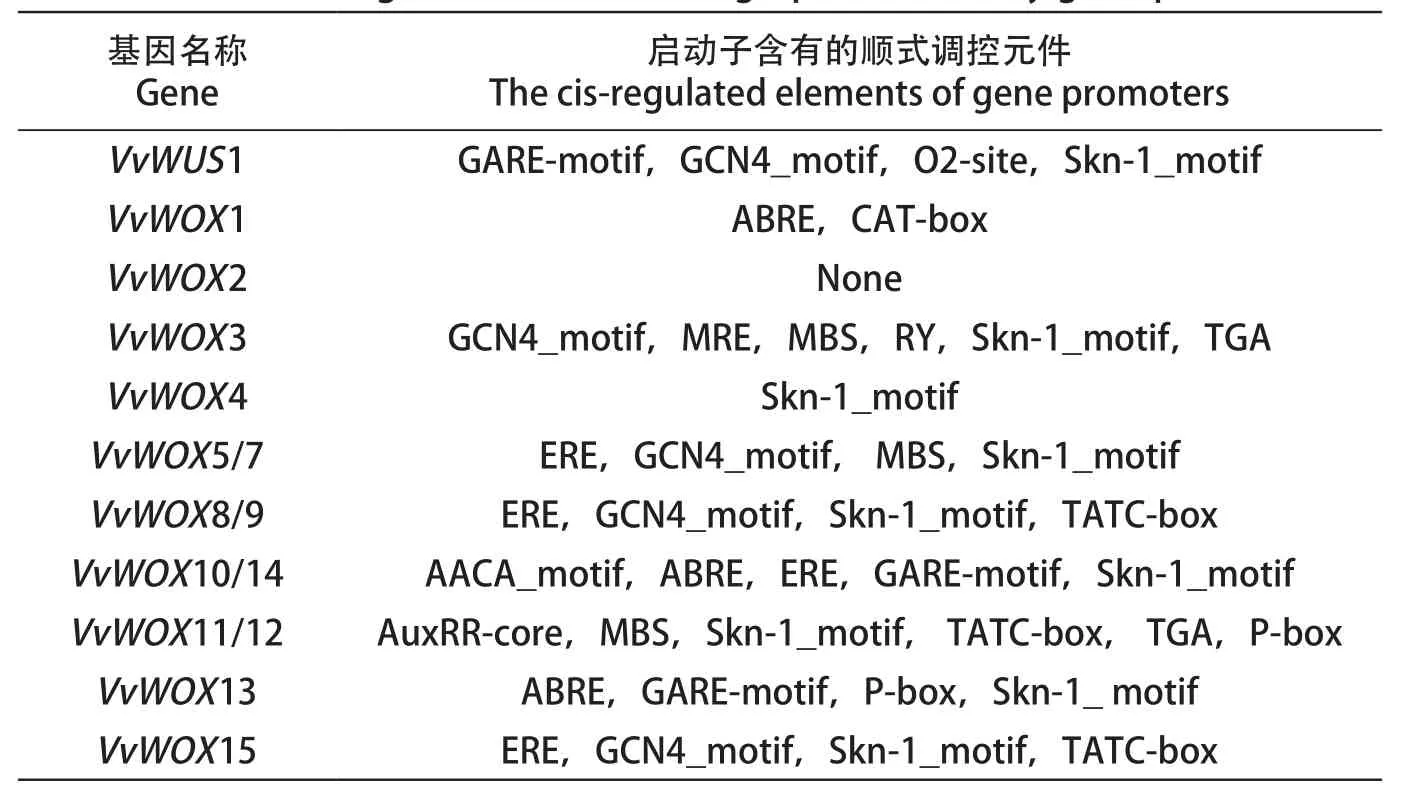
表3 葡萄WOX家族基因启动子含有的顺式调控元件Table 3 The cis-regulated elements of grape WOX family gene promoters
2.5 葡萄WOX家族基因密码子使用偏好性
用CodonW1.4软件计算葡萄WOX家族基因的密码子使用偏好性指数。计算的密码子偏好性指数包括:CBI(密码子偏爱指数)、RSCU(密码子使用相对概率)、CAI(密码子适应指数)以及Fop(最优密码子使用频率)。葡萄WOX家族基因外显子的平均GC含量为48.23%,平均GC3s为47.36%,平均Fop为0.472,平均CAI为0.2177,平均CBI为0.031。而通过分析葡萄WOX家族评价的RSCU发现,葡萄WOX家族存在密码子使用的偏好性。例如,编码酪氨酸(Tyr)密码子UAC的RSCU值为1.37,而编码酪氨酸的密码子UAU的RSCU值为0.63。这说明对于该家族而言,UAC是高频使用的密码子,更被偏好使用。而WOX家族中有的氨基酸没有展示明显的密码子偏好性,例如甘氨酸(Gly)的密码子GGU,GGC和GGA,其RSCU值都是1.05。
为进一步揭示葡萄WOX家族基因密码子使用偏好性及其影响因素,本研究进行了葡萄WOX家族基因CAI、CBI以及Fop与外显子GC含量、外显子GC3s的相关性分析,结果表明,葡萄WOX家族基因的Fop与GC含量著正相关(r=0.5,P<0.01)(图3A)。葡萄WOX家族基因的CBI与GC含量呈正相关(r=0.52,P<0.01)(图3B)。葡萄WOX家族基因的CAI与GC含量呈正相关(r=0.29,P<0.01)(图3C)。葡萄WOX家族基因的Fop与GC3s含量著正相关(r=0.53,P<0.01)(图3D)。葡萄WOX家族基因的CBI与GC3s含量呈正相关(r=0.55,P<0.01)(图3E)。葡萄WOX家族基因的CAI与GC3s含量呈正相关(r=0.4,P<0.01)(图3F)。
2.6 葡萄WOX家族基因受到的选择压力
利用Codeml program under PAML软件中的位点模型去分析各葡萄WOX基因家族在进化中所遭受的选择压力。当该基因家族的Ka/Ksω=1,说明该基因家族在进化中受到中性选择。当基因家族的Ka/Ks(ω)>1,说明该基因家族受到正向选择。当该基因家族的Ka/Ks(ω)<1,说明该基因家族受到纯化选择[28]。我们选取了PAML软件中的M0位点模型来分析WOX基因家族整体受到的选择压力。M0模型结果显示,葡萄WOX基因家族在进化过程中遭遇的是正向选择(ω=1.39794)。我们选择M1、M2、M3、M7与M8位点模型来鉴定正向选择位点。M1与M2比较结果显示,有448个正向选择位点被发现,其中极显著位点(P>99%)包括:104T、172D、173S、179R、208T、236*、305-、349G、353-、354-、355-、360-以及417S。M0与M3模型结果显示,有448个正向选择位点被发现,其中包含极显著位点(P>99%)138个。M7与M8比较结果显示,有448个正向选择位点被发现,其中极显著位点(P>99%)包括:104T、172D、173S、179R、236*、354-以及355-。

图3 3种密码子偏好指数与GC含量与GC3s的相关性分析Figure 3 The correlation analysis between three kinds of codons bias index and GC content and GC3s content
3 讨论与结论
本文鉴定了11种WOX家族基因编码的蛋白。葡萄的WOX基因编码的蛋白与其他高等植物(如拟南芥)一样可以被分为现代分支,中间分支以及祖先/基本分支三个大组。通过用MEME软件分析葡萄WOX蛋白的保守功能motif,发现了20个保守的motif。每个分支都含有保守的分支特异motif,本结果与系统发育树的结果一致,并可推测不同的分支功能可能存在分歧[31]。之前的研究显示,植物WOX家族基因在特定器官和细胞类型中的表达暗示其可能在这些特定器官和细胞中发挥着重要作用[8,26]。通过分析葡萄WOX家族基因在各个组织的表达,发现葡萄WOX家族间表达模式差异较大,部分葡萄WOX家族基因具有组织特异性。例如VvWOX3,其只在葡萄衰老的叶中表达;VvWOX13只在休眠的冬芽、木质部以及根中表达量较高;VvWOX1只在幼叶和雌蕊中表达量较高;VvWOX5/7和VvWOX11/12只在成熟的果肉中表达量最高;VvWOX13只在根中表达,因此推测可能只有VvWOX13与根的发育相关;VvWOX13在木质部表达,其可能与木质部的发育密切相关。
启动子顺式元件的分析结果显示,这些葡萄WOX家族基因的组织特异表达可能与其启动子的顺式调控元件相关。例如,VvWOX8/9和VvWOX15在种子中特异表达,可能与其启动子含有Skn-1_motif元件(胚乳特异性表达元件)相关。通过表达分析,推测VvWOX2可能是假基因。在之前对拟南芥WOX家族基因的研究中,也有假基因的发现[21,26]。通过对葡萄WOX家族基因的密码子使用偏好性的分析,发现葡萄WOX家族基因的部分密码子存在使用偏好性。而葡萄WOX家族基因三种密码子偏好性指数(Fop,CBI和CAI)与GC含量/GC3s呈正相关,表明葡萄WOX家族基因密码子使用偏好性受突变压力影响[32-34]。此外,研究发现葡萄WOX家族在进化历史中主要遭受正向选择,而大量正向选择位点的发现也证实了这个推论。正向选择或正向选择位点可能导致家族成员功能分歧或新功能的出现[32],这个结果与保守功能motif的分析结果相吻合。
[1] 王燕华, 陶磅, 贾克功. 葡萄花芽分化与花器官发育研究进展[J]. 中国果树, 2005(2): 51-52.
[2] 白惠磊. 葡萄卷须及花器官发育机理的研究[D]. 中国农业大学, 2006.
[3] ZHAO Y, HU Y, DAI M, et al. The WUSCHEL-related homeobox gene WOX11 is required to activate shoot-borne crown root development in rice[J]. Plant Cell. 2009, 21(3): 736-748.
[4] LIN H, NIU L, MCHALE NA, et al. Evolutionarily conserved repressive activity of WOX proteins mediates leaf blade outgrowth and floral organ development in plants[J]. PNAS,2013, 110(1): 366-371.
[5] IKEDA M, MITSUDA N, OHME-TAKAGI M. Arabidopsis WUSCHEL is a bifunctional transcription factor that acts as a repressor in stem cell regulation and as an activator in floral patterning[J]. Plant Cell, 2009, 21(11): 3493-3505.
[6] LIE C, KELSOM C, WU X. WOX2 and STIMPY-LIKE/WOX8 promote cotyledon boundary formation in Arabidopsis[J]. Plant Journal, 2012, 72(4): 674-682.
[7] LIU B, WANG L, ZHANG J, et al. WUSCHEL-related Homeobox genes in Populus tomentosa: diversified expression patterns and a functional similarity in adventitious root formation[J]. BMC Genomics, 2014, 15(1): 296.
[8] HEDMAN H, ZHU T, VON ARNOLD S, et al. Analysis of the WUSCHEL-RELATED HOMEOBOX gene family in the conifer picea abies reveals extensive conservation as well as dynamic patterns[J]. BMC Plant Biology, 2013(13):89.
[9] NARDMANN J, REISEWITZ P, WERR W. Discrete shoot and root stem cell-promoting WUS/WOX5 functions are an evolutionary innovation of angiosperms[J]. Molecular Biology &Evolution, 2009, 26(8): 1745-1755.
[10] ZHANG X, ZONG J, LIU J, et al. Genome-wide analysis of WOX gene family in rice, sorghum, maize, Arabidopsis and poplar[J]. Journal of Integrative Plant Biology, 2010, 52(11):1016-1026.
[11] VAN DER GRAAFF E, LAUX T, RENSING S A. The WUS homeobox-containing (WOX) protein family[J]. Genome Biology, 2009, 10(12): 248.
[12] MAYER KF, SCHOOF H, HAECKER A, et al. Role of WUSCHEL in regulating stem cell fate in the Arabidopsis shoot meristem[J]. Cell, 1998, 95(6): 805-815.
[13] SHIMIZU R, JI J B, KELSEY E, et al. Tissue specificity and evolution of meristematic WOX3 function[J]. Plant Physiology,2009, 149(2): 841-850.
[14] NAKATA M, MATSUMOTO N, TSUGEKI R, et al. Roles of the middle domain-specific WUSCHEL-RELATED HO-MEOBOX genes in early development of leaves in Arabidopsis[J]. Plant Cell, 2012, 24(2): 519-535.
[15] NARDMANN J, JI J, WERR W, et al. The maize duplicate genes narrow sheath1 and narrow sheath2 encode a conserved homeobox gene function in a lateral domain of shoot apical meristems[J]. Development, 2004, 131(12): 2827-2839.
[16] MATSUMOTO N, OKADA K. A homeobox gene, PRESSED FLOWER, regulates lateral axis-dependent development of Arabidopsis flowers [J]. Genes Development, 2001, 15(24):3355-3364.
[17] HIRAKAWA Y, KONDO Y, FUKUDA H. TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis[J]. Plant Cell, 2010,22(8): 2618-2629.
[18] JI J, SHIMIZU R, SINHA N, et al. Analyses of WOX4 transgenics provide further evidence for the evolution of the WOX gene family during the regulation of diverse stem cell functions[J]. Plant Signaling & Behavior, 2010, 5(7): 916-920.[19] Wu X, Dabi T, Weigel D. Requirement of homeobox gene STIMPY/WOX9 for Arabidopsis meristem growth and maintenance[J]. Curr Biology, 2005, 15(5): 436-440.
[20] CHANDLER J, NARDMANN J, WERR W. Plant development revolves around axes[J]. Trends in Plant Science, 2008, 13(2):78-84.
[21] ROMERA-BRANCHAT M, RIPOLL J J, YANOFSKY M F, et al.The WOX13 homeobox gene promotes replum formation in the Arabidopsis thaliana fruit[J]. Plant Journal, 2013, 73(1): 37-49.
[22] SCHOOF H, LENHARD M, HAECKER A, et al. The stem cell population of Arabidopsis shoot meristems in maintained by a regulatory loop between the CLAVATA and WUSCHEL genes[J]. Cell, 2000, 100(6): 635-44.
[23] SUER S, AGUSTI J, SANCHEZ P, et al. WOX4 imparts auxin responsiveness to cambium cells in Arabidopsis[J]. Plant Cell,2011, 23(9): 3247-3259.
[24] SARKAR A K, LUIJTEN M, MIYASHIMA S, et al. Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers[J]. Nature, 2007, 446(7137): 811-814.
[25] STAH Y, WINK R H, INGRAM G C, et al. A signaling module controlling the stem cell niche in Arabidopsis root meristem[J].Current Biology Cb, 2009, 19(11): 909-914.
[26] DEVEAUX Y, TOFFANO-NIOCHE C, CLAISSE G, et al.Genes of the most conserved WOX clade in plants affect root and flower development in Arabidopsis[J]. Bmc Evolutionary Biology, 2008, 8(1): 291.
[27] RU D, JIN H, ZENG W, et al. Cloning and characterization of WOX4 gene from Vitis vinifera L. involved in stem cell regulation[J]. Agricultural Science in China, 2011, 10(12): 1861-1871.
[28] Gambino G, Minuto M, Boccacci P, et al. Characterization of expression dynamics of WOX homeodomain transcription factors during somatic embryogenesis in Vitis vinifera[J].Journal of Experimental Botany, 2011, 62(3): 1089-1101.
[29] YANG Z, OCHMAN H, BORK P, et al. PAML 4: phylogenetic analysis by maximum likelihood[J]. Molecular Biology and Evolution, 2007, 24(8): 1586-1591.
[30] YANG Z, NIELSEN R, GOLDMAN N, et al. Codon-substitution models for heterogeneous selection pressure at amino acid sites[J]. Genetics, 2000, 155(1): 431-449.
[31] WANG P, SU L, GAO H, et al. Genome-wide characterization of bHLH genes in grape and analysis of their potential relevance to abiotic stress tolerance and secondary metabolite biosynthesis[J]. Frontiers in Plant Science, 2018(9): 64.
[32] CHEN S L, LEE W, HOTTES A K, et al. Codon usage between genomes is constrained by genome-wide mutational processes.[J]. Proc Natl Acad Sci U S A, 2004, 101(10): 3480-3485.
[33] Knight R D, Freeland S J, Landweber L F. A simplemodel based on mutation and selection explains trends in codon and aminoacid usage and GC composition within and across genomes[J].Genome Biology. 2001, 2(4): research0010.1-research0010.13.
[34] BEISSWANGER S, STEPHAN W. Evidence That strong positive selection drives neofunctionalization in the tandemly duplicated polyhomeotic genes in Drosophila[J]. PNAS, 2008,105(14): 5447-5452.

