光学相干断层成像在颈内动脉系统中的应用进展
刘锐,李敏,朱武生,殷勤,刘新峰
颈内动脉系统供应脑的前循环,由颈内动脉及其分支共同组成。颈内动脉粥样硬化、颈动脉血管炎以及颈内动脉夹层等病变均会导致血管腔狭窄、斑块破裂及继发血栓的形成,继而引起缺血性脑血管病[1-2]。目前,血管腔的狭窄率依然是评价动脉粥样硬化的严重程度和危险程度的重要依据。但临床发现,有的颈内动脉高度狭窄的患者并未出现脑梗死,而很多脑梗死患者的血管狭窄程度并不高。因此,对颈内动脉病变性质的判断,以及颈动脉粥样硬化斑块的组织学特点及成分分析成为评价颈动脉相关的脑梗死危险度的重要手段[3]。
光学相干断层成像(optical coherence tomography,OCT)是分辨率较高的血管图像技术,在冠状动脉系统已得到广泛的应用[4]。本文对OCT技术在颈内动脉系统中的研究进展进行综述,为颈动脉病变性质的判断提供新的思路。
1 OCT成像技术基本原理
OCT成像技术由美国麻省理工学院的Fujimoto教授领导的研究小组,于1991年在Science上首次报道[5]。OCT采用近红外光作为光源,对人体无害。光源发出的光线分为两束,一束称为信号臂,其发射到被测物质,如血管壁;一束称为参考臂,其发射到参照反光镜上。将信号臂与参考臂反射回来的两束光信号叠加,当信号臂与参考臂的长度一致时,就会发生干涉,从而获得高分辨率图像。由于组织性状不同,从组织中反射回来的光信号显示的强弱不同。信号臂的反射光与参考臂的反射光信号叠加,当光波顶点一致时信号增强(干涉增加),当光波顶点方向相反时信号减弱(干涉消减)。由于信号臂和参考臂长度相同时才能产生干涉值,因此可以通过改变反光镜的位置来改变参考臂的长度,继而得到不同深度的组织信号。这些光信号经过计算机处理便可得到组织断层图像[5-6]。OCT所获取的图像无须复杂的数学计算和图像重建。
根据成像工作原理,OCT可以分为时域OCT(time domain OCT,TD-OCT)和频域OCT(frequency domain OCT,FD-OCT)[6-7]。TD-OCT是把在同一时间内从组织中反射回来的光信号叠加、干涉,然后成像。其利用高速旋转的齿轮反光镜来改变参考臂的长度,从而对不同深度的组织进行扫描成像。由于TD-OCT采用的机械移动反光镜的方法速度有限,其对搏动性血管的扫描速度和图像质量均有影响。FD-OCT的参考反光镜固定不动,通过改变光源光波的频率实现信号的干涉。由于取消了机械移动部件,利用电子扫描方式,FD-OCT的扫描成像速度大大提高,信噪比也得到改善。
2 颈动脉系统OCT成像方法
由于颈动脉位置较深,无创的OCT成像技术在判断颈动脉血管内病变时难度较大。Vikramaditya Prabhudesai[8]在2006年应用无创的OCT技术在体外对10例切除后的颈动脉斑块进行检测。通过和病理切片比较发现,在斑块的外表面进行OCT扫描能够清楚识别斑块的钙化、胆固醇结晶、脂质沉积等特点,而对内膜情况以及纤维帽的识别不理想。
Marco Zimarino等[9]于2007年在新西兰兔模型中,应用体内OCT技术对14例颈动脉斑块进行了研究,结果显示体内OCT能够清楚识别Ⅲ型斑块,但对早期的颈动脉粥样硬化的识别度有限。2010年,Shinichi Yoshimura等[10]报道了血管内OCT技术在人体颈动脉系统中的首次应用,在这例个案报道中,研究者应用血管内OCT对一名83岁男性患者的右侧颈内动脉血栓进行扫描,认为血管内OCT在颈动脉血栓形成的判断以及指导后续治疗中具有重要应用价值。由于OCT发出的近红外线不能透过血液,不透明的血液会对OCT的光学信号造成衰减,无法清晰显示血管壁的结构改变。因此,颈动脉血管内OCT成像的图像质量与血管内血液的清除程度有着密切的关系。在这项研究中,为了避免血液干扰,获取清晰图像,采用了血管近端球囊阻断血流的方法,该方法在一定程度上增加了手术风险[10]。
为了评价OCT技术在颈动脉支架置入术(carotid artery stenting,CAS)过程中的安全性,Carlo Setacci等[11]于2012年采用非血管阻塞技术,对25例患者进行了研究。这项研究使用的设备为C7XR FD-OCT系统(LightLab Imaging Inc.)。为了获得清晰图像,研究者采用血管冲洗的方法来减少血液对图像采集的干扰。研究所用的颈动脉冲洗方案是通过8F导管,将浓度为50%造影剂,以6 ml/s速度,750 psi压力,总量为24 ml进行高压团注。与之不同的是,Michael R Jones等[12]针对症状性颈动脉狭窄和非症状性颈动脉狭窄患者的OCT图像进行了对比研究。在该研究中,颈动脉冲洗方案是采用100%造影剂,以8 ml/s速度,总量为15 ml,高压团注,压力设定为200 psi;或者采用100%造影剂,总量25 ml,用30 ml注射器手动注射,5 s内注射完毕;也可采用肝素化生理盐水,总量50 ml,用60 ml注射器手动注射,5 s内注射完成。因此,目前尚无标准的血管冲洗方案。
南京军区南京总医院神经内科研究小组在2015年报道了基于OCT观察颈动脉脂质斑块对支架贴壁情况的影响[13]。在该研究中,课题组详细介绍了血管内OCT在颈动脉系统中的操作程序(图1):取颈动脉侧位造影,并经由导引导管将微导丝远端置于C1段以远。根据患者血管病变情况,必要时,将脑保护装置(伞)置于C1段远段。冲洗并连接OCT成像导管后,将OCT成像导管送入0.014 in导丝。OCT成像导管的定位取决于造影狭窄的位置。由于两个Marker间距离20 mm,光学透镜在近端Marker的近端约5 mm,因此要求近端Marker需过病变10 mm。为了取得良好的血液冲洗效果,使导管与所检测血管的病变部位同轴,适当使指引导管口接近病变近端。在确认获得图像清晰有效后,撤出OCT成像导管;若图像不满意,重复成像,但应注意造影剂的使用总量。术后通过Off-line Review Software,version C.0.2;St. Jude Medical对图像进行线下分析(图2)。
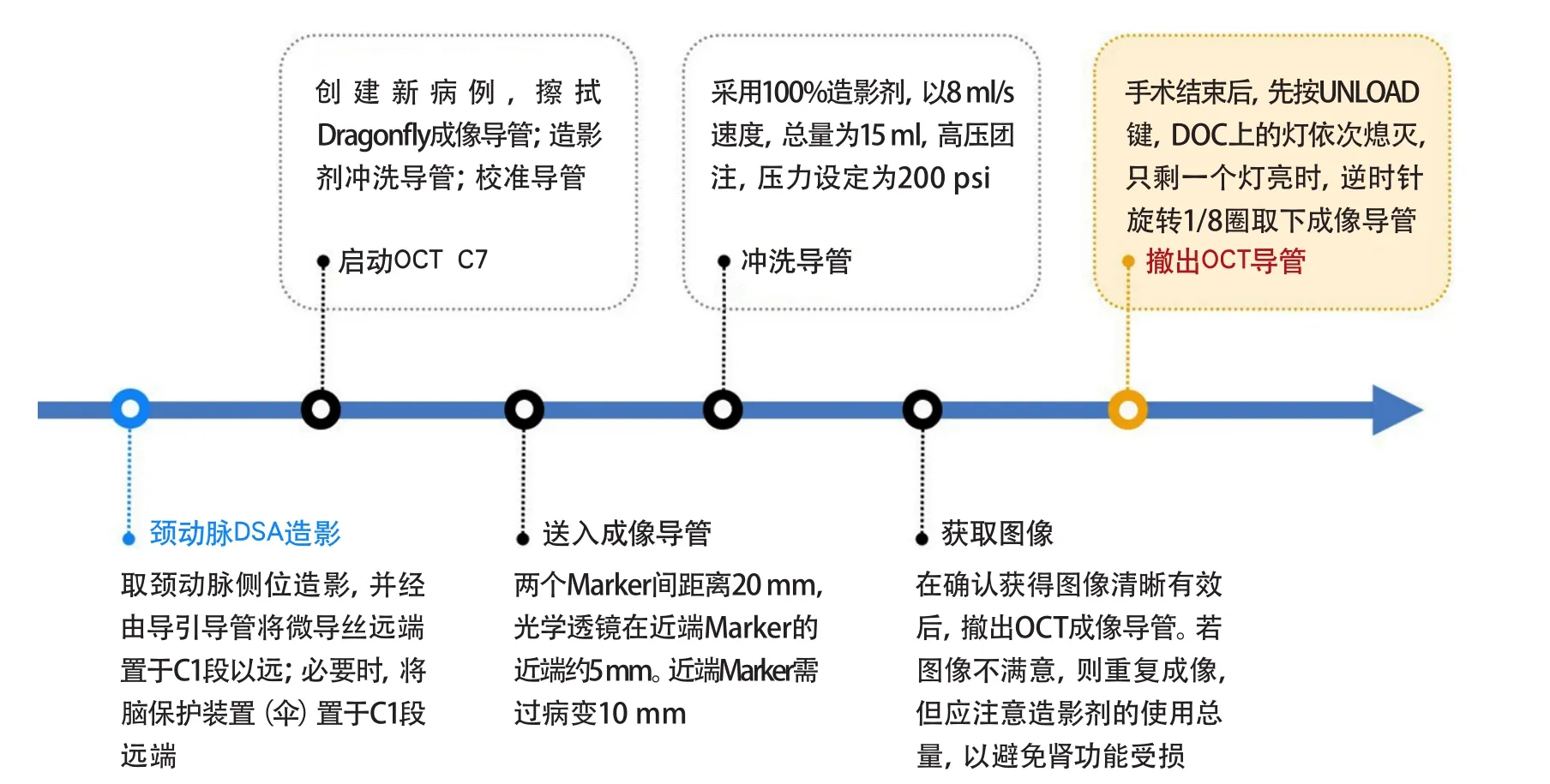
图1 血管内光学相干断层成像技术在颈动脉系统中应用流程
图2 光学相干断层成像的图像分析软件Off-line Review Software,version C.0.2;St. Jude Medical操作界面
3 OCT对颈动脉病变的评价方法
对于动脉粥样硬化斑块,OCT的图像评价标准多来源于其在冠状动脉中的应用[14]。通过冠状动脉粥样硬化斑块的研究发现,OCT对于脂质斑块的诊断具有较高的敏感性(90%)和特异性(92%)[15]。在OCT图像上,脂质斑块多表现为边界不清晰的低信号区,纤维帽表现为均一的高信号区。由于OCT的最小分辨率为10 μm,能够精确地测量斑块纤维帽的厚度。OCT可以显现和量化粥样斑块中的巨噬细胞成分,判断炎性细胞局限于纤维帽还是斑块之中,并对斑块进行危险分层,进一步识别易损斑块[16]。在OCT图像上,易损斑块组织特点包括大的脂质核心、薄纤维帽(<65 μm)以及靠近纤维帽的巨噬细胞聚集。纤维斑块较为稳定,表现为均一的高信号区。混合型斑块在OCT图像上表现为不同信号区域共存,由不同均质成分混合而成,包括脂质成分、纤维成分、钙化、斑块破裂以及血栓。钙化斑块则表现为边界清晰、均一的低信号带,与脂质斑块的OCT图像的区别是脂质斑块纤维帽的高信号区与脂质核的低信号区边界模糊不清,而钙化斑块的边界较为清晰[4,8](图3)。

图3 应用血管内光学相干断层成像观察到的常见的颈动脉病变及颈动脉支架置入术后表现
同样,在颈动脉系统中,通过OCT检查技术,可以对动脉粥样硬化斑块中的脂质斑块、纤维性斑块、混合型斑块和钙化斑块进行分析。研究证实,OCT技术可对颈动脉狭窄患者的血管狭窄程度进行分析。症状性颈动脉狭窄患者的复杂型斑块发生率较非症状性患者高。Ⅵ型斑块(即复杂病变,斑块内可见血肿、出血或血栓)、巨噬细胞浸润是颈动脉狭窄患者症状发生的独立危险因素[12]。
此外,颈动脉夹层也是较为多见的颈动脉病变。OCT对颈动脉夹层的诊断敏感性较高,可以发现血管内的微小夹层。在OCT图像上,夹层表现为内膜出现不连续,可撕裂至中膜[17-18]。颈动脉血栓形成也是导致颈动脉狭窄的重要原因。斑块破裂后可继发血栓形成,按照血栓的组成可分为白色血栓和红色血栓。白色血栓主要由血小板聚集体和白细胞组成,红色血栓主要由纤维蛋白和红细胞组成。在OCT图像上,红色血栓主要表现为向动脉管腔内突出的单信号高位反向散射投影,而白色血栓则被确定为低位的投影。通过信号强度曲线对红白血栓的区分有着90%的敏感性和88%的特异性[10,19-20]。
4 OCT在颈动脉支架置入过程中的应用
在新西兰兔模型中,在颈总动脉支架释放以后,应用OCT可以获取血管横断面图像,并清晰显示支架支撑杆[21]。和病理切片比较发现,支架支撑杆的识别率为93.7%。在支架置入后血管内膜覆盖厚度的识别上,OCT图像测量值(0.135 mm,标准差=0.079)与病理切片测量值(0.145 mm,标准差=0.085)相似且密切相关(r=0.85,P<0.001)。目前,在CAS过程中,可以在术前对颈动脉病变性质进行评估,在术后对支架释放情况进行评估。颈动脉支架置入过程中,由于受到数字减影血管造影(digital subtraction angiography,DSA)二维平面成像的局限性,难以对支架的释放情况、支架与血管内膜之间的关系进行直观评估。OCT所采用的近红外线光源,不能透过含有金属的支架支撑杆,因此支架支撑杆在图像上表现为支架内壁反射产生的高亮度散乱光,支架支撑杆背面有反射阴影。OCT图像的高分辨率使CAS后的支架贴壁不良、支架扩张不全、内膜组织脱垂等常见情况得以清晰呈现[11,13]。
支架贴壁不良是指支架支撑杆与血管壁之间的分离,可引起局部血流涡流,增加亚急性血栓的风险[22]。支架贴壁不良也可以延迟损伤血管的愈合过程,导致后期血栓形成。OCT图像可以通过测量支架支撑杆的中间部位离血管壁的距离来判断支架贴壁是否良好。研究认为,根据颈动脉支架的支撑杆的厚度,支架贴壁良好时,支撑杆与管壁之间的距离为10~200 μm;支架贴壁不良时,支撑杆与管壁之间的距离>200 μm;支架内陷时,支架支撑杆的整个厚度陷入血管内膜,支撑杆与管壁之间的距离<10 μm[11,13]。
支架扩张情况可以有不同表现类型,主要包括充分扩张、不完全扩张、不对称扩张或过度扩张。支架扩张不全常常发生在血管有纤维钙化斑块或钙化斑块区域。在OCT图像分析过程中,通常将支架支撑杆之间的距离>200%时定义为支架分布不规则,支架不对称扩张[11]。在CAS过程中,常见的与支架有关的血管损伤主要有组织脱垂纤维帽或内膜损伤。组织脱垂为组织突入至支架间隙,进入血管腔内或与相邻支架支撑杆连接。当斑块表面的内膜连续性遭到破坏时,可认为出现纤维帽破损[23]。
在CAS过程中,OCT可以识别术后的支架内急性血栓形成[24](图3)。在CAS的术后随访中,OCT检查可以进一步评价CAS术后内膜覆盖情况。如果支架支撑杆表面内膜增殖少,OCT可以见到支架支撑杆表面有一薄层的内膜覆盖。如果支架支撑杆表面内膜增殖明显,所覆盖的内膜组织大多表现为均匀光亮的组织(图3)。
5 前景与展望
目前,血管内OCT技术的应用多在脑血管介入诊疗的过程中同时开展。随着OCT技术的不断提高,其获取的图像越来越清晰,能够获得的病变信息越来越多。虽然血管内OCT检查对术者有一定的操作技能要求,但其操作步骤和其他血管内治疗技术相比并不复杂,也不会增加过多的操作时间。OCT可在介入手术中轻松并入,术者无须接受较多的附加培训。这使得OCT技术在颈内动脉系统的应用有着广阔的前景。
在颈动脉血运重建内膜剥脱术对比支架置入术的随机临床试验(Carotid Revascularization Endarterectomy versus Stenting Trial,CREST)研究中,颈动脉病变性质的评估主要依赖血管造影图像,能够获得病变信息较为有限,不能对斑块或其他病变的性质进一步评估判断[25]。在今后的临床研究中,通过OCT技术可以在CAS术前对患者的病变情况详细评估,预测支架释放后对病变的影响,选择出更适合行CAS的患者,从而降低CAS手术并发症。不同的病变特征与不同类型颈动脉支架之间的关系会有所区别,例如,对于脂质斑块而言,闭环支架导致的斑块脱垂的可能性会相对较小。而CAS后血管结构的变化与患者的临床预后的关系尚不清楚,因此在今后可以基于OCT技术,设计临床试验,进一步探讨CAS后血管结构的变化与患者临床预后之间的关系。CAS术后内膜过度增厚是颈动脉支架后血管再狭窄的常见原因,OCT可以在术后复查中对支架内再狭窄患者的内膜厚度进行精确测量,结合患者的临床特征,对支架内再狭窄的病理机制和预防治疗进行探讨。随着支架工艺的升级,会有一些新型颈动脉支架不断上市。通过OCT技术可以在研发阶段,对新型支架在血管内的细节表现进行观察记录,为后期临床试验积累资料。此外,对于血管炎等颈动脉病变,应用OCT技术可以获得更多的病变信息,并能指导临床治疗。
目前血管内OCT技术在颈动脉系统中的应用还有一些不足,主要包括:成像导管较为昂贵,不能在临床广泛推广;成像效果对血管要求较高,对于颈动脉较粗的患者,血液冲洗不够充分,成像范围有限,图像质量较差;扫描范围较为有限,目前仅能在颈动脉起始部约5 cm的范围内进行扫描,较长病变的图像不能完全获取。但OCT技术本身也在不断发展,图像扫描速度和成像质量都会进一步提高。在动物实验中,新型的FD-OCT可以获得100 000~200 000 axial scans/s的扫描速度[26]。今后的血管内OCT可以每秒获得200帧图像,这可以缩短操作时间,扫描更长的病变,获得更多的图像信息。此外,应用后期图像处理软件,可以基于OCT轴位图像重建3D图像,更加充分地展示血管内病变结构,并通过数学运算,获取脑血管血流储备分数[27]。此外,可以依据大量的图像特征,借助人工智能技术,对动脉粥样硬化斑块性质以及其他常见颈动脉病变进行自动识别,辅助临床诊断。
综上,血管内OCT技术可以在颈动脉系统中得以应用。通过OCT技术可以获取高分辨率图像,继而对颈动脉病变进行详细评估。在颈动脉支架置入过程中应用OCT技术可以对支架的释放情况和释放后的血管结构变化进行评估。随着OCT技术的发展,其在颈动脉系统中的应用有着较为广阔的前景。
参考文献
[1]高峰,杜彬,秦海强,等. 2007年颈动脉支架成形术专家共识[J]. 中国卒中杂志,2007,2(5):434-458.
[2]王琳,赵性泉. 颈动脉粥样硬化斑块高分辨磁共振成像与脑梗死[J]. 中国卒中杂志,2013,8(3):221-225.
[3]MONO M L,KARAMESHEV A,SLOTBOOM J,et al. Plaque characteristics of asymptomatic carotid stenosis and risk of stroke[J]. Cerebrovasc Dis,2012,34(5-6):343-350.
[4]JANG I K,TEARNEY G J,MACNEILL B,et al.In vivo characterization of coronary atherosclerotic plaque by use of optical coherence tomography[J].Circulation,2005,111(12):1551-1555.
[5]HUANG D,SWANSON E A,LIN C P,et al.Optical coherence tomography[J]. Science,1991,254(5035):1178-1181.
[6]LOW A F,TEARNEY G J,BOUMA B E,et al.Technology Insight:optical coherence tomography--current status and future development[J]. Nat Clin Pract Cardiovasc Med,2006,3(3):154-162,172.
[7]TAKARADA S,IMANISHI T,LIU Y,et al.Advantage of next-generation frequency-domain optical coherence tomography compared with conventional time-domain system in the assessment of coronary lesion[J]. Catheter Cardiovasc Interv,2010,75(2):202-206.
[8]PRABHUDESAI V,PHELAN C,YANG Y,et al.The potential role of optical coherence tomography in the evaluation of vulnerable carotid atheromatous plaques:a pilot study[J]. Cardiovasc Intervent Radiol,2006,29(6):1039-1045.
[9]ZIMARINO M,PRATI F,STABILE E,et al. Optical coherence tomography accurately identifies intermediate atherosclerotic lesions--an in vivo evaluation in the rabbit carotid artery[J].Atherosclerosis,2007,193(1):94-101.
[10]YOSHIMURA S,KAWASAKI M,HATTORI A,et al. Demonstration of intraluminal thrombus in the carotid artery by optical coherence tomography:technical case report[J/OL]. Neurosurgery,2010,67(3 Suppl):E305. http://dx.doi.org/10.1227/01.NEU.0000383749.76915.3C.
[11]SETACCI C,DE DONATO G,SETACCI F,et al. Safety and feasibility of intravascular optical coherence tomography using a nonocclusive technique to evaluate carotid plaques before and after stent deployment[J]. J Endovasc Ther,2012,19(3):303-311.
[12]JONES M R,ATTIZZANI G F,GIVEN C A 2ND,et al. Intravascular frequency-domain optical coherence tomography assessment of carotid artery disease in symptomatic and asymptomatic patients[J].JACC Cardiovasc Interv,2014,7(6):674-684.
[13]LIU R,JIANG Y,XIONG Y,et al. An Optical Coherence Tomography Assessment of Stent Strut Apposition Based on the Presence of Lipid-Rich Plaque in the Carotid Artery[J]. J Endovasc Ther,2015,22(6):942-949.
[14]LOWE H C,NARULA J,FUJIMOTO J G,et al. Intracoronary optical diagnostics current status,limitations,and potential[J]. JACC Cardiovasc Interv,2011,4(12):1257-1270.
[15]MACNEILL B D,JANG I K,BOUMA B E,et al.Focal and multi-focal plaque macrophage distributions in patients with acute and stable presentations of coronary artery disease[J]. J Am Coll Cardiol,2004,44(5):972-979.
[16]DIAZ-SANDOVAL L J,BOUMA B E,TEARNEY G J,et al. Optical coherence tomography as a tool for percutaneous coronary interventions[J]. Catheter Cardiovasc Interv,2005,65(4):492-496.
[17]CHAMIÉ D,BEZERRA H G,ATTIZZANI G F,et al. Incidence,predictors,morphological characteristics,and clinical outcomes of stent edge dissections detected by optical coherence tomography[J]. JACC Cardiovasc Interv,2013,6(8):800-813.
[18]YUMOTO K,SASAKI H,AOKI H,et al.Successful treatment of spontaneous coronary artery dissection with cutting balloon angioplasty as evaluated with optical coherence tomography[J].JACC Cardiovasc Interv,2014,7(7):817-819.
[19]OTAKE H,SHITE J,AKO J,et al. Local determinants of thrombus formation following sirolimus-eluting stent implantation assessed by optical coherence tomography[J]. JACC Cardiovasc Interv,2009,2(5):459-466.
[20]ALFONSO F,CUESTA J,BASTANTE T,et al.Calcified nodule mimicking red thrombus on optical coherence tomography[J]. JACC Cardiovasc Interv,2015,8(1 Pt A):120-121.
[21]PRATI F,ZIMARINO M,STABILE E,et al. Does optical coherence tomography identify arterial healing after stenting? An in vivo comparison with histology,in a rabbit carotid model[J]. Heart,2008,94(2):217-221.
[22]FOIN N,LU S,NG J,et al. Stent malapposition and the risk of stent thrombosis:mechanistic insights from an in vitro model[J/OL]. EuroIntervention,2017,13(9):e1096-e1098. http://doi.org/10.4244/EIJ-D-17-00381.
[23]DE DONATO G,SETACCI F,SIRIGNANO P,et al. Optical coherence tomography after carotid stenting:rate of stent malapposition,plaque prolapse and fibrous cap rupture according to stent design[J].Eur J Vasc Endovasc Surg,2013,45(6):579-587.
[24]郭志良,姜永军,俞书红,等. 应用光学相关断层成像快速诊断颈动脉支架内血栓一例[C]. 中华医学会第十八次全国神经病学学术会议论文汇编(上). 北京:中华医学会,2015.
[25]MOORE W S,POPMA J J,ROUBIN G S,et al.Carotid angiographic characteristics in the CREST trial were major contributors to periprocedural stroke and death differences between carotid artery stenting and carotid endarterectomy[J]. J Vasc Surg,2016,63(4):851-858.
[26]WIESER W,BIEDERMANN B R,KLEIN T,et al. Multi-megahertz OCT:High quality 3D imaging at 20 million A-scans and 4. 5 GVoxels per second[J].Opt Express,2010,18(14):14685-14704.
[27]FRANCAVIGLIA B,CAPRANZANO P,GARGIULO G,et al. Usefulness of 3D OCT to diagnose a noncircumferential open-cell stent fracture[J]. JACC Cardiovasc Imaging,2016,9(2):210-211.

