乌头碱对肝癌MHCC97 细胞生长、侵袭和迁移的调控作用及机制研究①
熊慧生 蒋 参 高 瑞 陈丽华
(重庆市肿瘤研究所中医肿瘤科,重庆 400030)
肝癌是临床常见的恶性肿瘤之一,其发病率仅次于肺癌和胃癌[1,2]。手术切除是目前治疗肝癌的最佳方法,但由于肝癌早期没有明显症状且具有较高转移率,导致仅有10%~20%的患者适合手术[3-5]。因此,提高肝癌诊断水平及寻找抑制肝癌细胞转移的药物是治疗肝癌的关键。乌头碱是乌头、附子等的主要活性成分,具有较强的抗炎和镇痛活性,但由于乌头碱具有较强的毒性而限制了其应用[6,7]。现代研究表明适量的乌头碱能明显减轻癌症患者的疼痛,并且还能减少吗啡类镇痛药的用药量,延长作用时间,尤其适用于消化系统癌症[8,9]。此外,乌头碱还能抑制艾氏癌、黑色素瘤和胰腺癌等癌细胞增殖,诱导细胞凋亡[7,10,11]。川乌水提物还能降低肝癌细胞活性[12]。但乌头碱对肝癌细胞生长及侵袭迁移能力的影响及作用机制还未见报道。本文将以人肝癌细胞株MHCC97为对象,探讨不同浓度乌头碱对肝癌细胞生长、侵袭和迁移的作用,并初步探究其作用机制。
1 材料与方法
1.1材料
1.1.1试验药物 乌头碱购自北纳创联研究院,分子式为C34H47NO11,分子量为645.74,纯度≥98%。使用时用DMSO助溶,临用前用细胞培养液稀释为实验所需浓度,DMSO浓度不超过0.1%。
1.1.2细胞 人肝癌细胞系MHCC97购自美国ATCC公司,用含10%胎牛血清的DMEM培养液培养,培养条件为5%CO2,37℃。每两天换液一次。
1.1.3试剂 特级胎牛血清(货号:12664025)、DMEM培养液(货号:12491-015)购自美国Gibco公司。MTT试剂盒、BCA试剂盒购自碧云天生物技术公司。Matrigel购自美国BD公司。P38、p-P38、p-AMPKAPK和p-HSP27一抗均购自美国Millipore公司。HRP标记二抗购自美国Santa Cruz公司。
1.1.4仪器 MK3酶标仪购自美国ThermoFisher公司;垂直电泳槽、半干转膜仪和凝胶成像系统购自美国Bio-Rad公司。
1.2方法
1.2.1MTT检测细胞增殖 将细胞传代培养于96孔板中,培养24 h后,分别用0.1、0.2、0.4、0.8、 2、5、10、20、40、80、200和400 μg/ml的乌头碱处理细胞24 h,每组3个复孔。24 h后根据MTT试剂盒说明书检测细胞活性。根据预实验结果,将细胞分为MHCC97组、乌头碱5 μg/ml组、10 μg/ml组和20 μg/ml组,每组6个复孔。乌头碱 5 μg/ml组、10 μg/ml组和20 μg/ml组分别用5 μg/ml、10 μg/ml和20 μg/ml乌头碱处理细胞,MHCC97组加入等量溶媒,于第0、1、2、3和4天用MTT法检测细胞增殖情况。
1.2.2Transwell检测细胞侵袭能力 实验前1天用Matrigel包被Transwell小室。将预冷的Matrigel取出后,迅速加入到Transwell小室底部,避免气泡产生,于37℃放置30 min,待Matrigel凝固后,放置于无菌环境备用。第2天将细胞接种于小室上层,用含有不同浓度乌头碱的无血清培养液培养,小室下层加入正常培养液,24 h后刮去上层细胞,下层细胞用结晶紫染色并计数统计。
1.2.3划痕实验检测细胞迁移能力 实验前一天用Marker笔于12孔板背面划五条平行直线,消毒灭菌后置于超净工作台备用。将细胞以5×105个/ml的密度传代培养于预先准备的12孔板中,培养24 h后,用10 μl枪头垂直于培养板背面的五条横线划痕,用预冷的PBS洗涤4次后,加入含不同浓度乌头碱(5、10、20 μg/ml)的无血清培养液进行培养,每组3个复孔。分别于处理后的第0 h和24 h拍照记录,每孔随机选取5个视野进行统计。
1.2.4Western blot检测蛋白表达 用RIPA裂解液提取各组细胞蛋白,用BCA试剂盒对每组细胞总蛋白浓度进行定量分析并调平。用10%SDS-PAGE分离蛋白并转移蛋白至PVDF膜。用5%脱脂牛奶室温封闭膜2 h,加入适宜浓度一抗(P38,1∶1 500;p-P38,1∶1 000;p-MAPKAPK,1∶1 000;p-HSP27,1∶1 000)4℃封闭过夜,第2天用缓冲液清洗PVDF膜3次,加入HRP标记二抗室温封闭1 h后,滴加化学发光液,用凝胶成像系统采集图像,Image J软件进行灰度值分析。以GAPDH为内参。
2 结果
2.1乌头碱对肝癌细胞生长的影响 预实验结果表明,当乌头碱浓度达到50 μg/ml及以上时,MHCC97细胞活性明显被抑制,表明高浓度乌头碱对MHCC97细胞具有细胞毒性(图1),因此选择5、10和20 μg/ml三个浓度进行后续实验。与MHCC97组比较,乌头碱作用4 d后,10 μg/ml组和20 μg/ml组细胞生长速度均明显降低(图2),提示乌头碱可抑制肝癌细胞增殖。
2.2乌头碱对肝癌细胞侵袭能力的影响 Transwell实验结果表明,乌头碱处理细胞24 h后,10 μg/ml组和20 μg/ml组侵袭细胞总数明显减少,与MHCC97组比较,差异具有统计学意义(图3),提示乌头碱能减弱肝癌细胞的侵袭能力。
2.3乌头碱对肝癌细胞迁移能力的影响 用不同浓度乌头碱处理细胞24 h后,乌头碱 5 μg/ml组、10 μg/ml组和20 μg/ml组划痕愈合率明显低于MHCC97(图4),且具有量效关系。表明乌头碱能抑制肝癌细胞迁移。
2.4乌头碱对P38MAPK信号通路的影响 与MH-CC97组比较,乌头碱 5 μg/ml组、10 μg/ml组和20 μg/ml组通路蛋白p-P38蛋白表达水平降低,p-P38/P38比值明显降低;同时,各受试物组P38/MAPK信号通路下游蛋白p-MAPKAPK和p-HSP27的蛋白表达水平与MHCC97组比较也明显降低(图5),且体现出量效关系。提示乌头碱能抑制P38/MAPK信号通路激活。

图1 乌头碱对肝癌细胞存活率的影响Fig.1 Effect of aconitine on cell viabilityNote:A.Structure of aconitine;B.Treated MHCC97 cells with aconitine at different concentrations for 24 h,and MTT asaay was performed for cell viability.

图2 乌头碱对肝癌细胞增殖的影响Fig.2 Effect of aconitine on cell proliferation of hepatoma carcinomaNote:Cells were divided to MHCC97 group,5 μg/ml group,10 μg/ml group and 20 μg/ml and treated with acontinefor 0 d,1 d,2 d,3 d and 4 d respectively,cell viability was detected by MTT assay.n=6.Vs MHCC97 group,*.P<0.05.

图3 乌头碱对肝癌细胞侵袭能力的影响Fig.3 Effect of aconitine on invasion of hepatoma carcinoma cellsNote:The invasion viability of hepatoma carcinoma cells were measured by Transwell.The experience was repeated at least three times.n=3.Vs MHCC97 group,*.P<0.05.

图4 乌头碱对肝癌细胞迁移能力的影响Fig.4 Effect of aconitine on cell viability of migration of hepatoma carcinoma cellsNote:Wound healing assay was employed for detecting viability of migration of hepatoma carcinoma cells.Vs MHCC97 group,*.P<0.05.
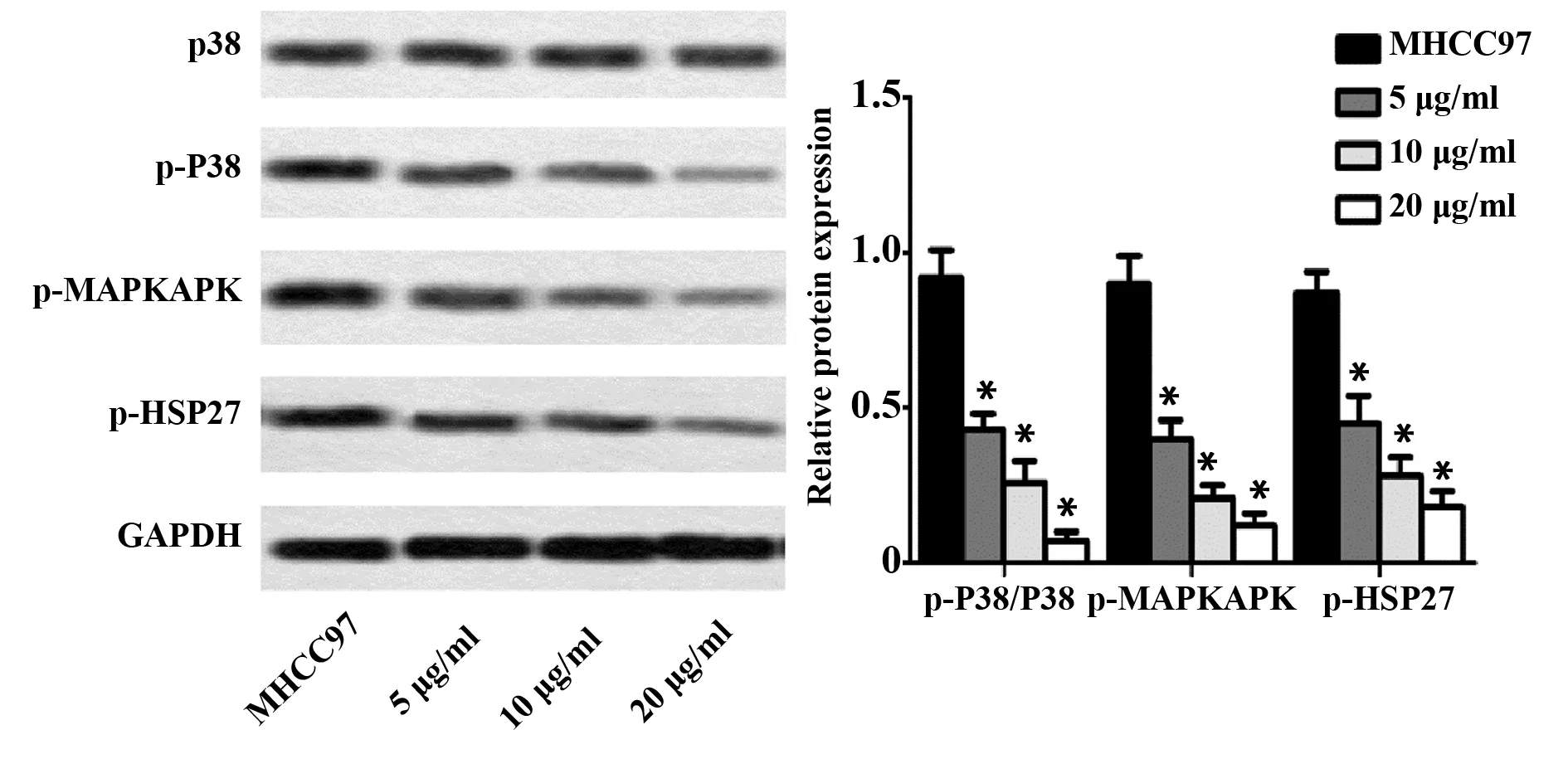
图5 乌头碱对P38MAPK信号通路的影响Fig.5 Effect of aconitne on P38 MAPK signaing pathwayNote:The protein levels of p-P38,P38,p-MAPKAPK and p-HSP27.Vs MHCC97 group,*.P<0.05.
3 讨论
肝癌是临床常见的恶性肿瘤,具有高死亡率和高转移率的特点[13]。临床数据表明,肝癌患者确诊后的生存期仅有6~20个月,肝癌每年的新发病例超过500 000人[14,15]。目前,对于肝癌的治疗方法主要包括手术切除、肝移植及化疗等,但由于化疗药物具有较大的副作用而限制了其应用[16]。因此寻找新的抗肝癌药物及方法成为国内外研究的热点。
乌头碱是一类乌头类生物碱,能够调控细胞膜上的电压依赖性钠离子通道的开放,兴奋迷走神经,还可通过诱导神经毒素的释放,对周围神经造成损伤[17-19]。但其也具有多种药理学活性,如抗炎、免疫抑制及镇痛等[20]。目前,乌头碱常被应用于缓解晚期癌症患者的疼痛,以改善癌症患者的生活质量[8]。研究表明,乌头碱对一些癌细胞的生长具有一定的抑制作用。Ji等[7]的研究表明,乌头碱可通过抑制NF-κB信号通路的激活抑制胰腺癌细胞增殖并诱导癌细胞凋亡,还可通过调控PI3K/AKT通路抑制黑色素瘤细胞的增殖。此外,乌头碱还可增强二氯乙酸盐的抗癌活性[10]。本文研究结果表明,乌头碱能明显抑制肝癌细胞MHCC97的细胞活性,降低MHCC97细胞的生长速度,提示其具有一定的抗肝癌活性。
研究表明,90%的癌症死亡都是由癌细胞转移引起的[21]。因此,有效抑制癌细胞的侵袭和迁移能力是降低癌症死亡率的关键。Guo等[22]研究发现,乌头碱可降低乳腺癌细胞的侵袭活性。但目前还没有研究报道表明乌头碱能明显影响肝癌细胞的侵袭迁移能力。本文研究发现,乌头碱能明显减少侵袭的肝癌细胞总数、减缓肝癌细胞迁移速度,并体现出量效关系,表明乌头碱能通过降低肝癌细胞侵袭和迁移活性降低肝癌细胞的运动能力。
MAPK是一类丝氨酸-苏氨酸激酶,能被多种分裂素激活而使细胞进入分裂周期[23]。MAPK由三个成员组成,包括ERK、P38 MAPK和JNK[24]。研究表明,P38 MAPK信号通路参与了细胞增殖、迁移和凋亡的调控[25,26]。MAPKAPK是P38 MAPK的最重要的下游靶标,MAPKAPK可直接诱导HSP27磷酸化,从而调控细胞迁移、增殖和凋亡[27,28]。大量研究表明,P38 MAPK信号通路在调控癌细胞的增殖过程中也起到了重要作用,P38 MAPK可通过调控癌组织血管新生促进癌细胞转移,抑制P38 MAPK表达可抑制新血管的形成[28,29]。人参皂苷Rh2可通过下调P38 MAPK信号通路抑制肝癌细胞侵袭和迁移[30]。Zhu等[31]研究发现,磷脂酸促进肝癌细胞侵袭和迁移的作用与调控P38 MAPK信号通路有关。S100A9促进肝癌细胞增殖和迁移也与MAPK通路有关[32]。本文研究发现,乌头碱能显著降低肝癌细胞p-P38/P38的比值,并能显著抑制MAPKAPK和HSP27磷酸化,且具有量效关系,表明乌头碱能抑制MHCC97细胞P38 MAPK信号通路激活。
综上所述,乌头碱能抑制肝癌细胞增殖并降低其侵袭、迁移能力,并且其机制可能与抑制P38 MAPK信号通路激活有关。本研究初步探讨了乌头碱对肝癌细胞增殖、侵袭和迁移的影响及其作用机制,对于其具体的分子机制还有待进一步研究。
参考文献:
[1] Jemal A,Bray F,Center MM,etal.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Liu Y,Huang H,Yuan B,etal.Suppression of CUGBP1 inhibits growth of hepatocellular carcinoma cells[J].Clin Invest Med,2014,37(1):10-18.
[3] Liu F,He Y,Shu R,etal.MicroRNA-1297 regulates hepatocellular carcinoma cell proliferation and apoptosis by targeting EZH2[J].Int J Clin Exp Pathol,2015,8(5):4972-4980.
[4] Li T,Qin LX,Gong X,etal.Clinical characteristics,outcome,and risk factors for early and late intrahepatic recurrence of female patients after curative resection of hepatocellular carcinoma[J].Surgery,2014,156(3):651-660.
[5] Fu F,Wan Y,Mulati WT,etal.Kanglaite injection combined with hepatic arterial intervention for unresectable hepatocellular carcinoma:a meta-analysis[J].J Cancer Res Ther,2014,10(Suppl 1):38-41.
[6] Chan TY.Aconite poisoning[J].Clin Toxicol,2009,47(4):279-285.
[7] Ji BL,Xia LP,Zhou FX,etal.Aconitine induces cell apoptosis in human pancreatic cancer via NF-κB signaling pathway[J].Eur Rev Med Pharmacol Sci,2016,20(23):4955-4964.
[8] 高运军,李 丽,李 文.癌痛宁巴布剂中乌头碱的体外透皮吸收研究[J].中成药,2008,30(11):1619-1620.
Gao YJ,Li L,Li W.The study on transdermal absorption of aconitine in aitongning plaster[J].Chin Traditional Patent Med,2008,30(11):1619-1620.
[9] 王华灵,韩培秀,徐世明,等.乌头碱对癌症疼痛的治疗效果[J].中国中西医结合杂志,1994,4:219-219.
Wang HL,Han PX,Xu SM,etal.The effects of aconitine on cancer related pain[J].Chin J Integrated Traditional Western Med,1994,4:219-219.
[10] Pyaskovskaya ON,Boychuk IV,Fedorchuk AG,etal.Aconitine-containing agent enhances antitumor activity of dichloroacetate against Ehrlich carcinoma[J].Exp Oncol,2015,37(3):192-196.
[11] Du J,Lu X,Long Z,etal.In vitro and in vivo anticancer activity of aconitine on melanoma cell line B16[J].Molecules,2013,18(1):757-767.
[12] Yan ZC,Chen D,Wu XZ,etal.Effects of aqueous extracts of Aconitum carmichaeli,Rhizomabolbostemmatis,Phytolaccaac-inosa,Panaxnotoginseng and Gekkoswinhonis Guenther on Bel-7402 cells[J].World J Gastroenterol,2007,13(19):2743-2746.
[13] Siegel R,Ma J,Zou Z,etal.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[14] El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemio-logy and molecular carcinogenesis[J].Gastroenterology,2007,132(7):2557-2576.
[15] Hefaiedh R,Sabbeh M,Ennaifer R,etal.Percutaneous treatment versus hepatic resection for the treatment of small hepatocellular carcinoma[J].Tunis Med,2015,93(3):132.
[16] Gomes MA,Priolli DG,Tralhão JG,etal.Hepatocellular carcinoma:epidemiology,biology,diagnosis,and therapies[J].Rev Assoc Med Bras,2013,59(5):514-524.
[17] Cheng P,Tao Z,Fan Y,etal.Study of neurotoxic effects and underlying mechanisms of aconitine on cerebral cortex neuron cells[J].Arch Pharm Res,2009,32(11):1533-1543.
[18] Sun GB,Sun H,Meng XB,etal.Aconitine-induced Ca2+overload causes arrhythmia and triggers apoptosis through p38 MAPK signaling pathway in rats[J].Toxicol Appl Pharmacol,2014,279(1):8-22.
[19] Gutser UT,Friese J,Heubach JF,etal.Mode of antinociceptive and toxic action of alkaloids of Aconitum spec [J].NaunynSchmiedebergs Arch Pharmacol,1998,357(1):39-48.
[20] Bensalem S,Soubhye J,Aldib I,etal.Inhibition of myeloperoxidase activity by the alkaloids of Peganumharmala L.(Zygophyllaceae)[J].J Ethnopharmacol,2014,154(2):361-369.
[21] Ma L,Young J,Prabhala H,etal.miR-9,a MYC/MYCN-activated microRNA,regulates E-cadherin and cancer metastasis[J].Nat Cell Biol,2010,12(3):247-256.
[22] Guo BF,Liu S,Ye YY,etal.Inhibitory effects of osthole,psoralen and aconitine on invasive activities of breast cancer MDA-MB-231BO cell line and the mechanisms[J].Zhong Xi Yi Jie He Xue Bao,2011,9(10):1110-1117.
[23] Li L,Zheng B,Ma L,etal.Telekin suppresses human hepatocellular carcinoma cells in vitro by inducing G2/M phase arrest via the p38 MAPK signaling pathway[J].Acta Pharmacol Sin,2014,35(10):1311-1322.
[23] Costa AP,Lopes MW,Rieger DK,etal.Differential activation of mitogen-activated protein kinases,ERK 1/2,p38 MAPK,and JNK p54/p46 during postnatal development of rat hippocampus[J].Neurochem Res,2016,41(5):1160-1169.
[26] Taniyama Y,Ushio-Fukai M,Hitomi H,etal.Role of p38 MAPK and MAPKAPK-2 in angiotensin II-induced Akt activation in vascular smooth muscle cells[J].Am J Physiol Cell Physiol,2004,287(2):C494-C499.
[27] Evans IM,Britton G,Zachary IC.Vascular endothelial growth factor induces heat shock protein(HSP)27 serine 82 phosphorylation and endothelial tubulogenesis via protein kinase D and independent of p38 kinase[J].Cell Signal,2008,20(7):1375-1384.
[28] Hui L,Bakiri L,Mairhorfer A,etal.p38alpha suppresses normal and cancer cell proliferation by antagonizing the JNK-c-Jun pathway[J].Nat Genet,2007,39(6):741-749.
[29] Tate CM,Blosser W,Wyss L,etal.LY2228820 dimesylate,a selective inhibitor of p38 mitogen-activated protein kinase,reduces angiogenic endothelial cord formation in vitro and in vivo[J].J Biol Chem,2013,288(9):6743-6753.
[30] 冯子强,左国伟,石庆强,等.人参皂苷Rh2抑制肝癌HepG2细胞迁移的实验研究[J].中国免疫学杂志,2015,31(1):61-65.
Feng ZQ,Zuo GW,Shi QQ,etal.Mechanism of ginsenoside Rh2 inhibiting HepG2 cells migration[J].Chin J Immunol,2015,31(1):61-65.
[31] Zhu B,Shi S,Ma YG,etal.Lysophosphatidic acid enhances human hepatocellular carcinoma cell migration,invasion and adhesion through P38 MAPK pathway[J].Hepatogastroen-terology,2012,59(115):785-789.
[32] Wu R,Duan L,Ye L,etal.S100A9 promotes the proliferation and invasion of HepG2 hepatocellular,carcinoma cells via the activation of the MAPK signaling pathway[J].Int J Oncol,2013,42(3):1001-1010.

