运动神经元综合征并发干燥综合征康复1例报道
米海霞,杜晓霞
1.中国康复研究中心北京博爱医院神经康复科,北京市100068;2.首都医科大学康复医学院,北京市100068
干燥综合征是一种自身免疫性疾病,主要涉及唾液腺和泪腺[1]。原发性干燥综合征神经系统损害比较多见,外周和中枢神经系统损害分别占15%和5%[2]。运动神经元疾病(motor neuron disease,MND)是干燥综合征罕见的并发症。与干燥综合征相关的MND常见的临床特征类似于下运动神经元疾病或肌萎缩性侧索硬化。我们报道1例伴有干燥综合征的运动神经元综合征患者。
1 病历摘要
1.1 病史
患者女性,42岁,主因“进行性双下肢无力3.5年,伴双上肢活动不灵、言语缓慢4个月”以“运动神经元综合征”于2017年5月16日收入院。
患者于3年半前(2013年10月)无明显诱因出现左足趾活动无力、僵硬,予按摩等对症治疗可有缓解。2个月后(2013年12月)患者逐渐出现左下肢无力,表现为行走时左下肢拖拽,出现腿抖,易崴脚,伴左腿肌肉跳动,时感左腿外侧肌肉酸痛。5个月后(2014年3月)出现右下肢无力,上下楼梯费力,需扶物或搀扶,行走易摔倒,不能走直线,伴双下肢肌肉跳动,无肌肉萎缩及感觉异常。约2年半前(2014年底),患者双下肢无力、步行不稳加重,步行时需搀扶或借助辅具,夜间翻身、长时间卧位时出现双下肢僵直、痉挛,持续约0.5 min缓解,天气寒冷时加重,严重时每晚发作7~8次。约10个月前(2016年7月),患者在过度用力、大动作或姿势保持过长时,出现双上肢及手屈曲痉挛,约数秒钟可缓解,每天1~2次。约4个月前(2017年1月)患者无明显诱因出现双上肢活动笨拙,持物不稳,左手明显,伴言语缓慢、费力,饮水偶有呛咳。
入院时患者神清,言语缓慢、费力,四肢活动不灵、力弱,双下肢站立行走困难,需人搀扶或扶助行器缓慢步行。
患者自发病以来,饮食、睡眠正常,大便正常;2013年9月曾出现轻度尿频、尿不尽等症状,约1个月后症状自然消失,小便正常。体质量增加约20 kg。
既往史:发病前半年,患者反复感冒,偶有低热。干燥综合征4年,未正规治疗。4年前曾患急性肾盂肾炎。3年余前发现颈椎、腰椎退行性改变,椎间盘膨出。2年前发现T3锥体可疑血管瘤,脂肪肝,肝功能异常。否认食物药物过敏史。
1.2 专科查体
1.2.1 高级皮层功能
神清,言语缓慢、费力,记忆力、计算力、定向力及思维能力基本正常,高级皮层功能检查正常。
1.2.2 颅神经
粗测嗅觉、视力正常。双侧瞳孔等大同圆,直径约3 mm,光反射灵敏;眼动自如,辐辏反射正常。无面部感觉减退。双侧咬肌有力,左侧颞肌力量稍弱,下颌无偏移,角膜反射存在。双侧额纹对称,双侧鼻唇沟对称,示齿口角不偏。双侧听力粗测正常,双侧Rinne试验气导>骨导,Weber试验居中。悬雍垂居中,左侧咽反射消失,右侧咽反射存在,双侧软腭反射消失、软腭动度减弱,饮水偶呛。伸舌居中,轻度舌肌萎缩及舌肌纤颤。转颈、耸肩对称有力。
1.2.3 运动功能
双手大小鱼际肌、骨间肌萎缩,左侧明显。双侧髋关节屈曲、内收、外展轻度疼痛受限,双侧踝关节背伸受限。双上肢屈肌张力及旋前肌张力改良Ashworth量表分级Ⅰ级,双下肢伸肌张力Ⅰ+级。布氏分期:双上肢及手Ⅴ期,下肢Ⅳ期。徒手肌力测量结果见表1。
1.2.4 感觉功能
头面部、躯干、肢体无明显深、浅感觉减退。
1.2.5 反射及病理征
双侧肱二头肌、肱三头肌肌腱反射活跃,桡骨膜反射活跃,双侧膝腱反射活跃,跟腱反射亢进,髌阵挛阴性,踝阵挛阳性。Hoffmann征左侧阳性,右侧阴性;双侧Rossolimo征阳性,双侧Babinski征可疑阳性,双划征阳性。双侧掌颏反射阳性,吸吮反射阳性。
1.2.6 共济检查
双侧轮替动作笨拙,指鼻试验、跟膝胫试验缓慢,尚稳准。
1.2.7 平衡功能
坐位平衡可,双足并拢立位不能,宽步基时可短时站立。
1.2.8 步态
需人搀扶或扶助行器下缓慢步行。
1.3 肌电图及诱发电位
2013-10-31 肌电图(解放军总医院):左侧胫前肌轻度收缩时呈长时限、高波幅运动单位电位,可见自发电位,重收缩时呈单纯相;左侧腓肠肌轻度收缩时呈长时限、高波幅运动单位电位,重收缩时呈混合相;右侧胫前肌可见正相电位。
印象:左下肢神经源性受损,右胫前肌可见正相电位。
2014-01-28 肌电图和诱发电位(北京协和医院):双下肢神经源性损害(L4-5水平),上下肢SSR未见异常。
2014-12-23 肌电图和诱发电位(北京天坛医院):上下肢神经源性损害;胸锁乳突肌未见肯定神经源损害。
2017-05-19 肌电图和诱发电位(中国康复研究中心):右正中神经、右尺神经、双腓总神经复合肌肉动作电位(compound muscle action potential,CMAP)波幅下降;右肱二头肌、右胸锁乳突肌可疑神经源性损害;左足拇长伸肌、双胫前肌、右第一骨间肌、左肱二头肌神经源性损害;下肢皮肤交感反应潜伏期延长,波幅下降;双上、下肢深感觉径路传导阻滞;右侧听觉-脑干径路传导阻滞,双侧视觉径路传导阻滞。
1.4 影像学检查
1.4.1 头颅MRI
2013-12-07 :头颅核磁未见异常信号。
2015-03-04 :双侧侧脑室后缘少许白质脱髓鞘。
2017-05-18 :双侧额叶和脑室后角旁轻度白质脱髓鞘。
见图1。
1.4.2 颈椎MRI
2013-07-05 和2017-05-19均示:C3-6椎间盘压迫脊髓硬膜囊,脊髓中无异常信号。
见图2。
1.4.3 胸椎MRI
2013-07-12 :无脊髓压迫证据,脊髓无异常信号;T3椎体血管瘤。
2015-02-28 :T3椎体异常信号影,血管瘤可能性大;T4-5髓内信号欠均匀,胸髓表面不连续强化影。
2017-05-22 :无脊髓压迫和异常信号。
见图3。
1.5 实验室检查
2013-12-06 (解放军总医院):SSA抗体阳性;血清胱抑素3.95 mg/L(参考值0.45~1.25 mg/L)。
2013-12-26 (北京协和医院):SSA抗体、Ro52抗体强阳性。
2017-05-17 (中国康复研究中心):血尿便常规、凝血、肝功、肾功、甲功等未见异常,血脂、尿酸偏高,SSA、SSB抗体阳性,Ro52抗体阳性。
1.6 其他检查
腮腺超声(2013-12-10,解放军总医院):腮腺、颌下腺弥漫性病变。
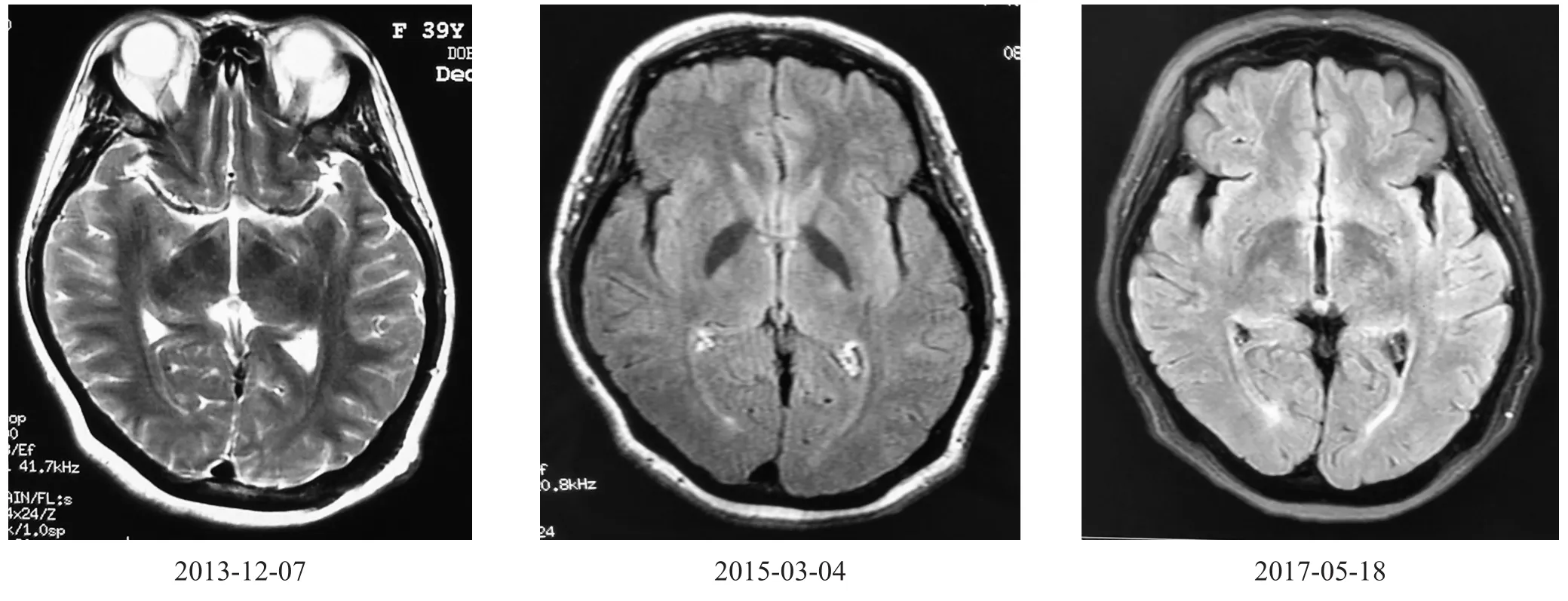
图1 患者头颅MRI
2 康复诊断
1.运动神经元综合征
上下肢神经源性损害
四肢活动不利、构音障碍
变性性
2.构音障碍
吞咽障碍
四肢运动功能障碍
平衡功能障碍
姿势异常
3.ADL中度功能缺陷
4.社会参与能力减退
5.其他诊断
干燥综合征
颈椎病
腰椎间盘退行性变
T3椎体血管瘤
脂肪肝
3 诊断依据
3.1 定位诊断
患者神清,言语缓慢、费力,饮水偶有呛咳,软腭反射消失,咽反射存在,软腭动度减退,双侧掌颏反射阳性,假性球麻痹,定位于双侧皮质脊髓束;轻度舌肌萎缩及舌肌纤颤,定位于舌下神经核团及其联系纤维;四肢活动不灵,肌力减退,双侧腱反射活跃或亢进,双侧Rossolimo征阳性及Babinski征加强试验阳性,肌电图示上下肢神经源性损害,定位于上运动神经元。患者双手肌力减退,大小鱼际肌、骨间肌肌肉萎缩,定位于脊髓前角细胞。综合定位于上、下运动神经元。
3.2 定性诊断
中年女性,隐袭起病,慢性进行性病程,表现为肌无力、肌萎缩和肌束震颤,伴反射亢进、病理征等上下运动神经元同时受累,无感觉障碍,肌电图检查示上下肢神经源性损害,故诊断考虑MND的可能。但患者近端肌肉力量远低于远端肌肉,症状进展相对较慢,病变包括脊髓和延髓。临床表现与MND的4种典型类型不完全匹配,考虑运动神经元综合征。患者被诊断患有干燥综合征,SSA和SSB抗体阳性,Ro52抗体持续阳性,没有授受任何针对性治疗;MRI曾显示脊髓异常信号,且头颅MRI显示脑室周围白质变性缓慢进展。查阅相关资料,不乏文献报道类似病例,考虑疾病机制可能为免疫介导引起上、下运动神经元损伤。
4 鉴别诊断
4.1 颈椎病性脊髓病
本病好发于中老年人,临床表现可有肢体无力、麻木、反射亢进等,但无舌肌萎缩和束颤,无球麻痹等表现。该患者虽然存在颈椎间盘突出等问题,但继肢体无力等表现后,出现构音及吞咽问题,暂排除此诊断,可进一步完善胸锁乳突肌肌电图以鉴别。
4.2 多灶性运动神经病
是一种以手部小肌肉无痛性不对称无力、萎缩起病,呈缓慢进展的疾病,中青年发病,可伴肌肉束颤,逐渐波及前臂、上臂,肌电图有神经源性损害,约50%~60%多灶性运动神经病患者血中神经节苷脂抗体滴度升高,免疫抑制剂和球蛋白治疗有效。该患者以下肢痉挛性瘫起病,逐渐累及四肢,并出现构音及吞咽问题,故暂除外,可进一步完善化验。
4.3 肯尼迪病
X染色体连锁遗传性运动神经元病,主要见于中年男性,表现为缓慢进展的延髓损害及肢体肌肉无力、萎缩、束颤,可有构音障碍及吞咽困难,但无上运动神经元损伤表现。该患者中年女性,存在上下运动神经元损害表现,家族中否认类似病史,故可排除,基因筛查可确诊。
4.4 平山病
又称青年上肢远端肌萎缩。典型表现为青春早期隐袭起病的手及前臂远端肌肉无力,随病变进展逐渐出现相应肌群萎缩,多为单侧损害,部分可表现不对称双侧损害,一般无锥体束损害。本患者中年起病,出现双下肢进行性无力,并逐渐进展为四肢活动不灵、无力,存在腱反射活跃、病理征等锥体束损害表现。故暂除外此诊断。
5 康复方案及疗效评估
5.1 主要问题
构音障碍:言语缓慢、费力,轻度吟诗样语言。吞咽障碍:饮水偶呛。
四肢运动功能障碍:四肢肌力减退,近端重于远端,双手肌肉萎缩,活动笨拙;需人搀扶或扶助行器下缓慢步行,双足下垂明显。
平衡功能障碍:坐位平衡可,双足并拢立位不能,宽步基时可短时站立。
姿势异常:双侧跟腱短缩,右侧重,不能保持中立位;鸭步步态。
日常生活活动(activities of daily living,ADL)中度功能缺陷:翻身、起坐、进食、穿衣、如厕等部分介助。
社会参与能力减退。
5.2 康复目标
近期目标:缓解发音费力,提高语速及清晰度;维持各关节活动度,提高四肢肌力及运动控制能力,防止肌肉萎缩,提高膝关节稳定性,改善步态;ADL训练。
远期目标:回归家庭。
5.3 康复方案
5.3.1 药物治疗
口服艾地苯醌、弥可保、维生素B1,肌注腺苷钴胺等营养神经;予依达拉奉清除氧自由基等治疗。第4周时,予γ-球蛋白每天0.4 g/kg静脉注射,共5 d。
5.3.2 物理治疗
遵守保护性康复训练原则,避免过度疲劳加重病情。佩戴下肢长肢具,纠正膝关节反张,辅助步行,减少肌肉力量过度消耗;治疗师徒手给予阻力或利用自身重力进行目标肌肉抗阻训练。每次45 min,每天1次,共4周。每个动作重复次数及训练间隔以不引起患者疲劳为原则。
5.3.3作业治疗
采用挂圈、拧螺丝、插小木钉等改善双上肢肌力和肌肉耐力,改善左手抓握姿势,提高双手灵活性,提高ADL。每次45 min,每天1次,共4周。
5.3.4 言语治疗
发声训练,呼吸训练,提高发音节律和速度。每次30 min,每天1次,每周5 d,共4周。
5.3.5 音乐治疗
练习发声、唱歌及气息,改善言语流畅性。每次30 min,每天1次,每周5 d,共4周。
5.3.6 中医治疗
针灸及推拿,每次30 min,每天1次,共4周。
5.3.7 康复护理
安全宣教,床上翻身、搭桥,坐位转移等训练,共4周。
5.4 康复评定
综合康复4周后,尤其γ-球蛋白静脉滴注后,患者功能状态改善。
5.4.1 运动功能
四肢肌力改善(表1),尤其是双侧上肢肌力改善明显。躯干核心控制能力及稳定性提高,立位静态平衡时重心转移能力提高,膝关节稳定性提高,站立姿势较前改善。双上肢抗重力姿势控制能力提高,左手抓握姿势及双手灵活性改善。
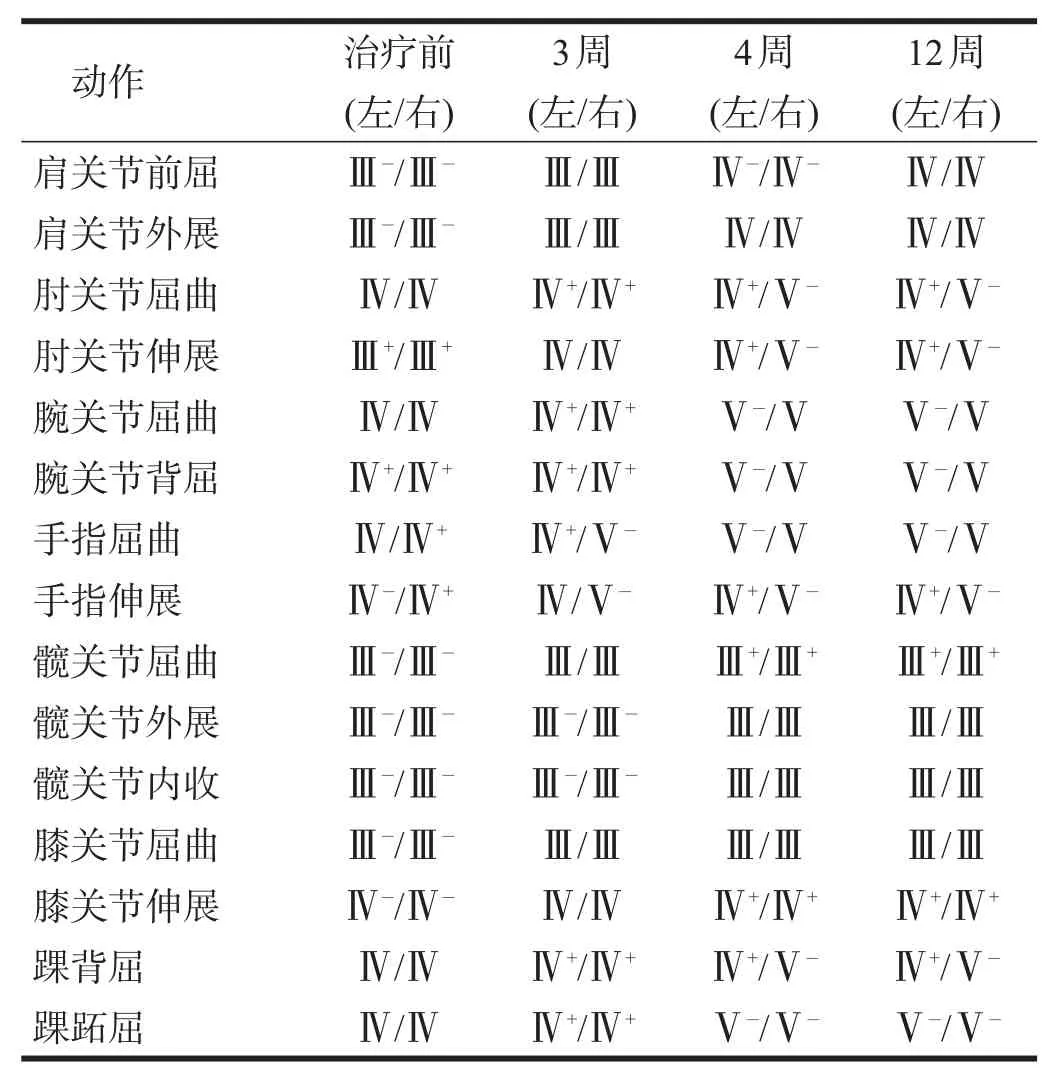
表1 患者各时间徒手肌力检查结果
5.4.2 ADL
改良Barthel指数较治疗前提高15分,在穿衣、转移、如厕3个项目中有进步。日常生活所需介助较前减少。
5.4.3 语言及吞咽功能
发音较前清晰,语速、语调及流畅性改善,言语费力感好转,可以比较轻松地吟读诗词。
6 随访
患者康复4周后出院,坚持每周3次门诊康复治疗,项目包括物理治疗、作业治疗、推拿等;8周后再次行γ-球蛋白静脉注射(方案同前)及口服糖皮质激素治疗,患者肌力(表1)和肌张力未见进一步改善,患者运动功能及ADL维持出院时水平。
7 讨论
MND是一组病因未明,选择性侵犯脊髓前角细胞、脑干后组运动神经元、皮质锥体细胞及锥体束的慢性进行性神经系统变性疾病。临床表现为上、下运动神经元同时或分别受损的症状和体征,肌无力、肌萎缩和锥体束征的不同组合,而感觉和括约肌功能一般不受影响。MND可分为4种类型:肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)、进行性肌萎缩、进行性延髓麻痹和原发性侧索硬化。
本例患者为中年女性,临床特点为:①隐袭起病,慢性进行性病程;②以上、下运动神经元同时受累为主要表现;③无感觉障碍;④肌电图检查示上、下肢神经源性损害;⑤无解释上下运动神经元损害的其他疾病的电生理依据及影像学依据。诊断考虑运动神经元方面疾病。但患者病情进展速度偏慢,病灶弥散、累及延髓,临床表现与MND的4种典型类型并不完全相符,考虑运动神经元综合征。另外,患者既往诊断干燥综合征,未特殊治疗,多次复查均为SSA、SSB抗体阳性和Ro52抗体阳性,既往胸髓曾有异常信号,头颅核磁存在白质变性,不除外免疫因素介导。
ALS发病机制可能与以下因素相关:Cu/Zn超氧化物歧化酶基因突变、谷氨酸毒性学说、线粒体功能障碍、免疫反应、星形胶质细胞功能异常等。原发性干燥综合征是由于外分泌腺进行性淋巴细胞浸润引起的以干燥为特征的慢性自身免疫性疾病[3],外周和中枢神经系统损害分别占15%和5%[2]。干燥综合征导致中枢神经系统疾病的机制尚不清楚,可能与T和B淋巴细胞浸润,进而引起血管炎或自身抗体介导的相关神经元损伤。因此,干燥综合征患者有发生ALS的免疫学基础。
原发性干燥综合征的中枢神经系统损害表现各不相同,包括急性或慢性脊髓病,多发性脑损伤类似于多发性硬化,认知功能障碍,甚至小脑共济失调。尽管罕见,但仍有一些报道患有运动神经元综合征的干燥综合征患者。Delalande等[4]回顾分析82例伴有神经系统损害的原发性干燥综合征患者,其中1例表现类似运动神经元病但伴有膀胱功能障碍。廖琴等[5]报道4例ALS并发干燥综合征患者。Hagiwara等[6]报道2例上运动神经元损害为主的ALS并发亚临床干燥综合征患者。Salachas等[7]报道3例干燥综合征并发运动神经元病患者,其中2例符合拟诊或可能的ALS,另l例符合原发性侧索硬化。
对此类患者的治疗有不同报道。Salachas等[7]报道的3例患者,经糖皮质激素治疗后,2例临床症状获短期缓解。Hagiwara等[6]报道2例患者。1例采用甲泼尼龙冲击治疗后,神经系统症状无改善;静脉注射免疫球蛋白治疗后,无力和步态障碍显著改善;1个月后重复免疫球蛋白治疗,但效果不明显。1例最初采用甲泼尼龙治疗,效果甚微;采用其他免疫调节疗法,包括血浆置换和环磷酰胺脉冲,症状仍继续进展。最后改为免疫球蛋白治疗后,头3 d患者肢体无力显著改善;1个月后重复免疫球蛋白治疗,肢体无力改善不明显。
本例患者接受静脉注射免疫球蛋白治疗和4周综合康复后,言语、肌力、平衡、姿势控制和ADL均显著改善;但2个月后重复免疫球蛋白治疗,并未改善患者功能状态。与Hagiwara等[6]的报道相似。
综上所述,对同时存在运动神经元综合征和干燥综合征的患者,可尝试应用γ-球蛋白冲击治疗,以期短期缓解患者临床症状。但仍需结合适宜的康复治疗,维持运动功能及ADL。
[参考文献]
[1]Moutsopoulos HM.Sjögren's syndrome:autoimmune epithelitis[J].Clin Immunol Immunopathol,1994,72(2):162-165.
[2]Alegria G,Guellec D,Mariette X,et al.Epidemiology of neurological manifestations in Sjögren's syndrome:data from the FrenchASSESS Cohort[J].RMD Open,2016,2(1):e000179.
[3]Jamilloux Y,Magy L,Hurtevent J,et al.Immunological profiles determine neurological involvement in Sjögren's syndrome[J].Eur J Intern Med,2014,25(2):177-181.
[4]Delalande S,de Seze J,Fauchais AL,et al.Neurologic manifestations in primary Sjögren syndrome:a study of 82 patients[J].Medicine(Baltimore),2004,83(5):280-291.
[5]廖琴,樊东升.肌萎缩侧索硬化伴干燥综合征四例临床分析[J].中华神经科杂志,2012,45(7):467-470.
[6]Hagiwara K,Murai H,Ochi H,et al.Upper motor neuron syndrome associated with subclinical Sjögren's syndrome[J].Intern Med,2008,47(11):1047-1051.
[7]Salachas F,Lafitte C,Chassande B,et al.Motor neuron disease mimicking amyotrophic lateral sclerosis or primary lateral sclerosis in primary Sjogren's syndrome[J].Neurology,1998,50(4):A31.

