结肠癌肝转移同期微创手术治疗6例报告
徐 力 谭海东 周文颖 司 爽 孙永亮 刘立国 刘笑雷 黄 笳 杨志英
(中日友好医院肝胆外科,北京 100029)
肝脏是结肠癌最常见的远处转移器官,15%~25%的患者在初次确诊结肠癌的同时即发现伴有肝脏转移[1]。结直肠癌肝转移(colon cancer with liver metastasis,CLM)也是该类患者最常见的治疗失败及死亡原因。目前认为根治性切除原发及转移病灶可延长CLM患者总体生存时间[2,3],是CLM的最佳治疗方案[4,5]。近年来,微创外科理念及技术不断发展,极大影响CLM的手术治疗模式,但同期腹腔镜处理肝脏及结肠病灶的报道尚不多见。我院2014年6月~2017年1月对6例CLM同期行腹腔镜手术切除和射频消融(radiofrequency ablation,RFA),现报道如下。
1 临床资料与方法
1.1 一般资料
本组6例,男4例,女性2例。年龄40~72岁,平均58.2岁。原发灶位于乙状结肠4例,左、右半结肠各1例。肝转移病灶数目、部位、累及范围及是否接受术前化疗情况见表1。3例接受新辅助化疗,例1、例3化疗方案为folfox+贝伐珠单抗,共4周期,结束后6周手术,例5为folfox化疗4周期,结束后4周手术。
病例选择标准:术前均行肠镜检查明确病灶位于结肠,活检病理确诊结肠癌;经腹部超声、增强CT和(或)核磁检查明确为肝转移(肝转移定义为结肠癌确诊前或确诊时发现的肝脏病灶[6]);影像学评估原发灶无腹、盆腔浸润,肝切除后剩余体积不小于原肝50%,无心肺及其他手术禁忌。
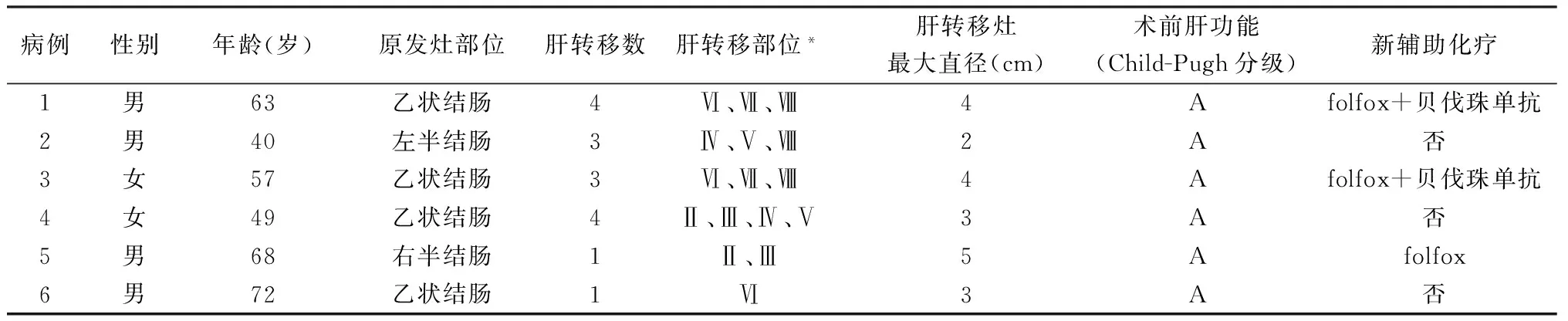
表1 6例一般资料
*Couinaud 分段
1.2 方法
明确诊断后经胸部CT、PET-CT除外肝外不可切除转移病灶,经多学科联合诊治团队(multiple disciplinary team,MDT)讨论明确初始治疗方案(包括可切除性评估、新辅助及术后辅助化疗方案制定等);MDT评估原发灶、转移灶为可切除后行腹腔镜同期结肠癌肝转移根治手术。对复发患者再次进行MDT讨论制定进一步治疗方案。
腹腔镜肝切除:取头高脚低位,CO2建立气腹(气腹压力14 mm Hg)。置入观察镜后先全面探查腹腔,再次确定可切除性。常规先行肝脏切除。均行术中肝脏超声检查,参照术前影像资料明确肝脏转移瘤部位、数目及与肝内管道关系。依据腹腔镜肝切除专家共识[7],非解剖性肝切除包括肝楔形切除、局部切除或病灶剜除等;解剖性肝切除主要包括肝左外叶切除、肝段切除等。以腹腔镜肝左外叶为例,具体方法:①CO2建立气腹后,取脐部作为观察孔,右侧操作孔取剑突与脐连线中点右侧5~10 cm处,左侧操作孔取剑突与脐连线中点水平与左侧腋前线相交处。②探查了解肝左外叶及病灶位置和解剖关系,剑突下插入缝肝针,将肝圆韧带于其根部悬吊于腹壁,将肝抬起(图1A)。③超声刀(日本Olympus公司)沿肝镰状韧带左缘切开肝表面实质达肝左外叶Glisson鞘表面(图1B),辨认Glisson鞘结构后用Endo-GIA(美国Johnson公司)将其切割闭合离断。④继续切开近第二肝门部肝表面实质,显露肝左外叶肝静脉(图1C),Endo-GIA切割闭合离断(图1D)。⑤沿左膈肌离断左冠状韧带及左三角韧带。检查断面并止血,将门静脉、胆管及肝静脉断端用可吸收夹夹闭以防止渗血。⑥切除标本放入标本袋中,待全部手术完成后取出,肝断面留置引流管自左侧穿刺孔引出。RFA(美国柯惠公司)用于直径<3 cm、位置深在或患者全身、肝脏功能难以耐受肝切除者。腹腔镜直视及超声引导下完成,单次射频时间12 min。将射频针插入肿瘤底部,打开集束电极针后锁定,接射频治疗仪进行RFA治疗。退针时针道消融。RFA输出功率0~200 W(±15%),射频频率480 kHz(±15%)。
结肠手术:均在肝切除完成后进行。依据肿瘤部位于下腹增加1~2个操作孔。肠管及其相应的肠系膜和淋巴脂肪组织用超声刀游离,粗大血管用Hem-o-lok夹(美国Teleflex公司)夹闭离断。根据手术部位利用下腹切口扩大至5 cm,将肝脏标本及病变肠段取出体外,完成肿瘤与肠段整块切除。均接受一期消化道重建。具体手术方式见文献[8]。
2 结果
6例均行腹腔镜结肠癌根治术,除例3中转开腹行右半肝切除,其余肝脏手术均在腹腔镜下完成。除例1术中输红细胞2 U、血浆400 ml外,其余病例围手术期未输血。术后病理结直肠癌标本远、近端切缘均为阴性;肝脏切缘均为阴性,肿瘤距离切缘最小距离1 mm。术后均无肝功能不全、吻合口漏、吻合口出血、腹腔感染、腹腔出血、切口感染等并发症。6例随访中位时间13.5月(6~27个月),病例1术后1年复发,再次行腹腔镜肝脏肿物射频消融术,27个月时死亡,其他病例无复发、死亡(表2)。
3 讨论
同时性CLM的手术治疗可以分为同期和分期2种[9]。既往因传统开腹同期切除原发、转移病灶,切口往往自下而上纵贯整个腹部,甚至再加横行“十字”形切口,创伤大、并发症发生率高,患者也往往难以耐受。近年来,腹腔镜、射频消融等微创理念及技术的应用,大大降低同期治疗CLM的手术创伤。与分期手术相比,同期切除并未增加并发症发生率,同时能够缩短住院时间,减轻患者对于二次手术的心理压力[10]。此外,患者接受同期切除后可以尽早开始术后治疗,避免2次手术等待期间肿瘤进展,甚至错过根治性切除时机的风险。近年来,有学者[11,12]倾向于同期手术,可以获得更好疗效。

图1 腹腔镜肝左外叶切除术 A.肝圆韧带悬吊,以便充分显露游离左外叶肝脏;B.超声刀由浅至深逐步离断肝实质;C.近第二肝门除显露肝左静脉;D. Endo-GIA离断肝左静脉

病例手术方式手术时间(min)术中出血量(ml)术中输血量(ml)是否输血淋巴结清扫(枚)恢复排气时间(d)随访时间(月)转归1局部切除+射频消融4301000430是9527死亡2局部切除+射频消融300100300无15518无复发,存活3中转开腹右半肝切除450200450无22616无复发,存活4左外叶切除+射频消融250300250无11411无复发,存活5左外叶切除300300300无1889无复发,存活6Ⅵ段切除280500280无1666无复发,存活
术前MDT准确评价CLM的可切除性是能否同期完成R0切除、获得满意疗效的根本保证,其中肝转移病灶部位、数量的确定及肝功能评估尤为关键。本组6例术前均经MDT讨论,3例初诊时判定肝转移灶潜在可切除。经新辅助化疗后再次MDT讨论认为治疗效果满意,满足手术干预指佂。此外,我们认为建立术前超声、CT、MRI等影像资料与术中超声比对体系,对于明确肝转移病灶、避免术中遗漏尤为重要,全部参与手术的医生应集体术前阅片,并建议至少1名手术医生参与肝脏转移病灶的术前超声检查。
目前,腹腔镜结肠癌手术已取得和开腹手术一样甚至是更好的效果[13],因此,在实际工作中如何处理肝脏转移病灶往往决定同期手术方式[14]。近年来,腹腔镜肝脏手术发展日趋成熟,但在同期治疗CLM中的应用尚处探索阶段,缺乏高级别循证医学证据[15],相关指南及共识中亦未予明确推荐。Inoue等[16]比较腹腔镜与开腹肝切除治疗CLM的短期疗效,腹腔镜组术中出血量、术后住院时间及肝功能恢复方面存在优势。本组病例1、2、4、5、6分别接受腹腔镜肝切除,全部获得R0切除的前提下同样获得满意的短期疗效。尽管已有回顾性研究及meta分析评价腹腔镜肝切除应用于CLM同期切除术后1、3、5年生存率与开腹手术相当[17,18],但多数病例肝转移个数较少,缺乏代表性,故其长期疗效尚需进一步研究。作为一项微创外科技术,腹腔镜肝切除在CLM中的应用必须首先严格遵循肿瘤治疗原则[6]:①结直肠癌原发灶能够或已经根治性切除;②根据肝脏解剖学基础和病灶范围,肝转移灶可完全(R0)切除,且要求保留足够的肝脏功能,肝脏残留容积≥30%~50%;③患者全身状况允许,没有不可切除的肝外转移病变。此外,作为CLM治疗的新趋势,腹腔镜肝切除的适用范围需要严格规范,以确保安全性及微创效果。参照腹腔镜肝切除治疗原发性肝脏肿瘤,并结合自身经验,我们认为肝转移灶位于Ⅱ、Ⅲ、Ⅳb、Ⅴ、Ⅵ段,Ⅳa及Ⅷ段表浅者,且病灶累及肝段数不超过3个或局限于半肝,腹腔镜肝切除安全可行;转移灶大小及数并非是能否行腹腔镜肝切除的决定因素,但病灶越大、数目越多,R0切除的前提下确保足够残留肝脏体积越困难,加之创面多、手术时间长,故一般建议单一病灶直径小于5 cm、不超过5个。对于腹腔镜肝右后叶、右半肝切除,尽管有学者[19]进行了初步尝试,但因手术难度较大,目前无论国际或国内指南及共识均不在推荐范围内,特别是对于接受术前化疗者,化疗药物往往导致肝脏不同程度的病变,腹腔镜肝切除尤需谨慎。本组病例3接受含有奥沙利铂方案的化疗,术中探查可见肝脏呈淤血表现,质地脆、极易出血,且肝转移病灶累及右肝3个肝段,位置深在,故转开腹肝切除。
RFA安全、创伤小、操作简便,为CLM局部治疗提供又一选择[20]。目前,对RFA的临床疗效报道不一。欧洲一项大规模随机对照临床研究表明对于直径<3 cm的转移灶,RFA治疗效果与手术切除相近[21],另有研究[22,23]显示RFA对肝转移癌治疗效果欠佳,局部复发率高。我们的经验是,对于患者肝转移病灶部位深在、切除困难、肝功能及全身状况难以耐受手术切除者,RFA可作为肝切除治疗CLM的有效补充,但病灶直径应<3 cm,且远离胆管以确保足够的消融范围(0.5~1 cm)[24]。病例2、4均已在腔镜下切除大部分病灶,如继续切除位置深在的Ⅷ、Ⅳa段病灶可能增加手术风险,故对其进行RFA治疗(直径最大3 cm),随访过程尚未见肿瘤复发。病例1除Ⅷ段病灶难以腹腔镜下切除外,既往合并慢性阻塞性肺病,呼吸功能差,有效缩短手术时间,降低手术创伤,更加凸显出腹腔镜肝切除联合RFA的微创优势。
总之,腹腔镜和RFA等技术的应用为同期微创治疗CLM提供更多选择,但尚处于探索阶段。微创时代的CLM治疗必须以肿瘤治疗原则为前提,准确筛选适应证患者,合理选择手术时机和手术策略,以最小的创伤,使CLM患者得到适当合理的治疗,以求得到最大的获益。
参考文献
1 Leporrier J,Maurel J,Chiche L,et al. A population-based study of the incidence, management and prognosis of hepatic metastases from colorectal cancer. Br J Surg,2006,93(4):465-474.
2 Choti MA,Sitzmann JV,Tiburi MF,et al. Trends in long-term survival following liver resection for hepatic colorectal metastases. Ann Surg,2002,235(6):759-766.
3 Jegatheeswaran S, Mason JM, Hancock HC, et al. The liver-first approach to the management of colorectal cancer with synchronous hepatic metastases: a systematic review. JAMA Surg,2013,148(4):385-391.
4 Fontana R,Herman P,Pugliese V,et al. Surgical outcomes and prognostic factors in patients with synchronous colorectal liver metastases. Arq Gastroenterol,2014,51(1):4-9.
5 Araujo RL,Gonen M,Allen P,et al. Positive postoperative CEA is a strong predictor of recurrence for patients after resection for colorectal liver metastases. Ann Surg Oncol,2015,22(9):3087-3093.
6 中华医学会外科学分会胃肠外科学组,中华医学会外科学分会结直肠肛门外科学组,中国抗癌协会大肠癌专业委员会,等.结直肠癌肝转移诊断和综合治疗指南(2016版).中华消化外科杂志,2016,15(8):755-767.
7 中华医学会外科学分会肝脏外科学组.腹腔镜肝切除术专家共识和手术操作指南(2013版).中华外科杂志,2013,51(4):289-292.
8 李新源,韩晓鹏,刘宏斌,等.腹腔镜辅助结直肠癌根治术的临床应用.腹腔镜外科杂志,2010,15(9):672-675.
9 Siriwardena AK,Mason JM,Mullamitha S,et al. Management of colorectal cancer presenting with synchronous liver metastases. Nat Rev Clin Oncol,2014,11(8):446-459.
10 Nachmany I,Pencovich N,Zohar N,et al. Laparoscopic versus open liver resection for metastatic colorectal cancer. Eur J Surg Oncol,2015,41(12):1615-1620.
11 Nanji S,Mackillop WJ,Wei X,et al. Simultaneous resection of primary colorectal cancer and synchronous liver metastases: a population-based study. Can J Surg,2017,60(2):122-128.
12 Abelson JS, Michelassi F, Sun T, et al. Simultaneous resection for synchronous colorectal liver metastasis: the new standard of care? J Gastrointest Surg,2017,21(6):975-982.
13 Vennix S, Pelzers L, Bouvy N, et al. Laparoscopic versus open total mesorectal excision for rectal cancer. Cochrane Database Syst Rev,2014,4:D5200.
14 刘 荣,贾宝庆.结直肠癌肝转移腹腔镜一期联合切除专家共识.中华腔镜外科杂志(电子版),2014,7(1):1-3.
15 Lupinacci RM,Andraus W,De Paiva HL,et al. Simultaneous laparoscopic resection of primary colorectal cancer and associated liver metastases: a systematic review. Tech Coloproctol,2014,18(2):129-135.
16 Inoue Y,Hayashi M,Tanaka R,et al. Short-term results of laparoscopic versus open liver resection for liver metastasis from colorectal cancer: a comparative study. Am Surg,2013,79(5):495-501.
17 Hasegawa Y,Nitta H,Sasaki A,et al. Long-term outcomes of laparoscopic versus open liver resection for liver metastases from colorectal cancer: A comparative analysis of 168 consecutive cases at a single center. Surgery,2015,157(6):1065-1072.
18 Schiffman SC,Kim KH,Tsung A,et al. Laparoscopic versus open liver resection for metastatic colorectal cancer: a meta-analysis of 610 patients. Surgery,2015,157(2):211-222.
19 Hu MG,Ou-Yang CG,Zhao GD,et al. Outcomes of open versus laparoscopic procedure for synchronous radical resection of liver metastatic colorectal cancer: a comparative study. Surg Laparosc Endosc Percutan Tech,2012,22(4):364-369.
20 Abdalla EK,Bauer TW, Chun YS,et al. Locoregional surgical and interventional therapies for advanced colorectal cancer liver metastases: expert consensus statements. HPB(Oxford),2013,15(2):119-130.
21 宋鹏远,孙亚红,郭 亚,等.微波消融与手术切除结直肠癌肝转移的疗效比较.中国微创外科杂志,2015,15(10):887-890.
22 Agcaoglu O,Aliyev S,Karabulut K,et al. Complementary use of resection and radiofrequency ablation for the treatment of colorectal liver metastases: an analysis of 395 patients. World J Surg,2013,37(6):1333-1339.
23 Nishiwada S,Ko S,Mukogawa T,et al. Comparison between percutaneous radiofrequency ablation and surgical hepatectomy focusing on local disease control rate for colorectal liver metastases. Hepatogastroenterology,2014,61(130):436-441.
24 Solbiati L,Ahmed M,Cova L,et al. Small liver colorectal metastases treated with percutaneous radiofrequency ablation: local response rate and long-term survival with up to 10-year follow-up. Radiology,2012,265(3):958-968.

