氯化钙和水杨酸对弱光胁迫下甜瓜幼苗生长及光合的影响
苗永美, 简 兴, 钱立生, 徐荣华(. 安徽科技学院 生命与健康科学学院,安徽 凤阳 3300;. 安徽科技学院 建筑学院,安徽 凤阳 3300)
光照是影响植物形态和功能的重要因子,对植物生长发育和形态建成具有极其重要的作用。植物在长期适应不同光环境过程中,不同植物所接受的太阳辐射存在明显差异,形成了自身特有的需光特性。甜瓜起源于非洲,喜光,但在栽培过程中,经常会遇到弱光环境。目前关于光照对甜瓜生长发育的影响已有不少报道,研究结论表明弱光会应影响甜瓜的生理生化指标和光合能力,长时间弱光导致甜瓜生长发育迟缓,最终影响产量和品质[1-2]。钙作为偶联胞外信号和胞内生理反应的第二信使参与植物对外界的反应和适应,是植物抵抗环境胁迫的一个重要因素,目前在植物生物学中有关钙的研究日益活跃[3-4]。已有研究表明,合理的使用钙在提高植物抗干旱[5]、低温[6]、盐碱[7]、涝渍[8]等逆境能力方面有一定正向作用。水杨酸(salicylic acid,SA)是一种广泛存在于植物体内的信号分子,能保护叶绿体膜结构及相对完整性,同时增加了叶片的气孔导度,提高光能转换效率,从而参与了调节植物抗病、抗盐、抗冷、重金属等多个抗逆过程[9-10]。黄瓜和番茄喷洒钙和SA后,光合酶和保护酶的活性升高,光合能力加强,作物对弱光的适应性加强[11-12]。关于钙和水杨酸对弱光下甜瓜的影响尚未见报道。因此,本试验针对甜瓜生长发育及生产中存在的实际问题,研究弱光胁迫结合喷洒CaCl2和SA,研究幼苗生长发育和光合能力等指标的变化情况,以探讨钙和SA调控甜瓜弱光胁迫的可行性,为甜瓜等作物利用外源物质钙和SA缓解弱光胁迫提供理论依据,也为甜瓜的农业生产提供技术服务。
1 材料与方法
1.1 供试材料
供试材料为‘羊角酥’甜瓜(安徽省凤阳县当地品种),经过多代自交收获的种子。CaCl2和SA均为AR,国药集团化学试剂有限公司;SPAD-502PLUS 叶绿素测定仪,日本柯尼卡美能达公司生产;CIRAS-3便携式光合荧光测定仪,美国PP System公司生产。
1.2 实验方法
试验于2015年9月至10月期间在安徽科技学院种植科技园进行。选取成熟饱满种子用55℃左右温水浸种5 h,滤掉水后,置于垫有湿纱布的培养皿中,28℃温箱中催芽。等到露出白色胚根时播入32孔穴盘,基质为土壤+草炭等比例混合,放于塑料大棚里培养,期间进行常规管理。等甜瓜幼苗长至两叶一心时,剔除弱苗,选择长势良好,整齐度基本一致的幼苗用于试验处理。设6个处理,每个处理2个穴盘,30~32株苗。具体处理方式见表1。弱光采用遮阳网双层遮阴,四周用竹竿搭架支撑遮阳网(遮光后光照强度约为自然光的50%)。采用全株(包括叶片和茎)喷施方式,CaCl2浓度为10 mmol/L,SA浓度为1 mmol/L,以喷去离子水为对照,每天上午10点开始喷施,喷至滴水,每天一次,连喷7 d,喷施时先喷遮阴处理的材料,逐盘喷施,喷完后立刻移入遮阳网中。下午5点浇水管理,保持土壤湿度尽可能一致。处理7 d结束后,第8 d开始测定相关指标。

表1 试验处理Table 1 Treatment
1.3 测定项目及分析方法
1.3.1 生长指标 各处理随机抽取5株甜瓜苗用于生长指标的测定。(1)叶长:用直尺测量第2、3功能叶叶心到叶尖的距离,平均值为该植株的叶长;(2)叶宽:用直尺测量第2、3功能叶最宽距离,平均值为该植株的叶宽;(3)叶厚:每株测第2、3功能叶,每个叶片用游标卡尺测四个部位,取平均值;(4)株高:子叶节到生长点处距离;(5)株粗:游标卡尺测量:子叶节处粗度;(6)将5株幼苗轻轻拔起,小心用清水洗净泥土,用吸水纸吸干表面水分,再剪取植株的地上部分和地下部分,分别称重;然后105℃杀青30 min, 75℃下烘干12 h,测定地上干重和地下干重。
1.3.2 叶绿素 随机抽取各处理的5株甜瓜苗测定叶绿素,选第2、3功能叶用 叶绿素测定仪测定,同一叶片测三个部位,取平均值。
1.3.3 光合指标 随机抽取各处理的5株幼苗,选第2、3功能叶用于光合指标测定。用光合荧光测定仪测定其胞间二氧化碳浓度Ci,气孔导度Gs,净光合速率Pn,蒸腾速率Tr,光合水分利用效率WUE,上午8∶00~11∶00进行测定。
1.3.4 数据处理 实验结果采用“平均值±标准误差”的方式表达,采用Excel 2003和采用SPSS 19软件进行数据分析,用Duncan′s检测法进行多重比较,检测处理间差异显著性。
2 结果与分析
2.1 CaCl2和SA对弱光下甜瓜幼苗生长的影响
甜瓜幼苗经过遮光(T4处理)后其生长明显受到抑制,除了叶厚变化差异不显著外,其它四个生长指标都明显降低,叶长、叶宽、株粗和株高分别降低了17.42%、15.88%、21.21%、24.84%(表2),说明本试验的弱光条件已成为逆境胁迫影响了甜瓜的正常生长。自然光照下喷施CaCl2和SA后,与T1相比,除叶厚和株粗稍有显著提高外,其它几个指标变化不显著,说明本研究所做的CaCl2和SA处理对正常条件下的甜瓜生长影响不太大;而弱光胁迫下喷施CaCl2能明显促进植株的生长,叶长、叶宽和株粗显著高于T4处理,比T4对应的各指标分别提高了20.44%、17.15%、30.77%;T5处理植株除了株高,其它四个指标达到自然光(T1处理)生长水平,说明合理喷施CaCl2能缓解甜瓜幼苗生长期的弱光逆境胁迫。弱光下喷施SA后的甜瓜幼苗生长情况从数值上与T4对照差异不显著,说明SA处理基本不能缓解弱光逆境对甜瓜生长造成的影响。

表2 CaCl2和SA对弱光下甜瓜幼苗生长的影响Table 2 Effect of CaCl2 and SA treatments on growth of melon seedling under low light intensity
注:同列不同字母表示处理间在0.05水平上差异显著;下同
Note: Different letters within the same column indicate significant differences at 0.05 level,the same as below.

图1 CaCl2和SA对弱光下甜瓜幼苗鲜重的影响Fig.1 Effect of CaCl2 and SA treatments on fresh weight of melon seedling under low light intensity
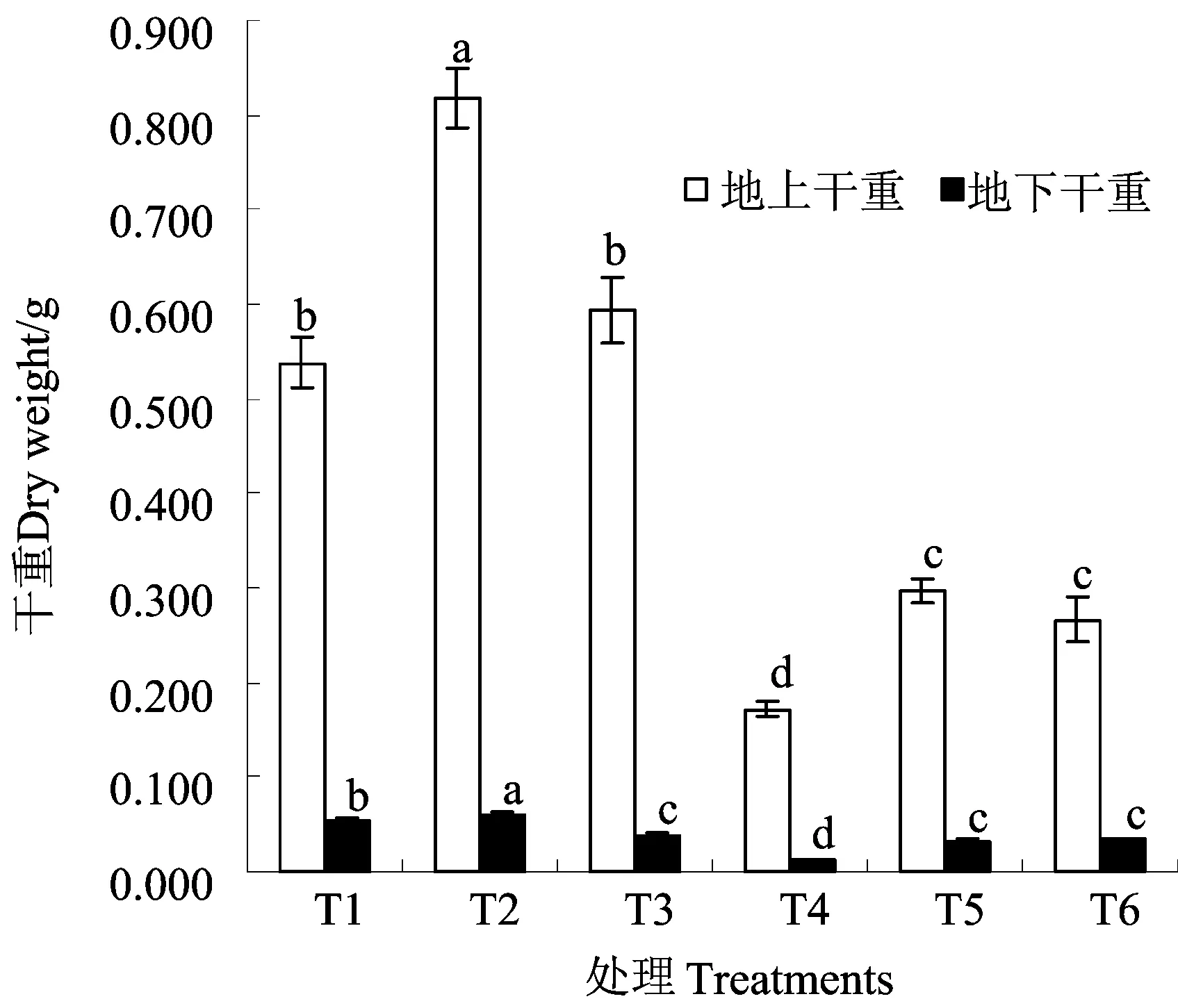
图2 CaCl2和SA对弱光下甜瓜幼苗干重的影响Fig.2 Effect of CaCl2 and SA treatments on dry weight of melon seedling under low light intensity
从图1、图2看出,遮光处理对甜瓜幼苗生长的抑制还表现在植株生物量方面,鲜重和干重都明显降低,T4处理植株地上鲜重和地下鲜重比T1分别降低了60.98%和62.36%,地上干重和地下干重分别降低了68.03%和77.78%。无论是自然光还是弱光条件下的CaCl2处理植株的鲜重和干重都比相应光条件下清水对照显著增加,自然光照下,鲜重(地上、地上)和干重(地上、地上)分别是T1对照的1.55、1.27、1.52、1.11倍,弱光条件下鲜重(地上、地上)和干重(地上、地上)分别是T4对照的2.04、1.68、1.72、1.66倍,比较发现弱光条件下CaCl2处理比自然光照条件下促进植株生物量的积累效果更明显。自然光照条件下,喷施SA促进植株地上部分生长效果不显著,抑制地下部分生长;而弱光条件下,SA处理能显著促进植株地上部分和地下部分的生长,鲜重(地上、地上)和干重(地上、地上)分别是T4对照的1.50、1.72、1.55、2.83倍。由此看出,喷施Ca2+和SA能缓解甜瓜弱光胁迫伤害。
2.2 CaCl2和SA对弱光下甜瓜幼苗叶绿素含量的影响
图3所示,遮光处理抑制了甜瓜幼苗叶绿素的合成,含量显著降低了8.70%。无论是自然光还是弱光下,甜瓜喷施CaCl2和SA后叶绿素含量比相应光条件下的清水对照有提高趋势,自然光下CaCl2和SA处理植株的叶绿素含量比对照提高了1.43%、3.36%,弱光下CaCl2和SA处理植株的叶绿素含量比对照提高了1.38%、0.13%,但与对照差异都不显著。由此看出CaCl2和SA不能显著促进甜瓜叶绿素的合成。

图3 CaCl2和SA对弱光下甜瓜幼苗叶绿素含量的影响Fig.3 Effect of CaCl2 and SA treatments on chlorophyl content of melon seedling under low light intensity
2.3 CaCl2和SA对弱光下甜瓜幼苗光合能力的影响
表3看出,遮光处理后的甜瓜植株Pn和Gs明显下降,而Ci明显提高,Pn和Ci是分别是自然光处理(T1)的22.19%、143.67%,说明弱光胁迫致使甜瓜光合能力下降的原因主要是非气孔限制因素,气孔限制因素非常小;遮光植株的Tr变化不显著,水分利用效率明显降低。自然光下喷施CaCl2和SA后,Ci变化不显著,而Pn明显降低,比T1处理分别降低了37.43%、12.10%,说明正常光下外施两种物质对甜瓜植株的光合有一定的抑制作用;而在弱光条件下,CaCl2和SA处理使甜瓜的Ci浓度较对照显著降低,分别降低了20.98%、14.75%,Pn升高,尤其是SA处理显著提高了55.79%,说明弱光下外施两种物质对甜瓜植株的光合有一定的促进作用。两种光照下CaCl2和SA处理的植株与对照植株的Gs变化差异不大,而Tr降低尤其是弱光处理降低程度显著,T5、T6处理比T4对照分别降低了49.13%、44.45%;两种光照条件下喷施两种物质对植株的光合水分利用效率(WUE)影响不显著。

表3 CaCl2和SA对弱光下甜瓜幼苗光合能力的影响Table 3 Effect of CaCl2 and SA treatments on photosynthetic capacity of melon seedling under low light intensity
3 结论与讨论
甜瓜属喜光作物,弱光逆境对其生长发育和光合影响很大,降低植株的同化作用,限制营养生长,植株形态从而发生变化。本试验研究结果表明,连续7天的50%自然光照强度对甜瓜植株造成了伤害,甜瓜的叶长、叶宽、株粗、株高、地上干鲜重、地下干鲜重都明显降低,这与种培芳在甜瓜上的研究结论一致[13]。光照是影响叶绿体形成的主要因子,弱光下叶绿体个体变小,数目变少。本试验表明弱光胁迫下,甜瓜叶绿素含量明显降低,使光合能力和水分利用能力都明显降低。目前认为,因光照强度导致净光合速率下降的原因分为气孔限制和非气孔限制两类,Gs和Ci同时下降时,Pn下降主要由气孔限制引起的,若Pn的下降伴随着Ci升高,则主要限制因素为非气孔因素[14]。本试验结果显示弱光处理的甜瓜叶片Pn和Gs下降,而Ci上升,说明Pn显著下降主要受到非气孔限制因素的影响。同样,弱光胁迫下引起番茄[15]、烤烟[16]、黄瓜[17]Pn下降的主要原因是非气孔限制因素,而艾希珍等[17]研究指出黄瓜弱光亚适温下气孔限制与非气孔限制因素同时存在,气孔度下降和碳同化降低都是导致黄瓜Pn降低的重要原因。
3.1 氯化钙对弱光下甜瓜生长和光合的影响
Hepler等[18]研究认为,Ca2+作为细胞内第二信使,通过Ca-CaM信使系统稳定细胞膜双脂层的基本结构,保护膜的完整性;另外,在细胞内Ca2+与受体细胞结合后具有接受、传递和放大外界信号的功能,而且会引发一系列与增强抗逆性有关的生理反应,从而减轻逆境胁迫给植物造成的伤害,维持植物正常生长。本试验结果表明,弱光处理结合喷施Ca2+能明显缓解弱光对甜瓜生长的危害,植株的叶长、叶宽、叶厚和株粗达到自然光照条件下的水平;Ca2+处理还能提高两种光处理下的甜瓜生物量,弱光条件下比自然光照条件下植株生物量的积累效果更明显。与清水对照及自然光下Ca2+处理植株相比,弱光条件下Ca2+处理的甜瓜植株Ci和Gs有所下降,Pn升高,喷施钙植株的叶绿素含量与对照差异不显著,说明Ca2+处理引起甜瓜植株净光速率升高的原因非叶绿素变化导致,而是其它非气孔限制因素比如Ca2+处理提高了光合作用碳同化相关的酶活性等。弱光胁迫下番茄、黄瓜喷施外源钙能提高光合效率的原因同样也是因为提高了碳同化相关的酶活性[15]。弱光下Ca2+处理仍然使甜瓜植株维持较高的同化力和光合速率,明显降低弱光下植物的蒸腾速率,提高水分利用率,利于植物生长和生物量的积累。由此看出Ca2+能均衡甜瓜植株生长,使植株长势健壮,提高同化能力,改善受光姿态,从而提高了其耐弱光性,即Ca2+发挥了其在细胞结构方面的调控作用。
3.2 水杨酸对弱光下甜瓜的生长和光合的影响
本试验的SA处理对甜瓜弱光胁迫伤害的缓解作用较小,缓解效果不如外施钙明显,甜瓜生长指标与对照差异不明显,生物量积累效果较明显;与Ca2+处理一样促进叶绿素的合成效果不显著,SA处理明显使弱光下甜瓜Ci降低、Pn升高,Gs变化不显著,说明外源SA对气孔限制的改善作用非常小,主要是通过改善非气孔限制因素来提高光合效率,其可能机理也可能是通过提高光合酶活性以维持叶肉细胞较高的光合能力。SA调节弱光下光合功能的作用同样在烤烟[16]、黄瓜[17]等作物上发挥积极作用。
综上所述,弱光胁迫使甜瓜幼苗生长和叶绿素合成受到抑制,光合速率明显降低,均由非气孔限制因素导致。胁迫过程中,连续7 d喷施10 mmol/L CaCl2和1 mmol/LSA溶液后,发现两种溶液均能促进弱光胁迫下甜瓜幼苗的生长和利于光合效率的提高,就甜瓜生长情况来看,CaCl2缓解效果好于SA;但SA处理对于改善非气孔限制因子、提高甜瓜光合效率方面效果好于CaCl2处理。
参考文献:
[1] 安翠香,杨世梅,纪海波,等.遮荫对甜瓜叶片光合特性的影响[J].西北植物学报,2012,32(2):342-347.
[2] 孙玉萍,户金鸽,杨英,等.冬季弱光条件下不同厚皮甜瓜品种生理指标初探[J].新疆农业科学,2014,51(9):1597-1604.
[3] 董玉梅,焦自高,王崇启,等.低温弱光胁迫对网纹甜瓜嫁接苗与自根苗某些物质含量的影响[J].山东农业大学学报(自然科学版),2005,36(1):67-69.
[4] 耿新丽,张银欢,张翠环.弱光胁迫对不同甜瓜果实大小发育的影响[J].北方园艺,2015(14):27-30.
[5] 刘小龙,李霞,钱宝云,等.植物体内钙信号及其在调节干旱胁迫中的作用[J].西北植物学报,2014,34(9):1927-1936.
[6] 苗永美,王万洋,杨海林,等.外源Ca2+,SA和ABA缓解甜瓜低温胁迫伤害的生理作用[J].南京农业大学学报,2013(4):25-29.
[7] 周贺芳,邹志荣,孟长军,等.外源ALA、CaCl2和水杨酸对盐胁迫下甜瓜幼苗一些生理特性的影响[J].干旱地区农业研究,2007,25(4):212-215.
[8] 欧立军,刘周斌,杨博智,等.外源Ca2+连续喷施时间对辣椒淹水胁迫的缓解效应研究[J].西北植物学报,2016,36(10):2015-2021.
[9] 康国章,孙谷畴,王正询.水杨酸在植物抗环境胁迫中的作用[J].广西植物,2004,24(2):178-183.
[10] 张永平,陈幼源,杨少军,等.外源水杨酸对镉胁迫甜瓜幼苗生长与光合气体交换和叶绿素荧光特性的影响[J].西北植物学报,2014,34(4):778-785.
[11] 毕焕改,董绪兵,王美玲,等.钙和水杨酸对亚适温弱光下黄瓜幼苗光合酶活性和基因表达的影响[J].园艺学报,2015,42(1):56-64.
[12] 刘玉凤,董文阁,李天来.钙素配方对弱光影响番茄抗氧化酶活性及产量的补偿作用[J].沈阳农业大学学报,2013,44(6):738-742.
[13] FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].ANNUAL REVIEW OF PLANT PHYSIOLOGY,1982,33:317-345.
[14] 李益清,李天来.外源钙及钙抑制剂对番茄耐弱光特性的调控作用[J].西北农业学报,2011,20(8):121-126.
[15] WANG H, LIU G S, YUN F, et al. Effects of salicylic acid on photosynthesis and chlorophyll fluorescence characteristics of flue-cured tobacco leaf in subdued light[J]. AGRICULTURAL SCIENCE & TECHNOLOGY,2014,15(1):33-38.
[16] 刘伟,艾希珍,梁文娟,等.低温弱光下水杨酸对黄瓜幼苗光合作用及抗氧化酶活性的影响[J].应用生态学报,2009,20(2):441-445.
[17] 艾希珍,王秀峰,崔志峰,等.钙对弱光亚适温下黄瓜光合作用的影响[J].中国农业科学,2006,39(9):1865-1871.
[18] HEPLER P K,QAYHE P O. Calcium and plant development[J]. ANN REW PLANT PHYIOL,1995,36:569-573.

