市售蒲公英片HPLC特征图谱建立及其单咖啡酰酒石酸、菊苣酸含量测定
,3 ,3 ,3 ,5*
1.云南省昆虫生物医药研发重点实验室,云南 大理 671000;2.药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000;3.中国西南药用昆虫及蛛形类资源开发利用协同创新中心,云南 大理 671000;4.四川好医生药业集团,四川 成都 610000;5.云南民族大学南亚东南亚辐射研究中心,云南 昆明 650504
蒲公英又名婆婆丁、黄花地丁、黄花三七等,为菊科植物蒲公英TaraxacummongolicumHand.-Mazz、碱地蒲公英TaraxacumborealisinenseKitag.或同属数种植物的干燥全草。蒲公英中含有黄酮类、酚酸类、萜类、色素类植物甾醇类等化合物[1],具有抗炎、抑菌、保肝、抗肿瘤、抗氧化、降糖等作用[2-5],常用于治疗疔疮肿毒、乳痈、目赤、肺痈、肠痈、湿热黄疸和热淋涩痛等症[6]。蒲公英片是以蒲公英水提醇沉干浸膏制得,具有清热解毒的功效,主要用于咽喉肿痛(急性扁桃体炎)、疮疖[1],收载于部颁标准中药成方制剂第三册,但该标准中未对蒲公英片做相关的含测要求,对该品种的质量控制缺乏全面性和客观性[7]。中药特征图谱可以通过系统性、整体性和特征性等特点评价蒲公英中所含化学成分的种类及数量,对于蒲公英片的质量控制具有重要意义[8]。近年来,有部分关于蒲公英药材的特征图谱研究相继报道,分别以其药材中绿原酸、咖啡酰、阿魏酸、芦丁、木犀草素等常见酚酸类化学成分进行特征图谱指认[9-10],但是尚未建立蒲公英片主要特征峰的HPLC特征图谱及含量测定方法。
笔者对市售7个厂家的蒲公英片展开特征图谱研究,采用“中药特征图谱相似度评价系统”(2012版)对其进行相似度评价,并首次确认蒲公英片特征图谱中的特征峰单咖啡酰酒石酸和菊苣酸,对其进行含量测定,为蒲公英片的质量控制提供参考,同时为后续药理活性研究提供参考依据。
1 仪器与材料
1.1 仪器 BSA124S分析天平(赛多利斯科学仪器有限公司);AKSW-V-16艾柯实验室超纯水机(成都艾柯水处理设备有限公司);Agilent 1260型高效液相色谱系统(美国Agilent 公司);Sepax Gp-C18色谱柱(4.6×250mm,5μm,美国赛分); 已腈、三氟乙酸为色谱纯,水为超纯水,其他试剂均为分析纯。
1.2 材料 对照品菊苣酸(批号:20140704,99.3%,中国计量科学研究院);单咖啡酰酒石酸(批号:PRF8052505,纯度>98%,成都柯瑞法科技开发有限公司)。市售7个厂家的蒲公英片,均执行部颁标准中药成方制剂第三册WS3-B-0648-91,标示量均为每片含干浸膏0.3克,分别产自河南A厂(批号:1607023)、河南B厂(批号:160509)、河南C厂(批号:160301)、河南D厂(批号:160305)、广西E厂(批号:150420)、山西F厂(批号:20151002)、吉林G厂(批号:04160303)。
2 方法与结果
2.1 单咖啡酰酒石酸与菊苣酸含量测定
2.1.1 混合对照品溶液的制备 精密称取单咖啡酰酒石酸5.1 mg、菊苣酸5.0 mg于25 mL棕色量瓶中,加入超纯水定容至刻度,摇匀,即得204 μg/mL的单咖啡酰酒石酸和200 μg/mL菊苣酸的对照品溶液,分别取混标溶液0.5、1、2、4、6、8、10 mL于10 mL量瓶中,加入超纯水定容致刻度线,摇匀,既得系列标准品溶液。
2.1.2 供试品溶液的配制 取各厂家蒲公英片20片,去除包衣后研碎,精密称取该粉末400.0 mg于具塞锥形瓶中,精密加入70 %乙醇10 mL,称重,超声处理(功率300 W,频率54 Hz)30 min,放冷,称重,用70%乙醇补足差重,摇匀,过滤,取续滤液1.0 mL过0.22 μm微孔滤膜,即得浓度为40 mg/mL供试品溶液。
2.1.3 色谱条件 色谱柱:Sepax Gp-C18(4.6×250 mm,5μm);流速1.0 mL/min;检测波长:323 nm;柱温:40 ℃;进样量:10 μL;流动相A为0.1%三氟乙酸-乙腈,流动相B为0.1%三氟乙酸-水,洗脱梯度:0~13 min,11%A 等梯度洗脱;14~22 min,17%A等度洗脱;22~29 min,17%~27%A梯度洗脱;29~43 min,27%~34%A梯度洗脱;43~50 min,34%~95%A梯度洗脱。理论塔板数按菊苣酸峰计算应不低于4000。取混合对照品溶液、空白溶液及供试品溶液进样检测,结果表明,供试品及混合标准品中各峰分离度及对称性良好,色谱图如图1所示。
2.1.4 线性关系试验 取系列标准品溶液10 μL进样,测定其峰面积。以峰面积为纵坐标,对照品浓度为横坐标(μg),绘制标准曲线,计算单咖啡酰酒石酸和菊苣酸的线性回归方程及相关系数见表1。
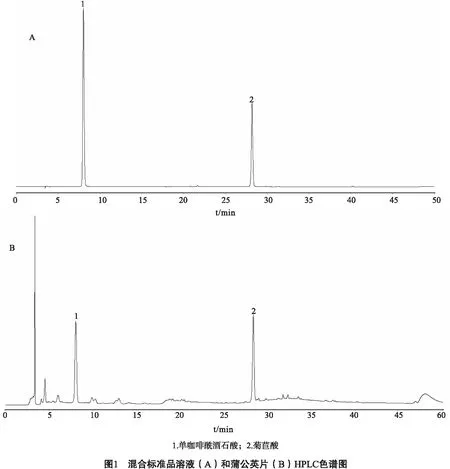
表1 单咖啡酰酒石酸、菊苣酸的回归方程、相关系数及线性范围

待测成分回归方程r线性范围/μg单咖啡酰酒石酸Y=2857 3X-27 210 999910 2~204 0菊苣酸Y=2899 2X-29 170 999910 00~200 0
2.1.5 精密度试验 取混合对照品溶液,进样10 μL,连续进样6次,记录峰面积。结果显示单咖啡酰酒石酸和菊苣酸的峰面积的RSD分别为1.09%、1.44%,表明精密度良好。
2.1.6 重复性试验 取山西F厂(批号:20151002)蒲公英片,各精密称量6份,按2.1.2项下配制供试品溶液,分别进样10 μL,记录峰面积并代入表1标准方程计算样品中单咖啡酰酒石酸和菊苣酸的含量(μg/mg)。结果显示单咖啡酰酒石酸和菊苣酸的平均含量分别为1.43 μg/mg、1.29 μg/mg,RSD值分别为0.99%、1.09%,表明重复性良好。
2.1.7 稳定性试验 取山西F厂(批号:20151002)蒲公英片供试品溶液,分别于室温下放置0、4、8、12、16、20、24 h进行进样分析,记录峰面积。结果显示24 h内单咖啡酰酒石酸峰面积的RSD为0.67%;菊苣酸峰12h内的面积的RSD为0.61%,即供试品溶液在室温条件下12 h内稳定。
2.1.8 加样回收试验 取山西F厂(批号:20151002)蒲公英片,各精密称量6份,精密加入对照品溶液,按2.1.2项下配制供试品溶液,测定单咖啡酰酒石酸和菊苣酸的含量,计算回收率,结果见表2。
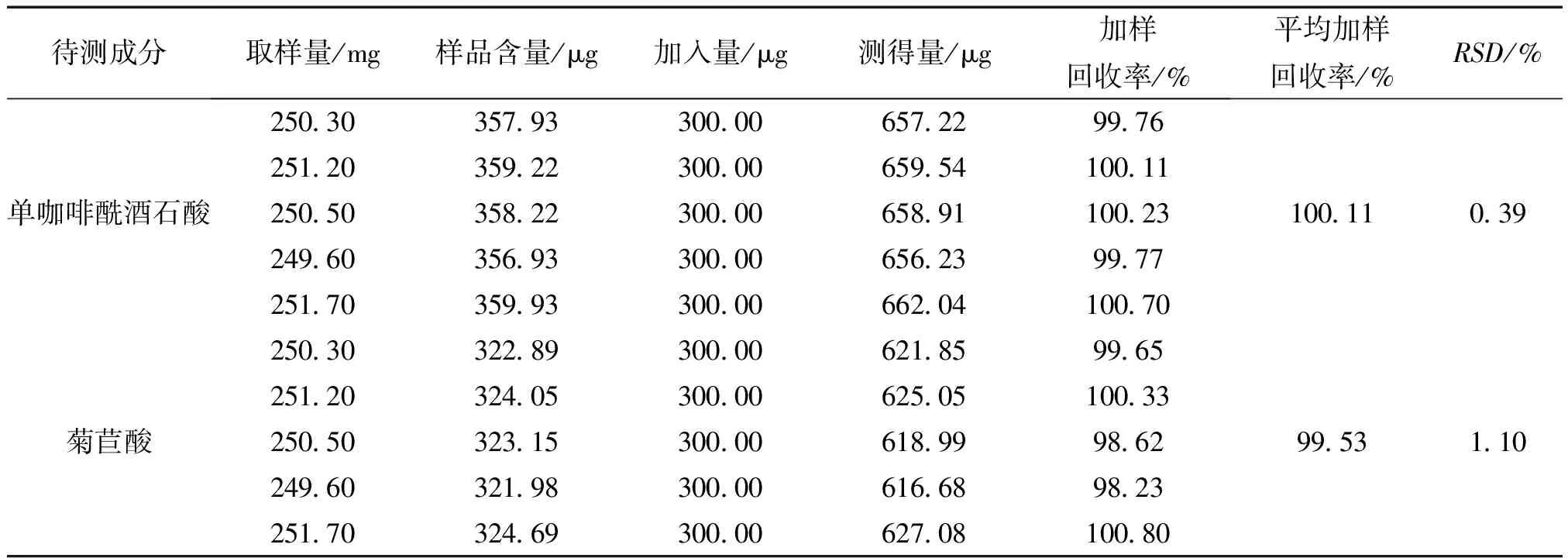
表2 蒲公英片中单咖啡酰酒石酸、菊苣酸的加样回收实验 (n=6)
2.1.9 供试品测定 取7个厂家的蒲公英片,按“2.1.2”项下方法配置供试品溶液,精密吸取各供试品溶液10 μL,按“2.1.3”项下色谱条件记录单咖啡酰酒石酸和菊苣酸的峰面积,并计算其含量,见表3。
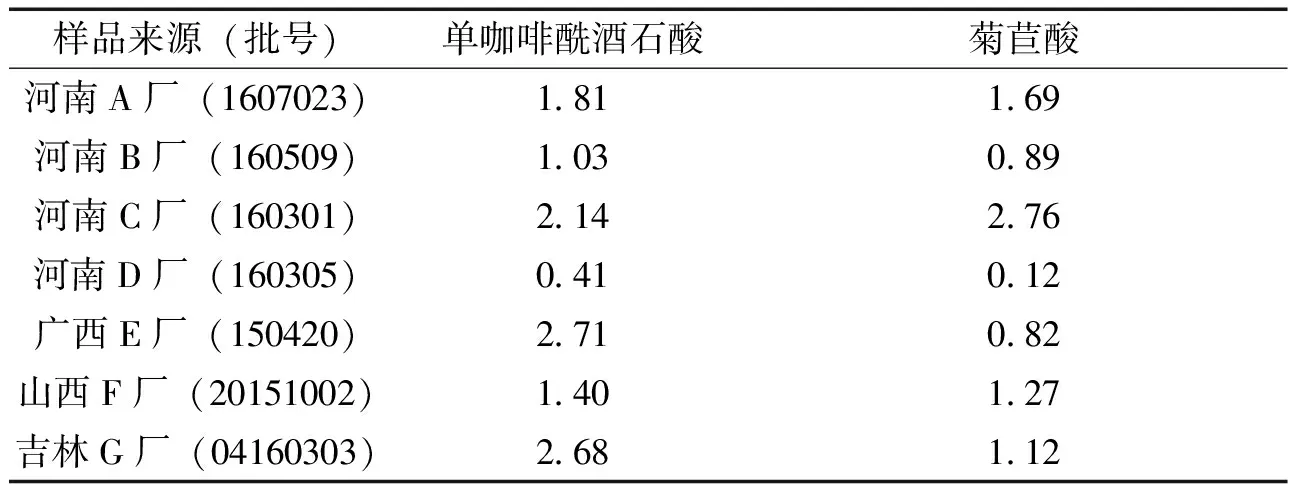
表3 不同厂家蒲公英片中单咖啡酰酒石酸和菊苣酸的含量测定 (mg/g)
2.2 特征图谱的测定与相似度分析
2.2.1 色谱条件 色谱柱:Sepax Gp-C18(4.6×250mm,5μm);流速:1.0 mL/min;检测波长:323 nm;柱温:40 ℃;流动相A为0.1%三氟乙酸-乙腈,流动相B为0.1%三氟乙酸-水,洗脱梯度:0~13 min,11%A 等梯度洗脱;14~22 min,17%A等度洗脱;22~29 min,17%~27%A梯度洗脱;29~43 min,27%~34%A梯度洗脱;43~50 min,34%~95%A梯度洗脱。
2.2.2 精密度实验 取山西F厂(批号:20151002)蒲公英片,各精密称量1份,按“2.1.2”项下配制供试品溶液,平行测定6次,以单咖啡酰酒石酸峰和菊苣酸峰为参照峰,计算其余各特征峰的相对保留时间和相对峰面积。结果各特征峰相对峰面积和相对保留时间无明显变化,RSD<2%,符合HPLC特征图谱检验要求,表明仪器精密度良好。
2.2.3 稳定性实验 取山西F厂(批号:20151002)蒲公英片供试品溶液,分别于室温下放置0、4、8、12、16、20、24 h进行进样分析,记录峰面积。以单咖啡酰酒石酸峰和菊苣酸峰为参照峰,计算其余各特征峰的相对保留时间和相对峰面积。结果各特征峰相对峰面积和相对保留时间在12 h内无明显变化,RSD<2%,表明供试品溶液在室温条件下12 h内稳定。
2.2.4 重复性实验 取山西F厂(批号:20151002)蒲公英片,各精密称量6份,按“2.1.2”项下配制供试品溶液,平行测定,以单咖啡酰酒石酸峰和菊苣酸峰为参照峰,计算其余各特征峰的相对保留时间和相对峰面积。结果各特征峰相对峰面积和相对保留时间无明显变化,RSD<2%,符合HPLC特征图谱检验要求,表明重复性良好。
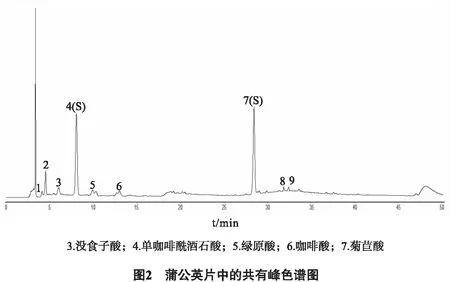
2.2.5 蒲公英片特征图谱测定 按“2.1.3”项色谱条件对7个厂家生产的蒲公英片进行测定,记录色谱图,见图2。采用“中药特征图谱相似度评价系统(2012版)”软件得出色谱峰1~9为7个不同厂家蒲公英片的共有峰,依次确认色谱峰1~9为蒲公英片的特征峰,并且在相同HPLC条件下,3、4、5、6、7的保留时间分别与没食子酸、单咖啡酰酒石酸、绿原酸、咖啡酸、菊苣酸对照品的保留时间一致,其中单咖啡酰酒石酸和菊苣酸分离度较好,且含量较高、稳定,故选择单咖啡酰酒石酸和菊苣酸为参照峰(S)。
2.2.6 特征图谱的相关性分析 将“2.2.1”项下所得色谱数据导入“中药特征图谱相似度评价系统(2012版)”软件,采用多点校正将谱峰自动匹配,平均数法设置参照图谱,峰匹配模式得出样品特征谱图的共有峰,并计算相似度,结果见图3和表4。由表4可见,7个厂家生产的蒲公英片中,除河南D厂样品相似度为0.831外,其余样品相似度均>0.90,差异不明显,并且1~9色谱峰在7个厂家生产的蒲公英片中均能全部检出,表明各厂家生产的蒲公英片成分相关性良好,该色谱条件建立的蒲公英片的特征图谱指标稳定。
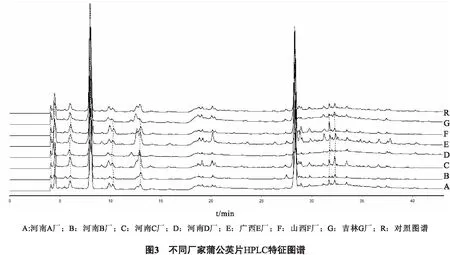

表4 蒲公英片特征图谱的相似度评价结果
3 讨论
3.1 单咖啡酰酒石酸和菊苣酸作为指标峰用于蒲公英片的特征图谱 在蒲公英原料药材及其制剂的相关报道检索中少见有对单咖啡酰酒石酸和菊苣酸的报道[11],实验发现在蒲公英片中,单咖啡酰酒石酸和菊苣酸有较高的含量、特征性良好,故选取单咖啡酰酒石酸和菊苣酸作为蒲公英片的含测指标及蒲公英片特征图谱的指标峰。结果表明,蒲公英片在0.1%的TFA乙腈和0.1%TFA水作为流动相时具有较好的分离效果,能够保证样品良好的分离度和出峰数。特征图谱研究中发现,蒲公英片中富含酚酸类物质,其中没食子酸、单咖啡酰酒石酸、绿原酸、咖啡酸、菊苣酸的含量较高,且均为咖啡酸类衍生物,故选取咖啡酸的特征吸收波长323 nm作为检测波长,且在该波长下各峰分离度良好,特征性强,峰数目较多。
3.2 市售7个厂家蒲公英片的特征图谱比较分析 对比分析7个厂家的蒲公英片发现,除河南D厂外,其余6个厂家的蒲公英片具有较高的相似度。通过“中药特征图谱相似度评价系统(2012版)”软件进行峰匹配发现7个厂家生产的蒲公英片中均含有没食子酸、单咖啡酰酒石酸、绿原酸、咖啡酸、菊苣酸,且单咖啡酰酒石酸和菊苣酸含量较高,特征性明显,特征指纹峰的相对保留时间一致,表明该方法用于蒲公英片的特征图谱具有较高的稳定性。河南D厂相似度相对较低可能是原料药材的选取、原料药材的质量控制或原料药材的采收季节、产地、储存方式等方面的原因,但缺乏实验论证。
3.3 单咖啡酰酒石酸和菊苣酸的含量比较 《中国药典》2015版仅在蒲地蓝消炎口服液中有测定蒲公英中菊苣酸含量的记载,尚无单咖啡酰酒石酸的相关指标考察[7]。研究表明,蒲公英中的单咖啡酰酒石酸和菊苣酸具有增强免疫、抗炎、抗氧化等作用[11]。测定蒲公英片中单咖啡酰酒石酸和菊苣酸含量发现,河南D厂生产的片剂中单咖啡酰酒石酸和菊苣酸含量分别为0.39 mg/g和0.12 mg/g,其余6个厂家的蒲公英片中单咖啡酰酒石酸和菊苣酸含量均高于1.00 mg/g和0.80 mg/g,这可能也是导致河南D厂与其余6厂相似度差别较大的原因之一。单咖啡酰酒石酸和菊苣酸在蒲公英片中有较高的含量和明显的HPLC特征图谱,因此,可将单咖啡酰酒石酸和菊苣酸作为蒲公英及其相关制剂的质量控制指标之一,但是单咖啡酰酒石酸和菊苣酸的含量与蒲公英片的疗效之间的关系尚需药理实验加以证实。
参考文献
[1]李超,董自波,蒋金来,等. HPLC法测定蒲公英中菊苣酸,咖啡酸与绿原酸[J].中草药, 2015, 46(23): 3577-3580.
[2] 肖潮勇,张宇,王宇亮.蒲公英总多糖的提取,纯化及其体外抗炎活性分析[J].中国实验方剂学杂志, 2016, 22(11): 25-28.
[3] 任丽平, 杜钢军, 崔新萍. 蒲公英对酒精性肝损伤的影响[J]. 中国实验方剂学杂志, 2011, 17(11): 179-181.
[4] 刘磊磊, 陈娟, 师彦平. 清热解毒中药抗肿瘤作用研究进展[J]. 中草药, 2012, 43(6): 1203-1212.
[5] 李雪石, 张彦文. 蒲公英水提取物对链脲佐菌素致糖尿病大鼠的降血糖作用及其机制[J]. 中草药, 2013, 44(7): 863-868.
[6] 张咏梅,张淑慧,王朝卿,等.不同产地蒲公英中总黄酮的测定[J]. 中草药, 2009, 40(2): 169-170
[7] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015.
[8] 田宇柔,甄亚钦,王鑫国,等.半枝莲配方颗粒HPLC指纹图谱及含量测定方法研究[J].中国药学杂志, 2016, 51(20):1795-1799.
[9]李喜凤,孟璐,陈随清.蒲公英药材高效液相色谱特征图谱研究[J].中国医院药学杂志,2010(8):643- 645.
[10]苏英,彭章明,刘燕,等.宜宾地区蒲公英药材HPLC特征图谱定性研究[J].中国药学杂志, 2009 (24): 1858-1861.
[11] 占远,黎田儿,黄文平,等. HPLC法同时测定二丁颗粒中的单咖啡酰基酒石酸,秦皮乙素和菊苣酸[J]. 中成药, 2015,37(10):2190-2193.

