CaSR对过氧化氢作用后心肌细胞活性和凋亡影响
闫世林,罗永百,朱浩锋,徐超
研究显示,动脉粥样硬化、心肌梗死、缺血再 灌注、高血压等心血管疾病的发生均与组织中氧自由基有关,正常组织中氧自由基不仅在维持正常氧化平衡状态中有重要作用,在细胞信号转导过程中也发挥重要作用[1-3]。当机体内出现氧化损伤时,细胞内正常的蛋白质、脂质等受到破坏,致细胞功能受损,引起细胞凋亡发生[1-3]。钙超载、细胞凋亡增加等均与心肌细胞氧化损伤有关[4]。钙敏感受体(CaSR)在心肌细胞中表达,能维持细胞内钙离子及其他相关金属离子的稳定,对细胞生长、凋亡等有调节作用[5,6]。研究显示,在缺血再灌注损伤中,心肌细胞中CaSR表达上调,并且与心肌组织氧化损伤和凋亡有关[7]。本研究用过氧化氢处理心肌细胞构建心肌细胞氧化损伤模型,用CaSR抑制剂处理心肌细胞,探讨CaSR在过氧化氢心肌细胞活性和凋亡中的作用,以期为探讨CaSR在心血管疾病中的作用奠定基础。
1 材料与方法
1.1 实验材料 大鼠心肌细胞H9C2购自于中国科学院细胞库。RNA提取试剂盒为北京天根产品;蛋白提取试剂盒为美国Thermo产品;二喹啉甲酸(BCA)蛋白浓度检测试剂盒为北京solarbio产品;CaSR抑制剂(NPS2300)为美国MedChemExpress产品;CaSR、甘油醛-3-磷酸脱氢酶(GAPDH)引物由南京金斯瑞合成;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)多克隆抗体、信号转导与转录因子3(STAT3)多克隆抗体、磷酸化信号转导与转录因子3(p-STAT3)多克隆抗体均为美国Abcam产品;丙二醛(MDA)含量检测试剂盒 、超氧化物歧化酶(SOD)含量检测试剂盒为碧云天生物研究所产品;乳酸脱氢酶(LDH)含量检测试剂盒为美国Sigma产品。
1.2 心肌细胞培养 H9C2细胞从液氮中取出以后,迅速放在37℃的水浴中,观察细胞完全融化后,加入细胞培养液(含有10%胎牛血清的DMEM),种植到细胞培养瓶,培养条件为:37℃,5% CO2培养箱。培养2~3 d后,倒置显微镜下观察细胞生长至90%,进行细胞传代。传代方法如下:弃培养液上清,磷酸盐缓冲液(PBS)洗涤2次,每个细胞瓶中加入适量的0.25%的胰蛋白酶,使胰蛋白酶能够全部覆盖细胞,在37℃消化1 min。加入细胞培养液,根据实验需求把细胞按照不同比例接种到细胞培养瓶中继续培养。
1.3 细胞分组 H9C2细胞培养至对数期后,用200 μmol/L过氧化氢处理细胞6 h,记为模型组,同时以正常培养不加过氧化氢处理的H9C2细胞为对照组。大鼠心肌细胞H9C2经过40 nM的CaSR抑制剂(NPS2300)作用后12 h再用200 μmol/L过氧化氢处理6 h记为抑制剂组。
1.4 荧光定量PCR检测CaSR水平 取各组细胞,按照每一个50 ml的细胞培养瓶加入1 ml的Trizol放在冰上裂解10 min。加入200 μl的氯仿溶液,震荡反应15 s后,在冰上静置5 min。4℃,12000×g离心10 min,用移液枪吸取上层水相溶液,加入500 μl的异丙醇溶液,混匀后,室温条件下静置10min。4℃,12000×g离心10 min,用75%的乙醇溶液洗涤两次,在RNA沉淀中加入20μL的DEPC(焦碳酸二乙酯)水溶解后保存在-80℃。取1 μg的RNA合成cDNA,步骤参照反转录试剂盒说明书。荧光定量PCR检测CaSR水平,以GAPDH为内参。实验重复3次,取均值。
CaSR上游引物为5,-TTCGGCATCAGCTTTG TG-3’,下游引物5,-TGAAGATGATTTCGTCTTCC-3’。GAPDH上游引物为5,-CGGAGTCAACGGAT TTGGTCGTAT-3’,
下游引物5,-AGCCTTCTCCATGGTGGTGAA GAC-3’。
1.5 噻唑蓝(MTT)检测细胞增殖活性 取对照组、模型组、抑制剂组细胞,按照每一个96孔板中加入20 μl的MTT溶液(5 mg/ml),放在37℃培养4 h,将上清液吸除后,每孔中加入150 μl的二甲基亚砜,震荡混合10 min,酶标仪检测490 nm每孔的光密度值(OD值),每组设置6个复孔,重复3次,取均值。
1.6 流式细胞术检测细胞凋亡 取对照组、模型组、抑制剂组细胞,加入蛋白酶消化,收集各组细胞,1000×g离心10 min,弃上清液,用PBS把细胞浓度调整为4×105个/ml。取1 ml的细胞悬浮液,1000×g离心10 min后,与200μL的Binding Buffer混合,依次加入10 μl膜联蛋白 V-FITC和碘化丙啶(PI)5 μl,放置于室温,避光反应15 min,再加入300 μl缓冲液混合后,流式细胞仪检测细胞凋亡情况。
1.7 LDH、MDA 、SOD水平检测 取对照组、模型组、抑制剂组细胞和培养液上清,分别用二硝基苯肼显色法LDH含量检测试剂盒检测培养液上清中LDH水平,用硫代巴比妥酸法检测MDA水平,黄嘌呤氧化酶法检测SOD水平,步骤参照试剂盒说明书。
1.8 Western blot检测Cleaved Caspase-3、STAT3、p-STAT3水平 取对照组、模型组、抑制剂组细胞,在每个50 ml细胞培养瓶中依次加入80 μl裂解液(PMSF和RIPA按照1:100体积比混合)进行细胞裂解,4℃,12000×g离心10 min,吸取蛋白上清溶液,保存于-80℃。用BCA蛋白定量试剂盒检测蛋白浓度。在80 V恒压条件下电泳,肉眼观察溴酚蓝到达距离玻璃板底时停止电泳。在60 mA,4℃转膜80 min。封闭:5%牛
血清白蛋白,室温反应2 h。一抗结合:加入一抗(Cleaved Caspase-3按照1:600稀释、STAT3按照1:800稀释、p-STAT3按照1:600稀释),在4℃反应过夜。二抗结合:放在1:2000倍稀释的二抗中,室温孵育2 h。显色,曝光后,用ImageJ对蛋白进行定量分析,以GAPDH为内参。
1.9 统计学分析 所有实验数据采用SPSS21.0软件进行分析,计量资料用(±s)表示,多组比较采用单因素方差分析,组间比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞中CaSR水平比较 对照组、模型组、抑制剂组细胞中CaSR mRNA水平为:1.00±0.12、1.95±0.17、1.42±0.14。模型组、抑制剂组CaSR mRNA水平高于对照组,差异具有统计学意义(P=0.000)。抑制剂组CaSR mRNA水平低于模型组,差异具有统计学意义(P=0.000)。过氧化氢作用后的心肌细胞中CaSR表达上调,而CaSR抑制剂能够抑制过氧化氢诱导的心肌细胞中CaSR表达上调,见表1。
2.2 各组细胞增殖活性和凋亡比较 对照组、模型组、抑制剂组细胞OD值为:0.48±0.04、0.21±0.02、0.36±0.03,细胞凋亡率依次为:(5.92±0.98)%、(39.25±7.16)%、(21.72±1.38)%。模型组、抑制剂组OD值低于对照组,差异具有统计学意义(P=0.000)。抑制剂组OD值高于模型组,差异具有统计学意义(P=0.000)。模型组、抑制剂组细胞凋亡率高于对照组,差异具有统计学意义(P=0.000)。抑制剂组细胞凋亡率低于模型组,差异具有统计学意义(P=0.000)。过氧化氢作用后的心肌细胞增殖活性降低,细胞凋亡增加,而CaSR抑制剂能够减弱过氧化氢诱导的心肌细胞凋亡,见图1、表2。
2.3 各组LDH、MDA 、SOD水平比较 对照组、模型组、抑制剂组LDH水平为:(136.25±17.03)U/L、(342.87±29.64)U/L、(285.46±21.45)U/L,MDA 水平为:(1.58±0.19)nmol/mg、(2.74±0.31)nmol/mg、(2.11±0.13)nmol/mg,SOD水平为:(86.22±8.36)U/mg、(27.49±2.33)U/mg、(48.26±4.27)U/mg。模型组、抑制剂组LDH、MDA水平高于对照组,差异具有统计学意义(P=0.000)。抑制剂组LDH、MDA水平低于模型组,差异有统计学意义(P=0.000)。模型组、抑制剂组SOD水平低于对照组,差异有统计学意义(P=0.000)。抑制剂组SOD水平高于模型组,差异有统计学意义(P=0.000)。过氧化氢能够造成心肌细胞氧化损伤,而CaSR抑制剂能够减弱过氧化氢诱导的心肌细胞氧化损伤,见表3。
表1 各组细胞中CaSR mRNA水平(±s)
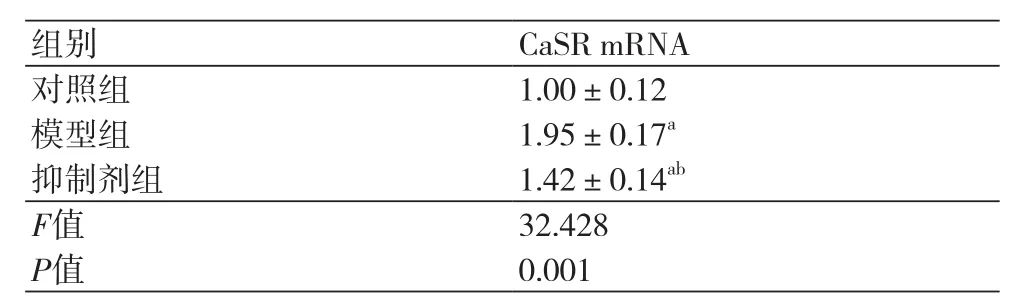
表1 各组细胞中CaSR mRNA水平(±s)
注:与对照组比较,aP<0.05 ;与模型组比较,bP<0.05
组别 CaSR mRNA对照组 1.00±0.12模型组 1.95±0.17a抑制剂组 1.42±0.14ab F值 32.428 P值 0.001
2.4 各组Cleaved Caspase-3、STAT3、p-STAT3水平比较 对照组、模型组、抑制剂组Cleaved Caspase-3水平为:0.25±0.03、1.89±0.17、1.24±0.11,STAT3水平为:1.64±0.13、1.68±0.16、1.65±0.14,p-STAT3水平为:0.75±0.06、0.21±0.02、0.32±0.03。模型组、抑制剂组Cleaved Caspase-3水平高于对照组,差异有统计学意义(P=0.000)。抑制剂组Cleaved Caspase-3水平低于模型组,差异有统计学意义(P=0.000)。模型组、抑制剂组p-STAT3水平低于对照组,差异有统计学意义(P=0.000)。抑制剂组p-STAT3水平高于模型组,差异有统计学意义(P=0.000)。过氧化氢能够抑制心肌细胞中STAT3磷酸化,而CaSR抑制剂能够部分拮抗过氧化氢对心肌细胞STAT3磷酸化水平影响,见图2和表4。
3 讨论
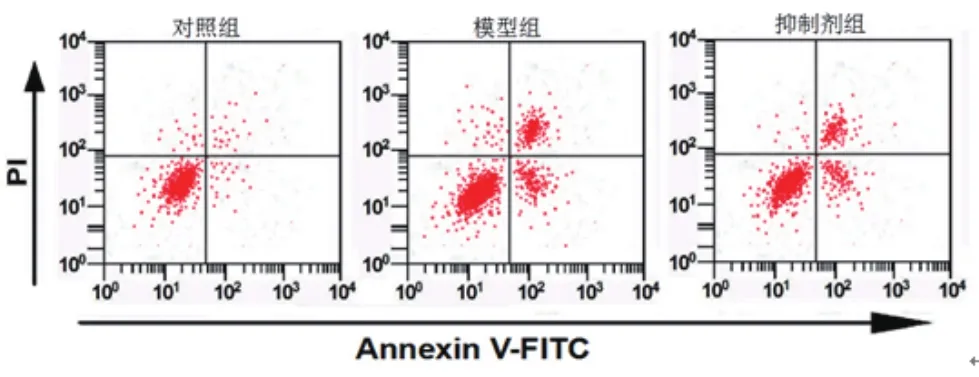
图1 流式细胞术检测细胞凋亡结果

表2 各组细胞OD值和细胞凋亡率
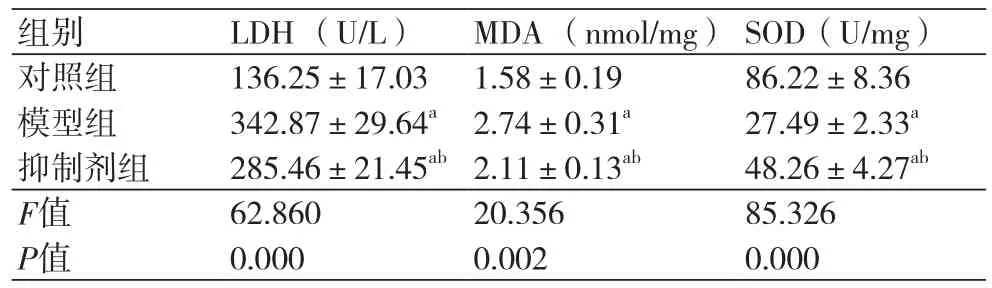
表3 各组LDH、MDA 、SOD水平
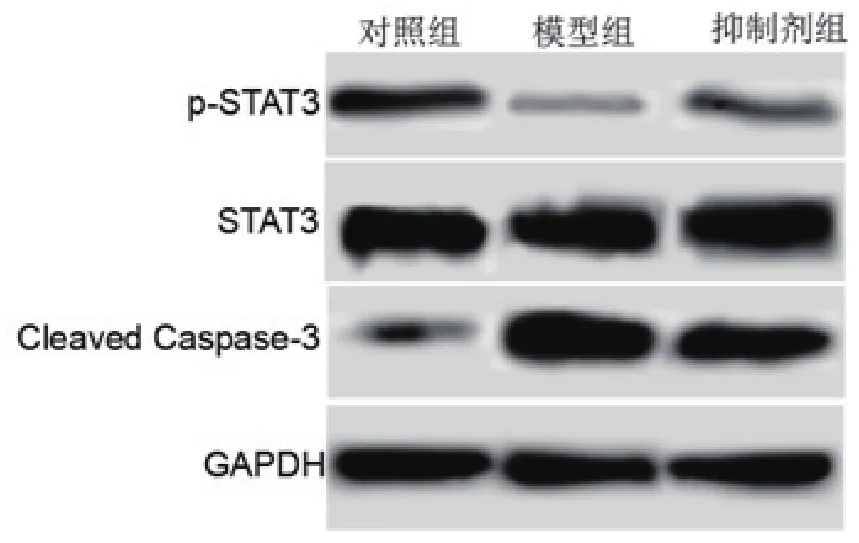
图2 Cleaved Caspase-3、STAT3、p-STAT3水平检测结果
表4 各组Cleaved Caspase-3、STAT3、p-STAT3水平(±s)
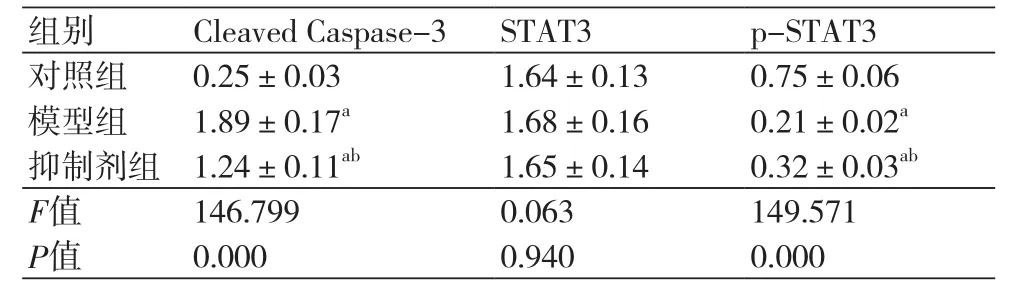
表4 各组Cleaved Caspase-3、STAT3、p-STAT3水平(±s)
注:与对照组比较,aP<0.05 ;与模型组比较,bP<0.05
组别 Cleaved Caspase-3 STAT3 p-STAT3对照组 0.25±0.03 1.64±0.13 0.75±0.06模型组 1.89±0.17a 1.68±0.16 0.21±0.02a抑制剂组 1.24±0.11ab 1.65±0.14 0.32±0.03ab F值 146.799 0.063 149.571 P值 0.000 0.940 0.000
CaSR参与缺氧复氧心肌细胞凋亡过程,用CaSR激动剂处理后降低心功能,加重心肌损伤[8]。在缺血再灌注心肌损伤中,氧化应激导致的心肌组织损伤是其损害正常心功能的重要途径[9]。目前对于CaSR调控心肌细胞凋亡机制的研究尚不十分清楚,线粒体途径、内质网应激、死亡受体途径等是其可能的作用机制[10]。CaSR参与G蛋白-PLC-IP3导致的钙离子超载进而引发线粒体损伤和内质网应激,最终激活Caspase级联反应,活化Caspase-3诱导细胞凋亡发生,另外CaSR还能够调控细胞内丝裂原活化蛋白激酶(MAPK)、c-Jun氨基末端激酶(JNK)、磷脂酰肌醇-3激酶(PI3K)等多种信号通路调控心肌细胞凋亡[11,12]。本研究发现,用过氧化氢处理后的心肌细胞中CaSR水平升高,而用CaSR抑制剂(NPS2300)处理后能够成功降低心肌细胞中CaSR水平,本研究结果同之前的研究报道一致,说明CaSR参与心肌细胞氧化应激过程。
正常情况下,机体处于氧化平衡状态,当机体内受到炎症因子、内毒素等刺激后会引起细胞内的氧自由基大量聚集,导致存在于细胞膜上的脂质发生过程氧化,使细胞膜通透性发生改变,原来存在于细胞内的LDH外漏,MDA是不饱和脂肪酸过氧化的产物,其在细胞氧化损伤中表达上调[13,14]。SOD在维持细胞内氧化平衡状态中具有重要作用,能够清除细胞内的超氧阴离子,保护细胞免受氧化损伤[15]。本结果显示,过氧化氢处理后的心肌细胞中MDA水平升高,细胞培养液中LDH水平也升高,而细胞中的SOD水平下降,说明过氧化氢能够诱导心肌细胞氧化损伤,而CaSR抑制剂(NPS2300)处理可缓解心肌细胞氧化损伤,抑制CaSR可降低心肌细胞氧化损伤。
氧化应激会引起细胞凋亡的发生,并且与细胞内多种信号通路的转导有关。Caspase级联反应激活后促进细胞凋亡的发生,而Caspase-3作为Caspase蛋白家族成员之一,其活化后可以生成Cleaved Caspase-3,发挥凋亡执行的作用[16,17]。STAT3信号通路在生物机体内广泛表达,其磷酸化水平升高后标志着STAT3信号通路激活,发挥凋亡抑制的作用[18]。研究表明,CaSR参与心肌细胞凋亡的发生与细胞内Caspase级联反应和STAT3信号通路有关[19,20]。本研究结果显示,过氧化氢作用后的心肌细胞中Cleaved Caspase-3水平升高,细胞凋亡增多,细胞活性降低,STAT3磷酸化水平也降低,而用CaSR抑制剂(NPS2300)处理后细胞中Cleaved Caspase-3部分降低,细胞凋亡减少,STAT3磷酸化水平有所升高,CaSR可能通过促进STAT3信号通路激活从而调控心肌细胞凋亡和氧化应激,而对于其具体的作用机制仍需要进一步验证。
综上,过氧化氢诱导心肌细胞凋亡,降低细胞增殖活性,诱导细胞氧化损伤,而抑制CaSR可以减弱心肌细胞凋亡,增加细胞增殖活性,降低细胞氧化损伤,其作用机制可能与STAT3信号通路的激活有关。本研究只在体外细胞试验中进行了初步探讨,在后续试验中会继续探讨CaSR在体内心肌组织细胞凋亡中的作用,对于其与信号通路的关系需继续验证,本研究明确了CaSR参与心肌细胞氧化应激,与心肌细胞凋亡有关,为后续探讨CaSR在心血管疾病中的作用奠定基础。
参 考 文 献
[1]Zhao Q,Li Z,Ding Y,et al. Effects of tyrosine oxidation products on redox state in myocardium of rats[J]. Wei sheng yan jiu = Journal of hygiene research, 2015,44(4):407-10.
[2]El-Deeb MEE, Abd-El-Hafez AAA. Can vitamin C affect the KBrO 3, induced oxidative stress on left ventricular myocardium of adult male albino rats? A histological and immunohistochemical study[J].Journal of Microscopy & Ultrastructure,2015,3(3):120-36.
[3]Dzugkoeva FS,Mozhaeva IV,Dzugkoev SG,et al. Oxidative Stress and Biochemical Markers of Endothelial Dysfunction and Organ Damage under Conditions of Experimental Nonferrous Metal Intoxication[J].Bulletin of Experimental Biology & Medicine,2016,162(2):1-4.
[4]Ma S,Wang Y,Chen Y,et al. The role of the autophagy in myocardial ischemia/reperfusion injury[J]. Biochimica Et Biophysica Acta,2015,1852(2):271-6.
[5]Zhang B,Zhi-Hui XU. VEGF165 reduced apoptosis by regulation of CaSR expression in ischemia/reperfusion cardiomyocytes[J]. Chinese Journal of Clinical Pharmacology & Therapeutics,2011,16(1):26-32.
[6]Yan L,Zhu TB,Wang LS,et al. Inhibitory effect of hepatocyte growth factor on cardiomyocytes apoptosis is partly related to reduced calcium sensing receptor expression during a model of simulated ischemia/reperfusion[J]. Molecular Biology Reports,2011,38(4):2695-701.
[7]张伟华,傅松滨,吴博,等. 钙敏感受体参与心肌缺血再灌注损伤诱发细胞凋亡的机制[J]. 中华地方病学杂志,2007,26(4):364-6.
[8]Jiang CM,Han LP,Hong-Zhu LI,et al. Expression of calcium sensing receptor during ischemia/reperfusion myocardial damage and relationship between CaSR and injury of myocardium[J]. Chinese Journal of Pathophysiology,2007,23(6):1084-7.
[9]Li Y,Zhong D,Lei L,et al. Propofol Prevents Renal Ischemia-Reperfusion Injury via Inhibiting the Oxidative Stress Pathways[J].Cellular Physiology & Biochemistry International Journal of Experimental Cellular Physiology Biochemistry & Pharmacology,2015,37(1):14-26.
[10]Yan L,Zhu TB,Wang LS,et al. Hepatocyte growth factor attenuates ischemia/reperfusion induced cardiomyocyte apoptosis via downregulating calcium sensing receptor expression.[J]. Chinese journal of cardiovascular diseases,2010,38(11):1019-24.
[11]Chang-Qing XU,Zhang WH. Investigation progress of CaSR in cardiovascular system[J]. Chinese Journal of Pathophysiology,2010,26(2):409-13.
[12]吴博,张伟华,李全凤,等. 钙敏感受体在缺氧-复氧诱导的大鼠心肌细胞凋亡中的作用[J]. 中国病理生理杂志,2007,23(7):1249-53.
[13]刘畅,王庸晋,曹文君. 丹参酮ⅡA对大鼠心肌细胞H9C2氧化损伤的保护作用[J]. 国际心血管病杂志,2015,42(4):261-3.
[14]武艳强,王慧娟,冯社军,等. 水飞蓟宾对H2O2诱导大鼠H9C2心肌细胞氧化应激损伤的保护作用[J]. 现代药物与临床,2015,30(5):503-8.
[15]Frustaci A,Russo MA,Morgante E,et al. Oxidative myocardial damage in human cocaine-related cardiomyopathy[J]. European Journal of Heart Failure,2015,17(3):283-90.
[16]Ran K,Zou DQ,Xiao YY,et al. Effects of isoflurane preconditioning in the delayed phase on myocardial tumor necrosis factor alpha levels and caspase-3 protein expression in a rabbit model of ischemiareperfusion injury.[J]. Genetics & Molecular Research Gmr, 2015,14(3):7267-73.
[17]朵杰,汪晓洲. 芹菜素与老年大鼠缺血心肌细胞凋亡及Bcl-2、Bax、Caspase-3表达的相关性[J]. 中国老年学杂志,2017,37(1):54-6.
[18]刘胜中,杨双强. TTX通过JAK2/STAT3通路活化SOD减轻心肌细胞凋亡[J]. 重庆医科大学学报,2010,35(1):64-7.
[19]Lu FH,Fu SB,Leng X,et al. Role of the calcium-sensing receptor in cardiomyocyte apoptosis via the sarcoplasmic reticulum and mitochondrial death pathway in cardiac hypertrophy and heart failure[J]. Cellular Physiology and Biochemistry,2013,31(4-5):728-43.
[20]Zhang C,Miller CL,Brown EM,et al. The calcium sensing receptor:from calcium sensing to signaling[J]. Science China Life Sciences,2015,58(1):14-27.

