BAG-1蛋白及其对神经系统疾病调控研究进展
张亚婷, 靳小艳, 钟国徽, 厉建伟, 李英贤*, 马雪梅
1.北京工业大学生命科学与生物工程学院, 北京 100124;2.中国航天员科研训练中心, 北京 100094
BAG-1蛋白作为BAG蛋白家族中第一个被确定的成员,最早是由Takayama等[1]在哺乳动物细胞质中发现的,经与Bcl-2家族蛋白比对无明显的同源序列,可与Bcl-2蛋白发生结合,协同促进抗凋亡作用。BAG-1包含多个功能结构域,可通过不同结构域作用于相应的靶分子,如Bcl-2、Hsp70/Hsc70、Raf-1、类固醇激素受体和DNA等,从而抑制细胞凋亡、影响基因转录、促进细胞增殖等。神经系统疾病的发病机制及病因复杂多样,研究发现,BAG-1在多种神经系统疾病的发生发展过程中均具有潜在的调控作用,因此,深入研究BAG-1的结构和功能可以进一步阐明神经系统疾病的潜在发病机制,并且有可能使其成为治疗神经系统疾病的潜在靶点。本文综述了BAG-1的结构、各结构域的基本功能及其对神经系统疾病的影响的相关研究,以期为神经系统疾病的研究和治疗提供参考。
1 BAG-1基本结构
人类BAG-1基因包含7个外显子,位于9p12号染色体,而小鼠的位于9q34号染色体[2]。BAG-1基因编码的蛋白有4个亚型:BAG-1L(p50,50 kDa)、BAG-1M(p46/RAP46/HAP46,46 kDa)、BAG-1S(p33,33 kDa)、p29(29 kDa),由1条mRNA分别从4个起始位点:CUG、AUG、AUG(第二个)、AUG(第三个)翻译而成[3]。由于其翻译的起始位点不同,BAG-1蛋白各亚型间具有不同的N末端、相同的C末端。人源细胞或组织中主要表达BAG-1L、BAG-1M和BAG-1S,极少表达p29;由于第一个AUG密码子不保守,所以,鼠源细胞或组织中不表达BAG-1M,仅表达BAG-1L和BAG-1S[4]。BAG-1蛋白(4个亚型)共有219个氨基酸残基,包括BAG-1结构域(BAG domain)、泛素样结构域(ubiquitin-like domain,ULD)、酸性氨基酸残基TRSEEX重复序列(TRSEEX repeats)和核定位序列(nuclear localization signal,NLS)等功能结构域[5]。人类BAG-1蛋白结构如图1A所示。BAG-1蛋白在不同物种中保守性均较高,且均具有高度保守的BAG结构域和ULD结构域(图1B)。

图1 BAG-1蛋白家族及基本结构Fig.1 The BAG-1 protein family members and their structural domains.A:人类BAG-1蛋白结构图;B:BAG-1蛋白在不同物种中的保守性以及保守的BAG和ULD结构域。图B中颜色越深代表同源性越高,深色区域所占比例越高,代表保守性较高。
2 BAG-1蛋白各结构域的功能
2.1 BAG结构域的功能
BAG结构域由110~124个氨基酸构成,内部可形成3个30~40个氨基酸长度且反向平行的α螺旋[6,7]。研究发现,α1和α2可与Raf-1相互作用;而α2和α3含有高度保守的氨基酸残基,可与Hsp70/Hsc70、Bcl-2相互作用[8,9]。
抗凋亡蛋白Bcl-2在线粒体凋亡通路中对于调节细胞凋亡起着重要作用。BAG-1通过BAG 结构域可与Bcl-2的C末端疏水区结合而形成复合体,从而抑制细胞色素C等凋亡相关因子从线粒体内膜释放到细胞质,并进一步抑制半胱天冬酶等的激活,增强Bcl-2的抗凋亡作用[9]。而不同BAG-1亚型对于增强Bcl-2的抗凋亡效果也不同[1,10]。
Raf-1激酶既是Ras(rat sarcoma viral oncogene)蛋白的效应物,又是胞外信号调控激酶(extracellular-signal regulated protein kinase,ERK)信号通路中的重要组分,是活化的Ras和ERK之间的一个重要分子,BAG-1可通过BAG-1结构域以弱亲和力方式结合Raf-1的催化结构域,也可以不依赖Ras的方式激活Raf-1,从而使Raf-Mek-Erk信号转导通路激活,促进细胞增殖、分化,抑制细胞凋亡等[11,12]。
Hsp70/Hsc70具有多种生物学功能,包括分子伴侣作用、抗细胞凋亡、提高细胞的应激耐受性、促进细胞增殖等。BAG-1通过BAG-1结构域与Hsp70/Hsc70的N末端ATP酶域结合,形成BAG-1-Hsp70复合体;BAG-1也可作为辅分子伴侣,以核苷酸交换因子的方式直接调节Hsp70/Hsc70的活性[13,14]。BAG-1通过与Hsp70结合,可进一步与糖皮质激素受体(glucocorticoid receptor,GR)结合形成复合体,从而影响GR的转录激活活性以及GR与DNA的结合等[15]。不同BAG-1亚型对Hsp70/Hsc70的调节功能不同,如BAG-1M阻滞Hsp70/Hsc70的多肽底物再折叠,而BAG-1S可促进分子伴侣活性[16]。研究发现,Hsp70和Raf-1可竞争性结合BAG-1,如在应激条件下,高表达的Hsp70可抑制BAG-1与Raf-1的结合,从而减弱Raf-1信号转导途径,抑制DNA合成和细胞增殖。而BAG-1 C204或E208位点突变后不能与Hsp70相互作用,同样,Hsp70的F245S、R262W、L282R位点突变可降低Hsp70与BAG-1的相互作用,但均不影响BAG-1与Raf-1之间的结合[17]。目前发现小分子复合物Thioflavin S[18]以及Thioflavin S的衍生物Thio-2[19]可在不影响BAG-1表达的条件下显著降低BAG-1与Hsc70以及BAG-1与Raf-1之间的相互作用。
2.2 其他结构域的功能
2.2.1泛素样结构域 BAG-1所有亚型N末端都包含1个泛素样结构域(ubiquitin-like domain,ULD),其可共价结合到靶蛋白上,促进蛋白酶体降解靶蛋白。BAG-1可以稳定的方式与26S蛋白酶体结合,促进蛋白酶体降解靶蛋白[20]。BAG-1还可作为结合蛋白酶体与Hsp70伴侣分子复合体的衔接分子[21]。BAG-1与具有E3泛素连接酶活性的CHIP(carboxy terminus of Hsp70 interacting protein)、Hsp70形成三元复合物降解靶蛋白,同时BAG-1通过依赖于CHIP的泛素化参与到蛋白酶体的调控网络中,在此过程中,BAG-1 ULD区可增强CHIP靶向蛋白的作用[20,22]。
2.2.2酸性氨基酸残基TRSEEX重复序列和六肽重复序列GARRPR BAG-1各亚型的N末端含有不同数量的TRSEEX重复序列(TRSEEX repeats),人类BAG-1L和BAG-1M含有9个此序列,BAG-1S含有3个,而p29不含此序列,鼠BAG-1蛋白中含有类似的重复序列,但功能尚不清楚,推测其参与了DNA的结合与转录激活[23],也可能对于调节GR的功能起重要作用[15]。研究发现,在BAG-1L N末端的6~11位和66~71位鉴定出1种新的六肽重复序列“GARRPR”,可通过与雄激素受体(androgen receptor,AR)的BF-3区域相互作用而调控AR活性,这些位点突变可破坏BAG-1L与AR的结合,但不影响BAG-1L与染色质的结合[24]。
2.2.3核定位序列 核定位序列(nuclear localization signal,NLS)可影响蛋白质的定位,进而影响其功能和活性,而BAG-1蛋白各亚型在细胞中的定位因所含NLS不同而存在差异。一般情况下,对于相对分子质量最大的BAG-1L来说,因其N端包含完整长度的NLS,所以主要定位于细胞核;BAG-1M包含少量的NLS,可同时定位于细胞质和细胞核;BAG-1S表达量最多,但缺乏NLS,主要定位于细胞质;p29表达量最少,同时也缺乏NLS,主要分布在细胞膜[5]。而对于不同细胞类型,亚型的定位也不一致,例如在人急性T淋巴细胞白血病细胞系细胞(JurkatT细胞)中,BAG-1L、BAG-1M和BAG-1S均定位在细胞质[25]。当细胞所处状态不同时,BAG-1亚型定位也会发生改变,例如,细胞受热激时,BAG-1M可从细胞质易位到细胞核,进一步增强细胞转录作用[23];神经元发育期间BAG-1主要定位于细胞核,而在神经元分化期间BAG-1可易位到细胞质[26]。研究发现,核定位的BAG-1L可正向调控类固醇受体(steroid receptor)如雄激素受体(androgen receptor,AR)的功能,通过使用猴病毒(SV40)抗原蛋白NLS对定位于细胞质的BAG-1M和BAG-1S进行标记,发现NLS-BAG-1M和NLS-BAG-1S向细胞核定位,从而可正向调控AR。
综上所述,BAG-1具有不同功能的结构域,同时,BAG-1可作用于Bcl-2、Hsp70/Hsc70、Raf-1、类固醇激素受体和DNA,从而抑制细胞凋亡、促进细胞增殖、影响蛋白质降解及基因转录活性等(图2)。
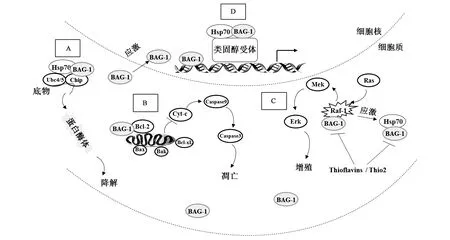
图2 BAG-1蛋白的生物学功能Fig.2 The biological function of BAG-1.A:BAG-1可与具有E3泛素连接酶活性的CHIP、Hsp70等形成复合物,从而促进靶蛋白降解;B:BAG-1可与Bcl-2结合,通过影响线粒体凋亡通路来抑制细胞凋亡;C:BAG-1可与Raf-1结合,通过影响Raf-Mek-Erk信号通路以促进细胞增殖;D:BAG-1和Hsp70可以协同结合类固醇激素受体(steroid receptor),从而影响类固醇激素受体(如GR)的转录激活活性以及GR与DNA的结合等。
3 BAG-1对神经系统疾病影响的研究概况
目前,研究表明BAG-1在神经系统的发生发展过程中发挥着重要作用,如在BAG-1基因敲除的小鼠胚胎中,神经元大量凋亡,并且在11.5~12.5 d时胚胎死亡[30];当轴突切断和短暂性脑缺血致神经元损伤时,BAG-1蛋白表达显著降低[31];在神经元分化过程中,BAG-1蛋白从细胞核易位到细胞质,由此推测BAG-1可能是神经元分化和发育的调节因子和标志物[26,32]。已有研究显示,BAG-1在阿尔茨海默病、帕金森氏病、亨廷顿舞蹈病、脑中风、脊髓损伤以及神经精神障碍疾病等神经系统疾病的发生发展过程中发挥着重要调控作用,而BAG-1有望成为神经系统疾病治疗中的潜在靶点。
3.1 BAG-1与阿尔茨海默病
阿尔茨海默病(Alzheimer disease,AD)是常见的神经退行性疾病,主要表现为记忆力损害和认知障碍。β-淀粉样蛋白(β-amyloid protein,Aβ)聚集形成的脑神经细胞外老年斑(senile plaques,SP)以及Tau蛋白异常聚集形成的脑神经细胞内神经原纤维缠结(neur ofibrillary tangles,NFT)是AD疾病的主要病理特征[33],但是对于导致Aβ及Tau蛋白产生及聚集的机制尚不清楚。Elliott等[34]发现,在AD小鼠模型中BAG-1以依赖于Hsc70的方式与Tau蛋白结合,从而抑制Tau蛋白被蛋白酶体降解,同时在胚胎癌细胞(P19细胞)中过表达BAG-1S可显著增加Tau蛋白的表达水平。Elliott等[35]还在AD患者大脑海马中发现BAG-1M表达显著增加,BAG-1可与细胞内Tau蛋白和Aβ发生结合,同时在神经2a细胞中过表达BAG-1M,也可显著增加Tau蛋白和Aβ前体蛋白(amyloid precursor protein,APP)的表达水平,但其机制尚不清楚。β-淀粉样蛋白前体蛋白裂解酶 1(β-amyloid precursor protein cleavage enzyme 1,BACE1)为体内的β分泌酶,是Aβ产生过程中重要的蛋白酶[36]。Shi等[37]发现BAG-1M可与结合在BACE1基因启动子区的NF-κB相互作用形成复合体,从而促进BACE1转录、APP剪切以及Aβ产生。因此,在AD小鼠中过表达BAG-1M可加速神经炎斑块的产生,从而加重AD症状。由于AD起病隐蔽,早期症状不明显,但其分子病理变化的出现要比临床症状早,因此,筛选发现具有敏感性和特异性的早期生物学指标具有重要的临床意义。上述研究表明,BAG-1作为Tau蛋白及Aβ降解中的关键的调节分子,有望成为AD患者研究和诊断的生物学指标之一,而寻找靶向BAG-1M-NF-κB复合体的药物对于治疗AD提供了新的研究思路。
3.2 BAG-1与帕金森氏病
帕金森氏病(Parkinson disease,PD)是继阿尔茨海默病之后的第二大常见的神经退行性疾病,其主要的症状有运动迟缓、发呆、震颤、体位不平衡等。α-突触核蛋白基因突变可导致罕见的遗传性PD的发生[38]。Kermer等[39]研究发现,过表达BAG-1可显著降低α-突触核蛋白突变体(A30P、A53T)瞬时过表达对人神经母细胞瘤细胞(SH-SY5Y细胞)产生的毒性效应,此外,研究还发现过表达BAG-1对较低浓度(0.25 μmoL和0.5 μmoL)鱼藤酮诱导的SH-SY5Y细胞死亡具有保护作用,同时可抑制1-甲基-4-苯基1,2,3,6四氢吡啶(1-methy-4-phenyl 1,2,3,6 tetrahydropyridine,MPTP)诱导的PD小鼠黑质中多巴胺能神经细胞死亡。
研究表明,DJ-1基因缺失和点突变也可导致常染色体隐性遗传早发性PD的发生[40]。Deeg等[41]在SH-SY5Y细胞中发现,BAG-1蛋白C末端可与野生型DJ-1以及DJ-1 L166P突变型发生相互作用,正常情况下,野生型DJ-1以同源二聚体的形式广泛存在于细胞质、膜/细胞器中,且拥有分子伴侣活性,而DJ-1 L166P不仅在细胞核中大量存在,还伴随着二聚化水平显著降低、分子伴侣活性消失,进而影响细胞的存活,但这种异常表型可以通过BAG-1的共表达有所逆转。BAG-1共表达可恢复DJ-1亚细胞分布、二聚体形成和分子伴侣活性,并阻止DJ-1 L166P诱导的细胞死亡。在上述研究中,尽管对于BAG-1治疗PD的具体机制尚不清楚,但为治疗PD提供了新的研究思路。在PD诊疗中,BAG-1可能作为新的潜在的神经保护靶点。
3.3 BAG-1与亨廷顿舞蹈病
亨廷顿舞蹈病(Huntington disease,HD)是常染色体显性遗传的致命性神经退行性疾病。HD的主要病因是亨廷顿(huntingtin,htt)基因发生变异,产生了亨廷顿突变体(htt-mut),而这种突变体蛋白发生聚集可对神经元产生毒性作用[42]。Orr等[43]在HD小鼠模型中,发现雄鼠比雌鼠拥有更大的旋转性能缺陷,过表达BAG-1可显著改善HD雄鼠性别依赖性运动缺陷,降低雄性HD小鼠突触体中htt-mut蛋白水平,并且发现在肾上腺髓质嗜铬瘤分化细胞株(PC12细胞)中过表达BAG-1可缓解由htt-mut造成的长神经突数目降低的现象,而且,同时过表达Hsp70和BAG-1时效果增强。Jana等[44]发现BAG-1可通过Hsc70/Hsp70与htt-mut聚合体结合,从而抑制htt-mut诱导小鼠神经2a细胞死亡。htt-mut可被蛋白酶caspase剪切,并产生包含有多聚谷氨酰胺序列的N末端片段,而htt的N末端片段核易位是htt-mut产生毒性促使HD发生的关键。Sroka等[45]在以黑腹果蝇建立的HD模型中发现,过表达BAG-1可阻止由htt-mut诱导的感光细胞数目的减少和破坏。同时,在CSM 14.1细胞中通过过表达htt-mut的N端片段建立HD细胞模型,发现过表达BAG-1可显著降低htt-mut在细胞中的聚集及其在细胞核中的表达,同时降低内源性E3泛素连接酶Siah1水平,而Siah1可与甘油醛3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehy drogenase,GAPDH)、htt-mut形成复合体,从而促使htt-mut发生核转移。由此推测BAG-1发挥保护作用的可能机制:BAG-1与Siah1结合,通过蛋白酶体途径降低Siah1水平,从而阻止htt-mut、GAPDH、Siah1形成入核复合物,进而避免htt-mut入核产生毒性;BAG-1直接通过蛋白酶体促进htt-mut的降解。综上所述,BAG-1不但可作为HD性别依赖性运动缺陷的调节剂,而且对于调节体内和体外htt-mut毒性、抑制HD发生发展具有重要作用,有望成为治疗HD的新靶点。
3.4 BAG-1与脑中风
脑中风,又称脑卒中或脑血管意外,是一种具有严重危害的脑血管疾病。在脑中风的体内外模型研究中,Kermer等[46]发现从BAG-1转基因小鼠大脑皮层中培养的神经元可显著抑制L-谷氨酸(50 μmoL,20 min)诱导的细胞凋亡,同时发现在通过动脉暂时性闭塞建立的BAG-1转基因小鼠脑中风模型中,脑梗死体积以及小鼠死亡率显著降低,并且在脑组织中发现Hsp70/Hsc70蛋白水平显著升高,而Hsp70/Hsc70的mRNA水平无明显变化,由此推测BAG-1可能是通过升高Hsp70/Hsc70的转录后修饰水平来降低中风造成的细胞损伤。目前,脑中风有2种类型:缺血性和出血性,80%以上为缺血性中风,主要是由脑内动脉阻塞等引起相应脑区缺血缺氧,进而导致神经元损伤及神经系统功能失调。廖亮英等[47]发现补阳还五汤(临床上治疗中风的一种常用药剂)能通过上调脑缺血损伤后BAG-1蛋白的表达,促进神经功能恢复。Wang等[48]发现在SH-SY5Y细胞中,BAG-1L能够通过促进Hsp70蛋白表达、激活PI3K/AKT信号通路来抑制缺血缺氧/再给氧8 h造成的细胞活性降低及细胞凋亡。以上研究直接或间接显示BAG-1在中风引起的神经损伤中发挥着重要的调控作用。
3.5 BAG-1与脊髓损伤
脊髓损伤是由多种致病因素造成的脊髓结构与功能的损害,可导致不同程度的神经元和胶质细胞的凋亡、坏死以及轴突断裂和脱髓鞘等[49]。因此,挽救受损神经元、促进受损轴突再生成为治疗脊髓损伤的关键。陈晔等[50]研究发现在大鼠脊髓损伤后BAG-1与神经元、星形胶质细胞存在共定位,并且BAG-1在这2种细胞中表达上调,表明BAG-1可能参与了神经元的凋亡以及星形胶质细胞活化的病理生理过程。早期Planchamp等[51]在视神经损伤模型中发现过表达BAG-1可通过促进Raf-1信号转导和抑制Rho激酶活性,来促进细胞存活和轴突生长。同样地,Challagundla等[52]在红核脊髓束(大鼠脊髓损伤模型)中发现过表达BAG-1具有促进红核神经元存活、近端的轴突出芽再生以及恢复运动功能的作用。提示在脊髓损伤修复中BAG-1可能成为有效靶点。
3.6 BAG-1与神经精神障碍疾病
双相情感障碍(bipolar disorder,BPD)是一种常见的躁狂相与抑郁相反复发作的神经精神障碍疾病。在BPD疾病中,抑郁发作比躁狂发作更频繁、持续时间更长,而糖皮质激素(glucocorticoid,GC)水平升高、垂体-下丘脑-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA轴)功能亢进是抑郁相发生的典型病理学特征,而GR可介导HPA轴的负反馈调控,GR数量及功能异常可导致抑郁相的发生[53~55]。Zhou等[56]发现在锂剂或丙戊酸钠(临床上用来治疗BPD的心境稳定剂)长期处理的大鼠海马CA3区中BAG-1蛋白表达水平显著升高,并且发现锂剂或丙戊酸钠可通过依赖于BAG-1的方式抑制地塞米松诱导的GR异常核易位以及GR介导的基因转录。Katz等[57]研究发现在患有抑郁症的怀孕妇女中,BAG-1、FK506结合蛋白51(FK506 binding protein 51,FKBP51)等的mRNA水平随着孕期发展和抑郁症状加重而小幅升高,但在怀孕中后期BAG-1和FKBP51的mRNA水平的增加量低于无抑郁的怀孕妇女;还发现在外周血细胞中GR敏感性逐渐降低,推测与怀孕中后期BAG-1和FKBP51的mRNA水平升高有关。提示BAG-1可能在抑郁相疾病中起到潜在的调控作用。此外,Maeng等[58]在狂躁症与抑郁症的动物模型中发现,与野生型小鼠相比,神经元特异性的BAG-1转基因小鼠在安非他明诱导的快速运动(狂躁症模型)中恢复的更快;在强迫游泳、学习无助等实验(抑郁症模型)中具有更强的自发恢复能力;而BAG-1敲除的小鼠在学习无助实验中恢复的概率更低。以上研究表明BAG-1在调节神经精神障碍疾病中发挥着关键作用,而其发挥作用的具体机制尚不明确,需要更为深入的实验研究加以证明。
综上所述,BAG-1对神经系统的正常分化、发育、功能维持和存活、损伤修复等均具有重要的生物学作用,体内外实验均表明BAG-1可作为潜在的神经损伤调控靶点。因此,探究激活BAG-1的靶蛋白或安全有效的BAG-1激活剂可为HD、PD、脑中风、脊髓损伤以及神经精神障碍疾病的治疗提供新的解决思路。
4 展望
各类神经系统疾病给家庭和社会都带来了沉重的负担,但目前缺乏有效的治疗方法。越来越多的研究提示BAG-1在神经系统疾病中起到重要的调控作用,过表达BAG-1在一些神经损伤模型中也产生了显著的治疗效果。因此,以BAG-1为靶点可能成为研发各种治疗神经损伤药物的新方向。但是,目前关于BAG-1对神经系统疾病影响的研究仍需考虑及解决下列问题:①BAG-1蛋白具有不同的亚型,而对于体内每种亚型对神经系统损伤的调控效果是否一致仍不清楚;②BAG-1对各种神经损伤的调控作用的具体机制尚未完全理清;③BAG-1的临床实验相对较少,较多集中在细胞或动物实验,缺少临床数据。因此,更为清楚的探究BAG-1的生物学功能及其在各类神经系统疾病中所起的重要作用及机制,对了解各类神经系统疾病的成因及探索治疗方法具有重要的意义。
参 考 文 献
[1] Takayama S, Sato T, Krajewski S,etal.. Cloning and functional analysis of BAG-1: A novel Bcl-2-binding protein with anti-cell death activity[J]. Cell, 1995, 80(2): 279-284.
[2] Takayama S, Kochel K, Irie S,etal.. Cloning of cDNAs encoding the human BAG1 protein and localization of the humanBAG1 gene to chromosome 9p12[J]. Genomics, 1996, 35(3): 494-498.
[3] Pruitt K D, Brown G R, Hiatt S M,etal.. RefSeq: An update on mammalian reference sequences[J]. Nucleic Acids Res., 2013, 42:756-763.
[4] Yang X, Chernenko G, Hao Y,etal.. Human BAG-1/RAP46 protein is generated as four isoforms by alternative translation initiation and overexpressed in cancer cells[J]. Oncogene, 1998, 17(8): 981-989.
[5] Townsend P A, Cutress R I, Sharp A,etal.. BAG-1: A multifunctional regulator of cell growth and survival[J]. BBA-Rev. Cancer, 2003, 1603(2): 83-98.
[6] Kumar N,Gaur D,Masison D C,etal.. The BAG homology domain of Snl1 cures yeast prion [URE3] through regulation of Hsp70 chaperones[J]. Genes Genom. Genet., 2014, 4(3):461-470.
[7] Antoku K, Maser R S, Scully W J,etal.. Isolation of Bcl-2 binding proteins that exhibit homology with BAG-1 and suppressor of death domains protein[J]. Biochem. Bioph. Res. Co., 2001, 286(5): 1003-1010.
[8] 吴曙辉, 陈 翔, 龚 齐, 等. 多功能蛋白BAG-1的研究进展[J]. 医学综述, 2014, 20(7): 1183-1186.
[9] Kudoh M, Knee D A, Takayama S,etal.. Bag1 proteins regulate growth and survival of ZR-75-1 human breast cancer cells[J]. Cancer Res., 2002, 62(6): 1904-1909.
[10] Chen J, Xiong J, Liu H,etal.. Distinct BAG-1 isoforms have different anti-apoptotic functions in BAG-1-transfected C33A human cervical carcinoma cell line[J]. Oncogene, 2002, 21(46): 7050-7059.
[11] Wang H G, Takayama S, Rapp U R,etal.. Bcl-2 interacting protein, BAG-1, binds to and activates the kinase Raf-1[J]. Proc. Natl. Acad. Sci. USA, 1996, 93(14): 7063-7068
[12] Anderson L R, Sutherland R L, Butt A J.BAG-1 overexpression attenuates luminal apoptosis in MCF-10A mammary epithelial cells through enhanced RAF-1 activation[J]. Oncogene, 2010, 29(4): 527-538.
[13] BriknarováK, Takayama S, Brive L,etal.. Structural analysis of BAG1 cochaperone and its interactions with Hsc70 heat shock protein[J]. Nat. Struct. Mol. Biol., 2001, 8(4): 349-352.
[14] Sondermann H, Scheufler C, Schneider C,etal.. Structure of a Bag/Hsc70 complex: Convergent functional evolution of Hsp70 nucleotide exchange factors[J]. Science, 2001, 291(5508): 1553-1557.
[15] Schneikert J, Hübner S, Martin E,etal.. A nuclear action of the eukaryotic cochaperone RAP46 in downregulation of glucocorticoid receptor activity[J]. J. Cell Biol., 1999, 146(5): 929-940.
[16] Lüders J, Demand J, Papp O,etal.. Distinct isoforms of the cofactor BAG-1 differentially affect Hsc70 chaperone function[J]. J. Biol. Chem., 2000, 275(20): 14817-14823.
[17] Song J, Takeda M, Morimoto R I. Bag1-Hsp70 mediates a physiological stress signalling pathway that regulates Raf-1/ERK and cell growth[J]. Nat. Cell Biol., 2001, 3(3): 276-282.
[18] Sharp A, Crabb S J, Johnson P W M,etal.. Thioflavin S (NSC71948) interferes with Bcl-2-associated athanogene (BAG-1)-mediated protein-protein interactions[J]. J. Pharmacol. Exp. Ther., 2009, 331(2): 680-689.
[19] Enthammer M, Papadakis E S, Gachet M S,etal.. Isolation of a novel thioflavin S-derived compound that inhibits bag-1-mediated protein interactions and targets BRAF inhibitor-resistant cell lines[J]. Mol. Cancer Ther., 2013, 12(11): 2400-2414.
[20] Lüders J, Demand J, Höhfeld J. The ubiquitin-related BAG-1 provides a link between the molecular chaperones Hsc70/Hsp70 and the proteasome[J]. J. Biol. Chem., 2000, 275(7): 4613-4617.
[21] Demand J, Alberti S, Patterson C,etal.. Cooperation of a ubiquitin domain protein and an E3 ubiquitin ligase during chaperone/proteasome coupling[J]. Curr. Biol., 2001, 11(20): 1569-1577.
[22] 魏瑞敏, 谢玲玲, 欧阳娴, 等. 植物BAG蛋白家族的结构及其功能特征综述[J]. 湖南农业科学, 2016(9):115-120.
[23] Zeiner M, Niyaz Y, Gehring U. The hsp70-associating protein Hap46 binds to DNA and stimulates transcription[J]. Proc. Natl. Acad. Sci., 1999, 96(18): 10194-10199.
[24] Jehle K, Cato L, Neeb A,etal.. Coregulator control of androgen receptor action by a novel nuclear receptor-binding motif[J]. J. Biol. Chem., 2014, 289(13): 8839-8851.
[25] Takayama S, Krajewski S, Krajewska M,etal.. Expression and location of Hsp70/Hsc-binding anti-apoptotic protein BAG-1 and its variants in normal tissues and tumor cell lines[J]. Cancer Res., 1998, 58(14): 3116-3131.
[26] Liman J, Faida L, Dohm C P,etal.. Subcellular distribution affects BAG1 function[J]. Brain Res., 2008, 1198: 21-26.
[27] Knapp R T, Steiner A, Schmidt U,etal.. BAG-1 diversely affects steroid receptor activity[J]. Biochem. J., 2012, 441(1): 297-303.
[28] Shatkina L, Mink S, Rogatsch H,etal.. The cochaperone Bag-1L enhances androgen receptor action via interaction with the NH2-terminal region of the receptor[J]. Mol. Cell. Biol., 2003, 23(20): 7189-7197.
[29] Cato L, Neeb A, Brown M,etal.. Control of steroid receptor dynamics and function by genomic actions of the cochaperones p23 and Bag-1L[J]. Nucl. Recept. Signal., 2014, 12: e005.
[30] Götz R, Wiese S, Takayama S,etal.. Bag1 is essential for differentiation and survival of hematopoietic and neuronal cells[J]. Nat. Neurosci., 2005, 8(9): 1169-1178.
[31] Hayashi T, Sakai K, Sasaki C,etal.. Loss of Bag-1 immunoreactivity in rat brain after transient middle cerebral artery occlusion[J]. Brain Res., 2000, 852(2): 496-500.
[32] Elliott E, Ginzburg I. BAG-1 is preferentially expressed in neuronal precursor cells of the adult mouse brain and regulates their proliferationinvitro[J]. FEBS Lett., 2009, 583(1): 229-234.
[33] Apostolova L G. Alzheimer disease[J]. Continuum, 2016, 22(2):419-434.
[34] Elliott E, Tsvetkov P, Ginzburg I. BAG-1 associates with Hsc70·Tau complex and regulates the proteasomal degradation of Tau protein[J]. J. Biol. Chem., 2007, 282(51): 37276-37284.
[35] Elliott E, Laufer O, Ginzburg I. BAG-1M is up-regulated in hippocampus of Alzheimer’s disease patients and associates with tau and APP proteins[J]. J. Neurochem., 2009, 109(4): 1168-1178.
[36] Sun J, Roy S. The physical approximation of APP and BACE-1: A key event in alzheimer’s disease pathogenesis[J]. Dev. Neurobiol., 2018, 78(3): 340-347.
[37] Shi Z, Hong Y, Zhang K,etal.. BAG-1M co-activates BACE1 transcription through NF-κB and accelerates Aβ production and memory deficit in Alzheimer’s disease mouse model[J]. BBA Mol. Basis Dis., 2017, 1863(9): 2398-2407.
[38] Nussbaum R L. The identification of alpha-synuclein as the first Parkinson disease gene[J]. J. Parkinson. Dis., 2017, 7(1): 43-49.
[39] Kermer P, Köhn A, Schnieder M,etal.. BAG1 is neuroprotective ininvivoandinvitromodels of Parkinson’s disease[J]. J. Mol. Neurosci., 2015, 55(3): 587-595.
[40] Hijioka M, Inden M, Yanagisawa D,etal.. DJ-1/PARK7: A new therapeutic target for neurodegenerative disorders[J]. Biol. Pharm. Bull., 2017, 40(5): 548-552.
[41] Deeg S, Gralle M, Sroka K,etal.. BAG1 restores formation of functional DJ-1 L166P dimers and DJ-1 chaperone activity[J]. J. Cell Biol., 2010, 188(4): 505-513.
[42] Jansen A H P, van Hal M, Meier R T,etal.. Frequency of nuclear mutant huntingtin inclusion formation in neurons and glia is cell-type-specific[J]. Glia, 2017, 65(1): 50-61.
[43] Orr A L, Huang S, Roberts M A,etal.. Sex-dependent effect of BAG1 in ameliorating motor deficits of Huntington disease transgenic mice[J]. J. Biol. Chem., 2008, 283(23): 16027-16036.
[44] Jana N R, Nukina N. BAG-1 associates with the polyglutamine-expanded huntingtin aggregates[J]. Neurosci. Lett., 2005, 378(3): 171-175.
[45] Sroka K, Voigt A, Deeg S,etal.. BAG1 modulates huntingtin toxicity, aggregation, degradation, and subcellular distribution[J]. J. Neurochem., 2009, 111(3): 801-807.
[46] Kermer P, Digicaylioglu M H, Kaul M,etal.. BAG1 over-expression in brain protects against stroke[J]. Brain Pathol., 2003, 13(4): 495-506.
[47] 廖亮英, 蔡光先, 周赛男. 补阳还五汤对局灶性脑缺血大鼠神经干细胞移植后Bag-1表达的影响[J]. 中医药信息, 2018(1): 38-42.
[48] Wang Y, Jia C, Li Q S,etal.. BAG-1L protects SH-SY5Y neuroblastoma cells against hypoxia/re-oxygenation through up-regulating HSP70 and activating PI3K/AKT signaling pathway[J]. Neurochem. Res., 2017, 42(10): 2861-2868.
[49] He Z, Jin Y. Intrinsic control of axon regeneration[J]. Neuron, 2016, 90(3): 437-451.
[50] 陈 晔, 赵 伟, 施小健, 等. BAG-1在大鼠损伤脊髓中的表达[J]. 江苏医药, 2012, 38(18): 2124-2126.
[51] Planchamp V, Bermel C, Tönges L,etal.. BAG1 promotes axonal outgrowth and regenerationinvivovia Raf-1 and reduction of ROCK activity[J]. Brain, 2008, 131(10): 2606-2619.
[52] Challagundla M, Koch J C, Ribas V T,etal.. AAV-mediated expression of BAG1 and ROCK2-shRNA promote neuronal survival and axonal sprouting in a rat model of rubrospinal tract injury[J]. J. Neurochem.,2015, 134(2):261-275.
[53] 秦红宁, 亓晓丽. 抑郁症糖皮质激素受体功能障碍机制:基因单核苷酸多态性及分子伴侣的作用[J]. 心理科学进展, 2013, 21(11):1949-1955.
[54] 张国双, 杨 坤. 抗抑郁新靶点-糖皮质激素受体[J]. 国际精神病学杂志, 2015, 42(1): 84-86.
[55] 安 磊, 李 静, 张有志, 等. 糖皮质激素受体:抑郁症治疗的潜在靶标[J]. 军事医学, 2014, 38(11): 908-911.
[56] Zhou R, Gray N A, Yuan P,etal.. The anti-apoptotic, glucocorticoid receptor cochaperone protein BAG-1 is a long-term target for the actions of mood stabilizers[J]. J. Neurosci., 2005, 25(18):4493-4502.
[57] Katz E R, Stowe Z N, Newport D J,etal.. Regulation of mRNA expression encoding chaperone and co-chaperone proteins of the glucocorticoid receptor in peripheral blood: Association with depressive symptoms during pregnancy[J]. Psychol. Med., 2012, 42(5): 943-956.
[58] Maeng S, Hunsberger J G, Pearson B,etal.. BAG1 plays a critical role in regulating recovery from both manic-like and depression-like behavioral impairments[J]. Proc. Natl. Acad. Sci. USA, 2008, 105(25): 8766-8771.

