抗生素-重金属双抗菌筛选及抗性研究
杨统一,盛冬雯,巢 波,杨 芬,姚志宇,唐玉斌
(江苏科技大学 环境与化学工程学院,镇江 212018)
在后抗生素时代,日渐增多的抗生素抗性菌严重威胁人类健康,全球面临抗生素失效的风险.土壤作为环境中最重要的抗性菌的储库之一,在研究中备受重视.现有研究表明抗生素并不是驱动土壤中抗生素抗性基因及水平转移的唯一因素,一些非抗生素物质,特别是重金属也能间接激发微生物抗生素抗性[1-2].
近年来,现代农业的多种种植措施,如大量使用含有多种抗生素残留和重金属元素(Cu、Zn等)的畜禽粪肥、重金属营养剂及抗生素类抑菌剂喷施,都加剧了农田土壤重金属和抗生素的复合污染[3].与抗生素的环境行为不同, 进入土壤中的重金属很难被降解, 作为一种广泛且顽固的选择性压力长期存在, 而可能通过协同作用进一步加剧微生物抗生素抗性.重金属与抗生素协同选择压力使环境中抗生素抗性微生物种群增加,形成新一代的抗性菌群[4-5],携带抗生素抗性基因的菌群在土壤中转移、传播和扩散,并使抗性种群在竞争中逐渐成为优势群落,从而改变自然微生物群落结构,这将极大地危害人类健康及土壤微生物的生态效应.
微生物修复被广泛用于水体和土壤污染,它是利用微生物对环境污染物的代谢作用而转化、降解污染物.通常采用促进土著微生物的代谢活性,从环境中分离、筛选降解菌及投加微生物和微生物制剂等方式[6-7].尽管抗生素具有抑菌和杀菌作用,环境中还是可能存在一些兼具耐药性和降解功能的专性降解菌,这些微生物菌株的分离和鉴定将有助于推动抗生素及其复合污染生物修复技术的开发与研究[8-9].本试验从重金属铜离子处理的土壤中筛选出抗生素与重金属交叉抗性菌株,通过研究Cu2+对抗生素抗性菌抗性的影响,以此为重金属和抗生素交叉污染环境的修复治理提供科学依据和借鉴.
1 实验
1.1 土样的采集与处理
土壤样品采集于2015年3月江苏科技大学西校区蚕业研究所桑园苗圃,按5点取样法采样,然后将收集到的所有土壤混匀,保存于-20℃冰箱.
1.2 抗生素溶液的配制
抗生素储备液使用灭菌的超纯水配制.采用0.22 μm水相滤膜将储备液过滤除菌,避光保存于-20℃冰箱,保存时间不超过一周.
1.3 培养基的制备
基础培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,蒸馏水1 000 ml,琼脂20 g,用1 mol/L的NaOH调节pH值为7.2~7.4.
抗生素培养基:基础培养基121 ℃灭菌20 min,冷却至50 ℃左右时,向其中添加抗生素储备液,使庆大霉素和链霉素的终浓度为32 mg/L,新霉素浓度为128 mg/L,青霉素、磺胺噻唑和头孢霉素的浓度为64 mg/L.
药敏试验培养基:基础培养基灭菌冷却至50℃左右时,向其中添加CuSO4储备液使Cu2+终浓度分别至0,25,50,75 mg/L.
1.4 土壤抗生素抗性菌的分离纯化
将土壤样品用灭菌的生理盐水制备成土壤悬液,经梯度稀释后,取100 μL均匀涂布于添加有相应抗生素的灭菌培养基平板上,每个土样3个平行,30 ℃培养48 h.挑取平板上的单菌落进行划线分离纯化,所用培养基仍为添加相应浓度的抗生素培养基.
1.5 生理生化鉴定
菌株的生理生化鉴定参照文献[10]进行,包括过氧化氢酶实验、硝酸盐还原实验、淀粉水解实验、糖醇发酵实验、产生吲哚实验、甲基红实验、柠檬酸盐的利用实验、V.P.实验、苯丙氨酸脱氢酶实验、硫化氢产气实验和革兰氏染色实验.
1.6 细菌的分子鉴定
基因组DNA的提取[11]:取一环单菌落于5 mL灭菌的LB培养基中,30 ℃,120 r/min摇床培养过夜.取1.5 mL过夜培养的菌液12 000 r/min离心2 min,弃上清,收集菌体;菌体中加500 μL无菌去离子水,-20 ℃冷冻一段时间后,100 ℃水浴5 min;涡旋30 s;重新冷冻,水浴,涡旋一次,12 000 r/min离心5 min,取上清,即为DNA模板,-20 ℃保存备用.
引物27-F:5’AGAGTTTGATCCTGGCTCAG3’和1492-R:5’GGTTACCTTGTTACGACTT 3’为16S rDNA上下游引物,扩增分离的细菌DNA[10, 12].测序结果提交GenBank,后用Blast软件将测序结果与GenBank中已知菌株的16S rDNA序列进行同源性比较,选取同源性较高的序列,利用MEGA 6.0软件构建株菌的系统发育树.
1.7 抗性菌株的交叉耐药性测试
1.7.1 不同浓度Cu2+对抗性菌株生长的影响
挑取纯化后的抗性菌株S-2于牛肉膏蛋白胨液体培养基中,30 ℃,120 r/min摇床培养过夜.取该菌液1 mL接种于100 ml灭菌的牛肉膏蛋白胨液体培养基中,并向液体培养基中添加Cu2+使其终浓度分别为0,50,100,200 mg/L,30 ℃,120 r/min摇床培养,每间隔几小时进行取样,测定600 nm时的OD值[13].
1.7.2 药敏实验
参考文献[14],先配好添加了0,25,50 mg/L的不同铜离子浓度的牛肉膏蛋白胨培养基,然后取抗性菌悬液涂布在添加了分别浸泡过磺胺噻唑、头孢拉定、链霉素、青霉素、庆大霉素、新霉素以及氨苄霉素的滤纸的牛肉膏蛋白胨培养基中,最后将其放置在恒温30 ℃的培养箱中培养.
1.7.3 不同浓度Cu2+对菌株抗生素抗性能力的影响
取1 mL活化后的S-2菌液接种于100 mL灭菌冷却至室温的牛肉膏蛋白胨液体培养基中,并添加链霉素、青霉素钠和磺胺噻唑,使终浓度分别为32、64和64 mg/L,同时添加Cu2+使其终浓度分别为0,50,100,200 mg/L,每个交叉抗性试验设置3个重复,30℃,120 r/min摇床培养,定时取样,测定OD600值.
2 实验结果与讨论
2.1 抗性菌株的鉴定
2.1.1 菌株生理生化特征
由图1和表1可知,S-2菌为革兰氏阳性菌,菌落为白色,不规则状,无光泽,边缘有锯齿,不透明,表面湿润平滑.生理生化鉴定表明该菌过氧化氢酶、淀粉水解、苯丙氨酸脱氢酶、硝酸盐还原、甲基红、硫化氢和吲哚实验呈阳性,而乳糖发酵、葡萄糖发酵、甘露醇发酵和V.P.实验呈阴性.
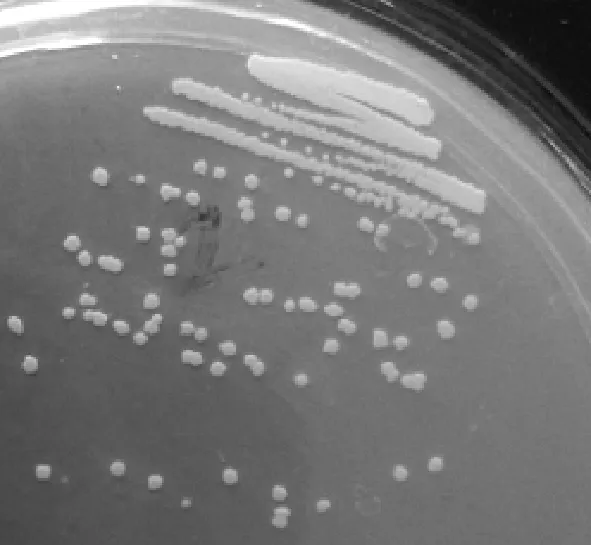
图1 菌株S-2菌落形态Fig.1 Colony of strain S-2表1 S-2菌株的生理生化鉴定Table 1 Physiological and biochemicalidentification of strain S-2

鉴定项目S-2鉴定项目S-2乳糖发酵-硝酸盐还原+葡萄糖发酵-甲基红+甘露醇发酵-V.P.-过氧化氢酶+硫化氢+淀粉水解+吲哚+苯丙氨酸脱氢酶+革兰氏染色+
注:“+” 阳性;“-” 阴性
2.1.2 基于16S rDNA 基因序列的系统发育分析
将体外扩增的细菌16S rDNA 基因扩增产物进行测序后,序列提交GenBank,获得登录号KT283097.利用Blast进行序列同源性分析,结果表明菌株S-2与Streptomyces sp.ABF2(KX010118.1)具有86%的相似性,在 NCBI 中选取与菌株S-2亲缘关系较近的菌株序列构建系统发育树(图2).

图2 菌株S-2的16S rDNA基因系统发育树分析Fig.2 Phylogenetic tree based on 16S rDNAgene sequences of strain S-2
2.2 Cu2+对抗性菌生长周期的影响
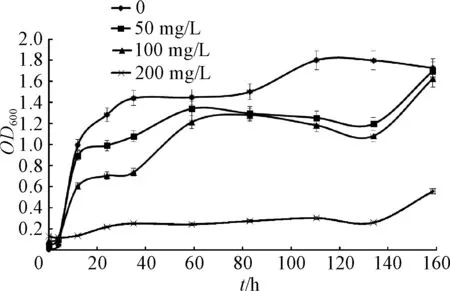
图3 不同浓度Cu2+对抗性菌株生长的影响Fig.3 Effect of different concentrations of Cu2+on the growth of strain S-2
由图3可知,在Cu2+浓度为0时,菌株S-2均在6 h左右开始进入对数生长期,40 h左右生长速度减慢,开始逐步进入稳定期.Cu2+浓度为50,100 mg/L时,对S-2对数期影响不大,对稳定期的菌体浓度影响较大;当Cu2+浓度达到200 mg/L时,S-2对数期表现不明显,菌体浓度一直缓慢增加,140 h后生长速度有加快趋势.综合来说菌株的生长是受到了Cu2+的抑制,且抑制程度随Cu2+浓度的增加而逐渐增强.但菌株S-2在经过一定时间的调整适应后仍能够进行正常的生长繁殖,进入稳定期,说明对Cu2+还是有一定抗性的.文献[15]在重金属铜的土壤微生物毒性研究中发现低浓度铜对土壤微生物量有显著刺激作用,高浓度时则有抑制作用,与本实验结果相似.
2.3 抗性菌株对七种抗生素的药敏实验
抗性菌的药敏试验纸片法的抑菌范围参考标准见表2,试验结果见表3.

表2 药敏试验参考标准Table 2 Reference standard of Susceptibility testing
由表2和3可知,没有Cu2+离子存在时,菌株S-2对青霉素钠和磺胺噻唑敏感,而对其他5种抗生素均为耐药.当Cu2+浓度为25 mg/L时,磺胺噻唑和青霉素试纸周围抑菌圈增大,说明随着铜离子浓度的升高,铜离子与磺胺噻唑和青霉素钠共存时为协同杀菌作用[16-17].当Cu2+浓度为50 mg/L时,抑制了S-2的生长,但链霉素S周围仍可长出少量菌落,表明S-2菌株对链霉素与50 mg/L铜离子具有交叉抗性.

表3 菌株S-2药敏试验结果Table 3 Antibiotics sensitive tests of strainS-2 Drug sensitive test
注:R表示耐药,I表示中介,S表示敏感
2.4 Cu2+对菌株抗生素抗性的影响

图4 不同Cu2+浓度和链霉素对S-2菌株的影响Fig.4 Effect of streptomycin and different concentrationsof Cu2+ on growth of strain S-2
由图4可知,链霉素与不同浓度的Cu2+共存时,抗性菌S-2的适应期延长,且Cu2+浓度越大,S-2的适应期也越长,说明抗性菌S-2的生长受到的抑制作用与Cu2+的浓度有关.但经过较长的适应期后,抗性菌S-2仍能继续生长繁殖,说明S-2具有链霉素和Cu2+的交叉抗性,这与药敏试验的结果一致.S-2随Cu2+浓度的增大受到的抑制作用逐渐增强,说明Cu2+与链霉素之间表现为协同杀菌.
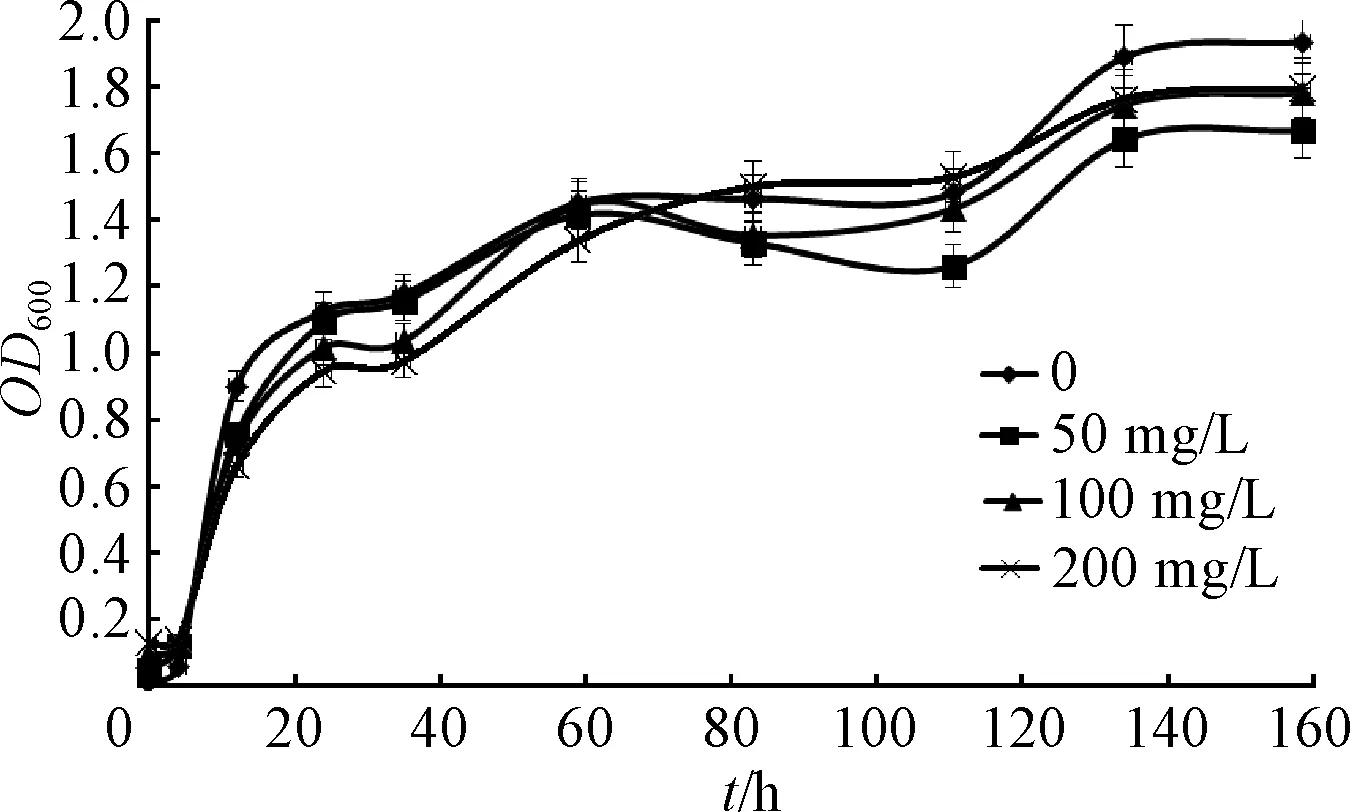
图5 不同Cu2+浓度和青霉素钠对S-2菌株的影响Fig.5 Effect of penicillin sodium and differentconcentrations of Cu2+ on growth of strain S-2
由图5可知,青霉素钠与不同浓度的Cu2+共存时,抗性菌S-2的生长与链霉素和Cu2+共存时的结果类似,但Cu2+浓度在0~200 mg/L范围时,对抗性菌S-2影响较小,说明S-2具有青霉素和Cu2+的交叉抗性,且抗性较强.

图6 不同Cu2+浓度和磺胺噻唑对S-2菌株的影响Fig.6 Effect of sulfathiazole and different concentrationsof Cu2+ on growth of strain S-2
由图6可知,磺胺噻唑与不同浓度的Cu2+共存时,抗性菌S-2的生长与链霉素和Cu2+共存时的结果类似,说明S-2具有磺胺噻唑和Cu2+的交叉抗性.S-2随Cu2+浓度的增大受到的抑制作用逐渐增强,说明Cu2+与磺胺噻唑之间表现为协同杀菌.文献[13]发现的低浓度重金属Cr6+或Zn2+和红霉素,Cu2+与头孢拉定共存时表现为协同抗性,高浓度为协同杀菌,可能与抗生素的种类以及细菌种类有关.
3 结论
(1) 综合抗性菌的生理生化特性及分子生物学分析,可初步鉴定菌株S-2与链霉菌(Stereptomyces)具有86%相似性;
(2) 抗性菌株S-2的生长会受到铜离子浓度的影响,但同时又对铜离子表现出一定的抗性;
(3) 药敏实验结果表明抗性菌株S-2具有多重耐药性,能够耐受链霉素、头孢拉定、庆大霉素、新霉素及氨苄霉素;
(4) 交叉抗性表明,抗性菌株S-2具有链霉素和Cu2+的交叉抗性,青霉素钠和Cu2+的交叉抗性及磺胺噻唑和Cu2+的交叉抗性.
参考文献(References)
[ 1 ] 李彬辉, 许燕滨, 赵欣欣, 等. 养殖废水中抗生素与重金属交叉抗性微生物的筛选及其抗性研究[J]. 中国农学报, 2012,28(11): 103-107.
LI Binhui,XU Yanbin,ZHAO Xinxin,et al.Screening on resistance strains of antibiotic and heavy metal from breeding waste water and its resistance research [J].Chinese Agricultural Science Bulletin,2012,28(11):103-107.(in Chinese)
[ 2 ] 张佳奇, 徐艳, 罗义, 等. 重金属协同选择环境细菌抗生素抗性及其机制研究进展[J]. 农业环境科学学报, 2016,35(3): 409-418.
ZHANG Jiaqi, XU Yan, LUO Yi, et al. Co-selection mechanisms of bacterial resistance to heavy metals and antibiotics. [J]. Journal of Agro-Environment Science, 2016, 35(3): 409-418. (in Chinese)
[ 3 ] 何利强. 浅谈畜牧业中抗生素的危害与控制[J]. 中国动物检疫, 2010, 27(4): 11-12.
HE Liqiang.Discussion on the harm and control of antibiotics in animal husbandry [J].Chinese Journal of Animal Health Inspection,2010,27(4):11-12.(in Chinese)
[ 4 ] ZHAO L,DONG YH,WANG H.Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J].Sci Total Environ,2010,408(5):1069-1075.DOI:10.1016/j.scitotenv.2009.11.014.
[ 5 ] ICGEN B, YILMAZ F. Co-occurrence of antibiotic and heavy metal resistance in KIzIlIrmak River isolates[J]. Bull Environ Contam Toxicol, 2014, 93(6): 735-743. DOI:10.1007/s00128-014-1383-6.
[ 6 ] HE Y, JIN L, SUN F, et al. Antibiotic and heavy-metal resistance of Vibrio parahaemolyticus isolated from fresh shrimps in Shanghai fish markets, China[J]. Environmental Science and Pollution Research, 2016, 23(15): 15033-15040. DOI:10.1007/s11356-016-6614-4.
[ 8 ] KUMAR M, KUMAR V, VARMA A, et al. An efficient approach towards the bioremediation of copper, cobalt and nickel contaminated field samples[J]. Journal of Soils and Sediments, 2016, 16(8): 2118-2127. DOI:10.1007/s11368-016-1398-1.
[ 9 ] DASH HR,DAS S.Diversity,community structure,and bioremediation potential of mercury-resistant marine bacteria of estuarine and coastal environments of Odisha,India[J].Environ Sci Pollut Res Int,2016,23(7):6960-6971.DOI:10.1007/s11356-015-5991-4.
[10] 杨统一, 高俊贤, 刘琦, 等. 邻苯二甲酸二丁酯高效降解菌的分离、鉴定及降解特性[J]. 江苏科技大学学报(自然科学版),2015,29(6): 607-611.
YANG Tongyi, GAO Junxian, LIU Qi, et al. Isolation and identification of highly efficient DBP-degrading strain and its degradation study [J]. Journal of Jiangsu University of Science and Technology (Natural Science Edition), 2015,29(6): 607-611. (in Chinese)
[11] 冯广达, 陈美标, 羊宋贞, 等. 用于PCR扩增的细菌DNA提取方法比较[J]. 华南农业大学学报, 2013,34(3): 439-442.
FENG Guangda, CHEN Meibiao, YANG Songzhen, et al. A comparative study on bacteria DNA extraction methods used for PCR amplification [J]. Journal of South China Agricultural University,2013,34(3): 439-442. (in Chinese)
[12] 高俊贤, 刘琦, 连梓竹, 等. 一株DBP高效降解菌的分离、鉴定与降解性能[J]. 环境工程学报, 2016,10(3): 1521-1526.
GAO Junxian,LIU Qi,LIAN Zizhu,et al.Isolation and identification of highly efficient DBP-degrading strain and its degradation study [J].Chinese Journal of Environmental Engineering,2016,10 (3):1521-1526.(in Chinese)
[13] 李淑英, 苏亚丽, 周元清, 等. 重金属胁迫培养对2种细菌生长曲线的影响[J]. 安徽农业科学, 2011,39(1): 443-446.
LI Shuying, SU Yali, ZHOU Yuanqing, et al. Effects of heavy metal stress on the growth curves of two kinds of bacteria[J]. Journal of Anhui Agricultural Sciences, 2011,39(1):443-446. (in Chinese)
[14] 冯邹达. 自家药敏纸片制备方法的建立及应用效果观察[J]. 中国畜禽种业, 2012,8(6): 39-40.
FENG Zouda.Establishment and application effect of their own susceptibility paper preparation process observation[J].Chinese Poultry seed Industry,2012,8(6):39-40.(in Chinese)
[15] 杨元根, PATERSON E, CAMPBELL C. 重金属Cu的土壤微生物毒性研究[J]. 土壤通报, 2002,33(2): 137-141.
YANG Yuangen,PATERSON E,CAMPBELL C.Study on microbial toxicity of heavy metal copper [J].Chinese Journal of Soil Science,2002,33(2):137-141.(in Chinese)
[16] 季秀玲, 魏云林, 林连兵. 细菌抗生素和重金属协同选择抗性机制研究进展[J]. 生物技术通报, 2010(5): 65-69.
JI Xiuling,WEI Yunlin,LIN Lianbing.Research advances on Co-selection resistant mechanisms of antibiotic and heavy metals resistance in bacteria [J].Biotechnology Bulletin,2010(5):65-69.(in Chinese)
[17] 温丽华, 许燕滨, 周艳, 等. 重金属胁迫对Pseudomon asalcaligenes LH7抗生素抗性的影响[J]. 生态学报, 2015,35(10): 3411-3418.
WEN Lihuang, XU Yanbin, ZHOU Yan,et al. Effects of heavy metal stress on antibiotics resistance of Pseudomonas alcaligenes LH7 [J]. Acta Ecologica Sinica,2015, 35(10): 3411-3418.(in Chinese)

